选修四2.3.2 影响化学平衡移动的因素 学案+随堂练习+课后练习(有答案)
文档属性
| 名称 | 选修四2.3.2 影响化学平衡移动的因素 学案+随堂练习+课后练习(有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-17 15:39:47 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2.3.2
影响化学平衡移动的因素
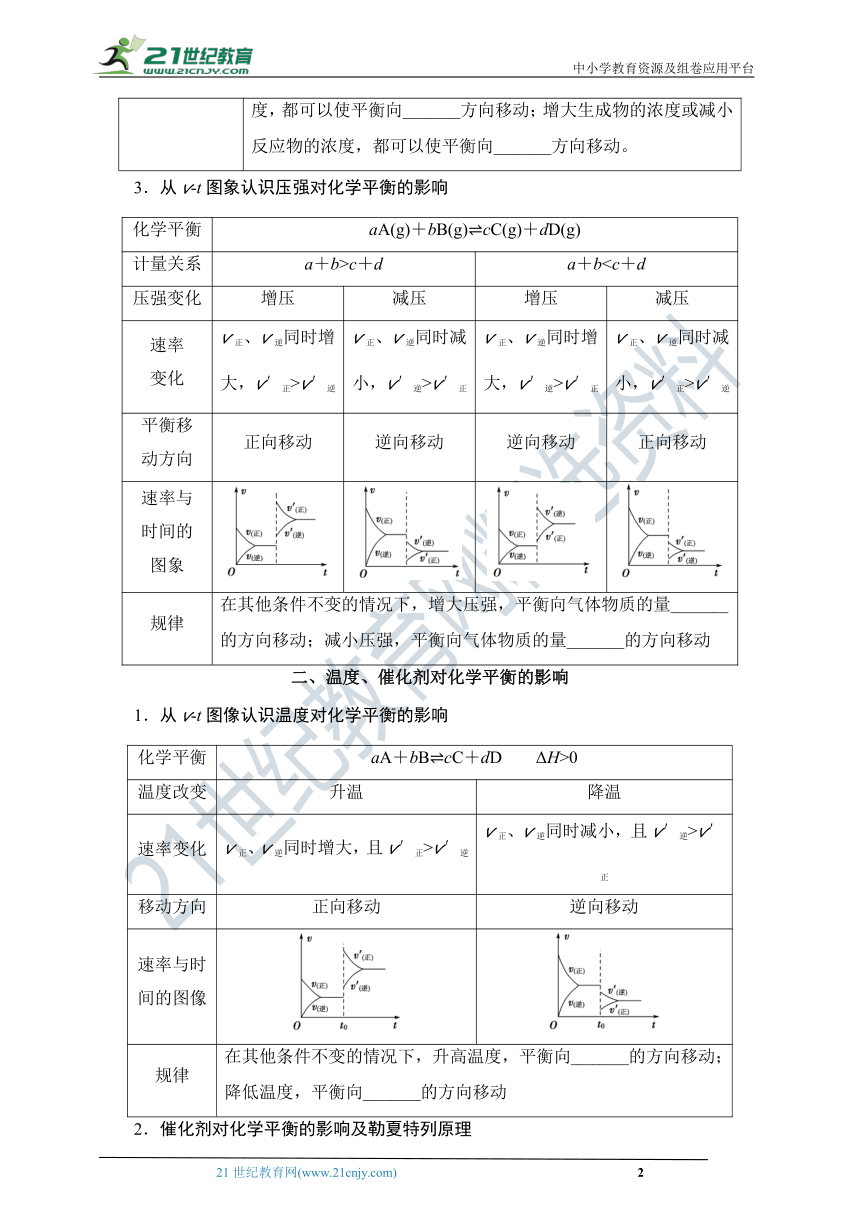
一、浓度、压强对化学平衡的影响
1.化学平衡移动
(1)含义:当一个可逆反应达到平衡后,如果改变________、________、________等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到____________。
(2)实质:改变条件后:
①v正________v逆。
②各组分的百分含量发生________。
(3)图示
2.从v?t图象认识浓度对平衡的影响
化学平衡
aA+bB?cC+dD(A、B、C、D为非固体)
体系浓度变化
增大反应物浓度
增大生成物浓度
减小生成物浓度
减小反应物浓度
速率变化
v正瞬间增大,v逆瞬间不变,v′正>v′逆
v逆瞬间增大,v正瞬间不变,v′逆>v′正
v逆瞬间减小,v正瞬间不变,v′正>v′逆
v正瞬间减小,v逆瞬间不变,v′逆>v′正
平衡移动方向
正向移动
逆向移动
正向移动
逆向移动
v?t图象
规律
在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向________方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向________方向移动。
3.从v?t图象认识压强对化学平衡的影响
化学平衡
aA(g)+bB(g)?cC(g)+dD(g)
计量关系
a+b>c+d
a+b压强变化
增压
减压
增压
减压
速率变化
v正、v逆同时增大,v′正>v′逆
v正、v逆同时减小,v′逆>v′正
v正、v逆同时增大,v′逆>v′正
v正、v逆同时减小,v′正>v′逆
平衡移动方向
正向移动
逆向移动
逆向移动
正向移动
速率与时间的图象
规律
在其他条件不变的情况下,增大压强,平衡向气体物质的量________的方向移动;减小压强,平衡向气体物质的量________的方向移动
二、温度、催化剂对化学平衡的影响
1.从v?t图像认识温度对化学平衡的影响
化学平衡
aA+bB?cC+dD
ΔH>0
温度改变
升温
降温
速率变化
v正、v逆同时增大,且v′正>v′逆
v正、v逆同时减小,且v′逆>v′正
移动方向
正向移动
逆向移动
速率与时间的图像
规律
在其他条件不变的情况下,升高温度,平衡向________的方向移动;降低温度,平衡向________的方向移动
2.催化剂对化学平衡的影响及勒夏特列原理
(1)催化剂对化学平衡的影响
①规律:
当其他条件不变时,催化剂________改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的________。
③v?t图象:
(2)勒夏特列原理
如果改变影响平衡的一个条件(如浓度、压强或温度),则平衡将向着能够________这种改变的方向移动。
三、化学平衡图象
1.常用物理量的名称和符号:化学反应速率为________,时间为________。温度为________,压强为________,物质的量为________,物质的量浓度为________,转化率为α。
2.在容积相同的密闭容器内,分别充入等量的N2和H2,在不同温度下,发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,绘图如下图:
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是________。
(2)此可逆反应的正反应是________反应。(填“放热”或“吸热”)。
3.常见的化学平衡图像分析
(1)图像题的解题思路
(1)一看点:即看线段的起点是否通过原点,两条线的交点或者线段的拐点等。
(2)二看线:看线段的走向和变化趋势。
(3)三看面:看清楚横坐标和纵坐标表示的物理量。
(4)四看要不要作辅助线:看是否需要作等温线或等压线。
(2)化学平衡图像的解题技巧
(1)“先拐先平,数值大”原则:
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
(2)“定一议二”原则:
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系或确定纵坐标所表示的量,讨论横坐标与曲线的关系。
参考答案:
2.3.2
影响化学平衡移动的因素
一、浓度、压强对化学平衡的影响
1.浓度
温度
压强
新的平衡
≠v逆
改变
2.正反应
逆反应
3.减小
增大
二、温度、催化剂对化学平衡的影响
1.吸热反应
放热反应
2.不能
时间
减弱
三、化学平衡图象
1.v
t
T
P
n
mol·L-1
2.A、B
放热
2.3.2
影响化学平衡移动的因素
随堂练习
一、浓度、压强对化学平衡的影响
1.下列叙述中说明某化学平衡一定发生移动的是( )
A.混合体系中气体密度发生变化
B.正、逆反应速率改变
C.混合物中各组分的浓度改变
D.反应物的转化率改变
2.下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.平衡状态
Ⅰ
到平衡状态
Ⅱ
是平衡发生正向移动
C.平衡状态
Ⅰ
到平衡状态
Ⅱ
是平衡发生逆向移动
D.平衡状态
Ⅰ
和平衡状态
Ⅱ
的反应速率不相等
3.Mg(OH)2在水中存在溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
A.NH4Cl
B.NaOH
C.MgCl2
D.Fe
4.已知反应mA(g)+nB(g)?pC(g) ΔH<0,m+n回答下列问题:
(1)表示反应物浓度增大的图像是________,表示反应物浓度减小的图像是________,表示生成物浓度增大的图像是________,表示生成物浓度减小的图像是________。
(2)表示平衡正向移动的图像是________,表示平衡逆向移动的图像是________。
5.一定温度下,反应C(s)+H2O(g)?CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是
( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①②
B.②③
C.①④
D.③④
6.密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)?2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,下列叙述正确的是( )
A.缩小容器的容积后,平衡正向移动
B.重新平衡后CaO的量减少
C.重新平衡后气体的质量不变
D.重新平衡后CaO2的量不变
7.mA(g)+nB(g)?pC(g)+qD(g),当反应达到平衡后,若压强改变,其v?t图像如下:
(1)图①表示的压强变化是________,平衡移动方向是向________方向。
(2)图②表示的压强变化是________,平衡移动方向是向________方向。
(3)m+n________p+q(填“>”、“=”或“<”)。
二、温度、催化剂对化学平衡的影响
1.已知反应A2(g)+2B2(g)?2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,A2的转化率增大
B.升高温度有利于反应速率增大,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
2.在容积不变的密闭容器中,一定条件下发生反应:2A?B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
3.mA(g)+nB(g)?pC(g),当反应达平衡后,若温度改变,其反应速率的变化曲线分别如下图所示:
(1)图①表示的温度变化是________,平衡移动方向是向________方向。
(2)图②表示的温度变化是________,平衡移动方向是向________方向。
(3)正反应是______热反应,逆反应是______热反应。
4.下列事实不能用勒夏特列原理解释的是
( )
A.用排饱和食盐水法收集Cl2
B.加压有利于合成氨反应
C.冰镇的啤酒打开后泛起泡沫
D.对2HI?H2+I2(g)平衡体系增加压强使颜色变深
5.已知:可逆反应2SO2(g)+O2(g)?2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是
( )
A.升温增压
B.降温增压
C.升温减压
D.降温减压
6.下列措施有利于反应:N2(g)+3H2(g)?2NH3(g) ΔH=-92
kJ·mol-1平衡向正反应方向移动的是( )
①升高温度 ②降低温度 ③增大压强
④减小压强⑤增大NH3浓度 ⑥减小NH3浓度
A.②④⑥
B.①③⑥
C.②③⑤
D.②③⑥
三、化学平衡图象
1.对于①N2(g)+3H2(g)?2NH3(g) ΔH<0
②2NH3(g)?N2(g)+3H2(g) ΔH>0
其中v?t图像为
(1)反应①
t1时刻改变的条件为_____________________________________________;
t2时刻改变的条件为_____________________________________________。
(2)反应②
t1时刻改变的条件为_____________________________________________;
t2时刻改变的条件为_____________________________________________。
2.一定条件下,A(g)+B(g)?C(g) ΔH<0,达到平衡后根据下列图象判断:
(1)升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”、“E”,下同),新平衡中C的体积分数______(填“增大”、“减小”、“不变”,下同)。
(2)减小压强,达到新平衡的是________,A的转化率________。
(3)减小C的量,达到新平衡的是________。
(4)增加A的量,达到新平衡的是_______,此时B的转化率_______,A的转化率_______。
(5)使用催化剂,达到新平衡的是________,C的质量分数________。
3.现有下列两个图象:
下列反应中符合上述图象的是( )
A.N2(g)+3H2(g)?2NH3(g) ΔH<0
B.2SO3(g)?2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)?4NO(g)+6H2O(g) ΔH<0
D.H2S(g)?H2(g)+S(s) ΔH>0
4.已知某可逆反应:mA(g)+nB(g)?pC(g) ΔH,在密闭容器中进行,如图所示,反应在不同时间t、温度T和压强p与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
A.T1>T2,p1>p2,m+n>p,ΔH>0
B.T1>T2,p1p,ΔH>0
C.T1D.T1p2,m+n>p,ΔH<0
5.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是( )
A.反应
Ⅰ:ΔH>0,p2>p1
B.反应
Ⅱ:ΔH<0,T1>T2
C.反应
Ⅲ:ΔH>0,T2D.反应
Ⅳ:ΔH<0,T2>T1
2.3.2
影响化学平衡移动的因素
随堂练习
答案
一、浓度、压强对化学平衡的影响
1.D
2.C
3.A
4.(1)① ④ ③ ②
(2)①② ③④
5.A
6.B
7.(1)增大压强 正反应 (2)减小压强 逆反应 (3)>
二、温度、催化剂对化学平衡的影响
1.B
2.C
3.(1)升高温度 逆反应 (2)降低温度 正反应 (3)放 吸
4.D
5.B
6.D
三、化学平衡图象
1.(1)增大压强 降低温度
(2)升高温度 减小压强
2.(1)B 减小 (2)C 减小 (3)E (4)A 增大 减小 (5)D 不变
3.B
4.A
5.B
2.3.2
化学平衡的移动
练习题
1.反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压
B.减压
C.减少E的浓度
D.降温
2.下列叙述中一定能判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
3.在恒温恒容的条件下,反应A(g)+B(g)?C(g)+D(s)已达平衡,能使平衡正向移动的措施是( )
A.减少C或D的浓度
B.增大D的浓度
C.减小B的浓度
D.增大A或B的浓度
4.已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡胶管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )
A.上述过程中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g)?N2O4(g)的逆反应为放热反应
5.对可逆反应:A(g)+B(g)?C(s)+2D(g) ΔH>0,如图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A ②加入催化剂 ③加压 ④升温 ⑤移走C。符合图示条件的是( )
A.②③
B.①②
C.③④
D.④⑤
6.一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
7.向一容积不变的密闭容器中充入H2和I2,发
生反应H2(g)+I2(g)?2HI(g) ΔH<0,当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使平衡移动(如图所示),下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0时改变的条件为减小体积或升高体系温度
8.在下列可逆反应中,增大压强或降低温度,均可使平衡正向移动的是( )
A.2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应)
B.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应)
C.2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应)
D.SO2(g)+NO2(g)?SO3(g)+NO(g)(正反应为放热反应)
9.在密闭容器中进行如下反应:CO2(g)+C(s)2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡________,c(CO2)________。
(2)缩小反应容器的容积,保持温度不变,则平衡______,c(CO2)________。
(3)保持反应容器的容积和温度不变,通入N2,则平衡________,c(CO2)________。
(4)保持反应容器的容积不变,升高温度,则平衡______,c(CO)________。
10.在2
L密闭容器内,800
℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s
0
1
2
3
4
n(NO)/mol
0.020
0.01
0.008
0.007
0.007
(1)800
℃,反应达到平衡时,NO的物质的量浓度是____________;升高温度,NO的浓度增大,则该反应是____________(填“放热”或“吸热”)反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
11.在恒温时,一个容积不变的密闭容器中发生反应:2NO2(g)?N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数( )
A.不变
B.增大
C.减小
D.无法判断
12.对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92
kJ·mol-1,若只改变下列一个条件,一定能增大正反应速率且使平衡向正反应方向移动的是
( )
A.升高温度
B.增大容器容积
C.降低c(NH3)
D.将三种物质的浓度均增大到原来的2倍
13.为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y的物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是( )
A.ΔH>0,a+b>c
B.ΔH>0,a+bC.ΔH<0,a+b>c
D.ΔH<0,a+b14.对可逆反应2A(s)+3B(g)?C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①②
B.④
C.③
D.④⑤
15.在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
A.p1<p2,纵坐标指A的质量分数
B.p1>p2,纵坐标指C的质量分数
C.p1<p2,纵坐标指A的转化率
D.p1<p2,纵坐标指混合气体的平均摩尔质量
16.已知反应CO(g)+2H2(g)?CH3OH(g) ΔH=Q
kJ·mol-1;在三个不同容积的容器中分别充入1
mol
CO与2
mol
H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是( )
实验编号
温度/℃
容器容积
CO转化率
平衡压强
①
200
V1
50%
p1
②
200
V2
70%
p2
③
350
V3
50%
p3
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器容积:V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率小于70%
17.(1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行。如图所示为反应在不同时间t,温度T和压强p与反应物B的体积分数的关系曲线。根据图像填空:
①化学计量数的关系:m+n______q(填“>”“<”或“=”);
②该反应的正反应为______反应(填“吸热”或“放热”);
③升高温度正反应速率________,逆反应速率________(填“加快”或“减慢”),但v(正)________v(逆)(填“>”“<”或“=”)。
(2)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题(填“正向”“逆向”或“不”):
①在溶液中加入少量的KSCN固体,平衡________移动。
②在溶液中加入少量的KCl固体,平衡________移动。
18.(1)T1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g) ΔH<0。容器中各物质的浓度变化如下表所示:
时间/min
c(CO)
(mol·L-1)
c(H2O)
(mol·L-1)
c(CO2)
(mol·L-1)
c(H2)
(mol·L-1)
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
c1
c2
c3
c4
4
c1
c2
c3
c4
5
0.116
0.216
0.084
6
0.096
0.266
0.104
①一定处于平衡状态的时间段为__________。
②5~6
min时间段内,平衡移动方向为______________(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母)。
a.增加了H2O(g)的量
b.增加氢气浓度
c.使用催化剂
d.降低温度
③T2℃时(T2>T1),在相同条件下发生上述反应,达到平衡时,CO的浓度__________c1(填“>”“<”或“=”)。
(2)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)?CH3OH(g) ΔH<0
②CO2(g)+H2(g)?CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。
图中的压强由大到小顺序为____________,判断理由是________________________;试解释CO平衡转化率随温度升高而减小的原因:_______________________________。
2.3.2
化学平衡的移动
练习题
答案
1.D 2.C
3.D
4.D
5.A
6.C
7.A 8.A
9.(1)不移动 不变 (2)向左移动 增大
(3)不移动 不变 (4)向右移动 增大
10.(1)0.003
5
mol·L-1 放热 (2)c
11.C
12.D
13.C
14.B 15.B
16.C
17.(1)①< ②吸热 ③加快 加快 >
(2)①正向 ②不
18.(1)①3~4
min ②向右移动 a ③>
(2)p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提高CO的转化率;而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应②为吸热反应,平衡向右移动,又使产生CO的量增大;总结果是随温度升高,CO的转化率降低
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
5
2.3.2
影响化学平衡移动的因素
一、浓度、压强对化学平衡的影响
1.化学平衡移动
(1)含义:当一个可逆反应达到平衡后,如果改变________、________、________等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到____________。
(2)实质:改变条件后:
①v正________v逆。
②各组分的百分含量发生________。
(3)图示
2.从v?t图象认识浓度对平衡的影响
化学平衡
aA+bB?cC+dD(A、B、C、D为非固体)
体系浓度变化
增大反应物浓度
增大生成物浓度
减小生成物浓度
减小反应物浓度
速率变化
v正瞬间增大,v逆瞬间不变,v′正>v′逆
v逆瞬间增大,v正瞬间不变,v′逆>v′正
v逆瞬间减小,v正瞬间不变,v′正>v′逆
v正瞬间减小,v逆瞬间不变,v′逆>v′正
平衡移动方向
正向移动
逆向移动
正向移动
逆向移动
v?t图象
规律
在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向________方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向________方向移动。
3.从v?t图象认识压强对化学平衡的影响
化学平衡
aA(g)+bB(g)?cC(g)+dD(g)
计量关系
a+b>c+d
a+b
增压
减压
增压
减压
速率变化
v正、v逆同时增大,v′正>v′逆
v正、v逆同时减小,v′逆>v′正
v正、v逆同时增大,v′逆>v′正
v正、v逆同时减小,v′正>v′逆
平衡移动方向
正向移动
逆向移动
逆向移动
正向移动
速率与时间的图象
规律
在其他条件不变的情况下,增大压强,平衡向气体物质的量________的方向移动;减小压强,平衡向气体物质的量________的方向移动
二、温度、催化剂对化学平衡的影响
1.从v?t图像认识温度对化学平衡的影响
化学平衡
aA+bB?cC+dD
ΔH>0
温度改变
升温
降温
速率变化
v正、v逆同时增大,且v′正>v′逆
v正、v逆同时减小,且v′逆>v′正
移动方向
正向移动
逆向移动
速率与时间的图像
规律
在其他条件不变的情况下,升高温度,平衡向________的方向移动;降低温度,平衡向________的方向移动
2.催化剂对化学平衡的影响及勒夏特列原理
(1)催化剂对化学平衡的影响
①规律:
当其他条件不变时,催化剂________改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的________。
③v?t图象:
(2)勒夏特列原理
如果改变影响平衡的一个条件(如浓度、压强或温度),则平衡将向着能够________这种改变的方向移动。
三、化学平衡图象
1.常用物理量的名称和符号:化学反应速率为________,时间为________。温度为________,压强为________,物质的量为________,物质的量浓度为________,转化率为α。
2.在容积相同的密闭容器内,分别充入等量的N2和H2,在不同温度下,发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,绘图如下图:
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是________。
(2)此可逆反应的正反应是________反应。(填“放热”或“吸热”)。
3.常见的化学平衡图像分析
(1)图像题的解题思路
(1)一看点:即看线段的起点是否通过原点,两条线的交点或者线段的拐点等。
(2)二看线:看线段的走向和变化趋势。
(3)三看面:看清楚横坐标和纵坐标表示的物理量。
(4)四看要不要作辅助线:看是否需要作等温线或等压线。
(2)化学平衡图像的解题技巧
(1)“先拐先平,数值大”原则:
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
(2)“定一议二”原则:
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系或确定纵坐标所表示的量,讨论横坐标与曲线的关系。
参考答案:
2.3.2
影响化学平衡移动的因素
一、浓度、压强对化学平衡的影响
1.浓度
温度
压强
新的平衡
≠v逆
改变
2.正反应
逆反应
3.减小
增大
二、温度、催化剂对化学平衡的影响
1.吸热反应
放热反应
2.不能
时间
减弱
三、化学平衡图象
1.v
t
T
P
n
mol·L-1
2.A、B
放热
2.3.2
影响化学平衡移动的因素
随堂练习
一、浓度、压强对化学平衡的影响
1.下列叙述中说明某化学平衡一定发生移动的是( )
A.混合体系中气体密度发生变化
B.正、逆反应速率改变
C.混合物中各组分的浓度改变
D.反应物的转化率改变
2.下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.平衡状态
Ⅰ
到平衡状态
Ⅱ
是平衡发生正向移动
C.平衡状态
Ⅰ
到平衡状态
Ⅱ
是平衡发生逆向移动
D.平衡状态
Ⅰ
和平衡状态
Ⅱ
的反应速率不相等
3.Mg(OH)2在水中存在溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
A.NH4Cl
B.NaOH
C.MgCl2
D.Fe
4.已知反应mA(g)+nB(g)?pC(g) ΔH<0,m+n
(1)表示反应物浓度增大的图像是________,表示反应物浓度减小的图像是________,表示生成物浓度增大的图像是________,表示生成物浓度减小的图像是________。
(2)表示平衡正向移动的图像是________,表示平衡逆向移动的图像是________。
5.一定温度下,反应C(s)+H2O(g)?CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是
( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①②
B.②③
C.①④
D.③④
6.密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)?2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,下列叙述正确的是( )
A.缩小容器的容积后,平衡正向移动
B.重新平衡后CaO的量减少
C.重新平衡后气体的质量不变
D.重新平衡后CaO2的量不变
7.mA(g)+nB(g)?pC(g)+qD(g),当反应达到平衡后,若压强改变,其v?t图像如下:
(1)图①表示的压强变化是________,平衡移动方向是向________方向。
(2)图②表示的压强变化是________,平衡移动方向是向________方向。
(3)m+n________p+q(填“>”、“=”或“<”)。
二、温度、催化剂对化学平衡的影响
1.已知反应A2(g)+2B2(g)?2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,A2的转化率增大
B.升高温度有利于反应速率增大,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
2.在容积不变的密闭容器中,一定条件下发生反应:2A?B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
3.mA(g)+nB(g)?pC(g),当反应达平衡后,若温度改变,其反应速率的变化曲线分别如下图所示:
(1)图①表示的温度变化是________,平衡移动方向是向________方向。
(2)图②表示的温度变化是________,平衡移动方向是向________方向。
(3)正反应是______热反应,逆反应是______热反应。
4.下列事实不能用勒夏特列原理解释的是
( )
A.用排饱和食盐水法收集Cl2
B.加压有利于合成氨反应
C.冰镇的啤酒打开后泛起泡沫
D.对2HI?H2+I2(g)平衡体系增加压强使颜色变深
5.已知:可逆反应2SO2(g)+O2(g)?2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是
( )
A.升温增压
B.降温增压
C.升温减压
D.降温减压
6.下列措施有利于反应:N2(g)+3H2(g)?2NH3(g) ΔH=-92
kJ·mol-1平衡向正反应方向移动的是( )
①升高温度 ②降低温度 ③增大压强
④减小压强⑤增大NH3浓度 ⑥减小NH3浓度
A.②④⑥
B.①③⑥
C.②③⑤
D.②③⑥
三、化学平衡图象
1.对于①N2(g)+3H2(g)?2NH3(g) ΔH<0
②2NH3(g)?N2(g)+3H2(g) ΔH>0
其中v?t图像为
(1)反应①
t1时刻改变的条件为_____________________________________________;
t2时刻改变的条件为_____________________________________________。
(2)反应②
t1时刻改变的条件为_____________________________________________;
t2时刻改变的条件为_____________________________________________。
2.一定条件下,A(g)+B(g)?C(g) ΔH<0,达到平衡后根据下列图象判断:
(1)升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”、“E”,下同),新平衡中C的体积分数______(填“增大”、“减小”、“不变”,下同)。
(2)减小压强,达到新平衡的是________,A的转化率________。
(3)减小C的量,达到新平衡的是________。
(4)增加A的量,达到新平衡的是_______,此时B的转化率_______,A的转化率_______。
(5)使用催化剂,达到新平衡的是________,C的质量分数________。
3.现有下列两个图象:
下列反应中符合上述图象的是( )
A.N2(g)+3H2(g)?2NH3(g) ΔH<0
B.2SO3(g)?2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)?4NO(g)+6H2O(g) ΔH<0
D.H2S(g)?H2(g)+S(s) ΔH>0
4.已知某可逆反应:mA(g)+nB(g)?pC(g) ΔH,在密闭容器中进行,如图所示,反应在不同时间t、温度T和压强p与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
A.T1>T2,p1>p2,m+n>p,ΔH>0
B.T1>T2,p1
C.T1
5.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是( )
A.反应
Ⅰ:ΔH>0,p2>p1
B.反应
Ⅱ:ΔH<0,T1>T2
C.反应
Ⅲ:ΔH>0,T2
Ⅳ:ΔH<0,T2>T1
2.3.2
影响化学平衡移动的因素
随堂练习
答案
一、浓度、压强对化学平衡的影响
1.D
2.C
3.A
4.(1)① ④ ③ ②
(2)①② ③④
5.A
6.B
7.(1)增大压强 正反应 (2)减小压强 逆反应 (3)>
二、温度、催化剂对化学平衡的影响
1.B
2.C
3.(1)升高温度 逆反应 (2)降低温度 正反应 (3)放 吸
4.D
5.B
6.D
三、化学平衡图象
1.(1)增大压强 降低温度
(2)升高温度 减小压强
2.(1)B 减小 (2)C 减小 (3)E (4)A 增大 减小 (5)D 不变
3.B
4.A
5.B
2.3.2
化学平衡的移动
练习题
1.反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压
B.减压
C.减少E的浓度
D.降温
2.下列叙述中一定能判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
3.在恒温恒容的条件下,反应A(g)+B(g)?C(g)+D(s)已达平衡,能使平衡正向移动的措施是( )
A.减少C或D的浓度
B.增大D的浓度
C.减小B的浓度
D.增大A或B的浓度
4.已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡胶管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )
A.上述过程中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g)?N2O4(g)的逆反应为放热反应
5.对可逆反应:A(g)+B(g)?C(s)+2D(g) ΔH>0,如图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A ②加入催化剂 ③加压 ④升温 ⑤移走C。符合图示条件的是( )
A.②③
B.①②
C.③④
D.④⑤
6.一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
7.向一容积不变的密闭容器中充入H2和I2,发
生反应H2(g)+I2(g)?2HI(g) ΔH<0,当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使平衡移动(如图所示),下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0时改变的条件为减小体积或升高体系温度
8.在下列可逆反应中,增大压强或降低温度,均可使平衡正向移动的是( )
A.2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应)
B.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应)
C.2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应)
D.SO2(g)+NO2(g)?SO3(g)+NO(g)(正反应为放热反应)
9.在密闭容器中进行如下反应:CO2(g)+C(s)2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡________,c(CO2)________。
(2)缩小反应容器的容积,保持温度不变,则平衡______,c(CO2)________。
(3)保持反应容器的容积和温度不变,通入N2,则平衡________,c(CO2)________。
(4)保持反应容器的容积不变,升高温度,则平衡______,c(CO)________。
10.在2
L密闭容器内,800
℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s
0
1
2
3
4
n(NO)/mol
0.020
0.01
0.008
0.007
0.007
(1)800
℃,反应达到平衡时,NO的物质的量浓度是____________;升高温度,NO的浓度增大,则该反应是____________(填“放热”或“吸热”)反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
11.在恒温时,一个容积不变的密闭容器中发生反应:2NO2(g)?N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数( )
A.不变
B.增大
C.减小
D.无法判断
12.对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92
kJ·mol-1,若只改变下列一个条件,一定能增大正反应速率且使平衡向正反应方向移动的是
( )
A.升高温度
B.增大容器容积
C.降低c(NH3)
D.将三种物质的浓度均增大到原来的2倍
13.为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y的物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是( )
A.ΔH>0,a+b>c
B.ΔH>0,a+b
D.ΔH<0,a+b
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①②
B.④
C.③
D.④⑤
15.在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
A.p1<p2,纵坐标指A的质量分数
B.p1>p2,纵坐标指C的质量分数
C.p1<p2,纵坐标指A的转化率
D.p1<p2,纵坐标指混合气体的平均摩尔质量
16.已知反应CO(g)+2H2(g)?CH3OH(g) ΔH=Q
kJ·mol-1;在三个不同容积的容器中分别充入1
mol
CO与2
mol
H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是( )
实验编号
温度/℃
容器容积
CO转化率
平衡压强
①
200
V1
50%
p1
②
200
V2
70%
p2
③
350
V3
50%
p3
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器容积:V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率小于70%
17.(1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行。如图所示为反应在不同时间t,温度T和压强p与反应物B的体积分数的关系曲线。根据图像填空:
①化学计量数的关系:m+n______q(填“>”“<”或“=”);
②该反应的正反应为______反应(填“吸热”或“放热”);
③升高温度正反应速率________,逆反应速率________(填“加快”或“减慢”),但v(正)________v(逆)(填“>”“<”或“=”)。
(2)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题(填“正向”“逆向”或“不”):
①在溶液中加入少量的KSCN固体,平衡________移动。
②在溶液中加入少量的KCl固体,平衡________移动。
18.(1)T1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g) ΔH<0。容器中各物质的浓度变化如下表所示:
时间/min
c(CO)
(mol·L-1)
c(H2O)
(mol·L-1)
c(CO2)
(mol·L-1)
c(H2)
(mol·L-1)
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
c1
c2
c3
c4
4
c1
c2
c3
c4
5
0.116
0.216
0.084
6
0.096
0.266
0.104
①一定处于平衡状态的时间段为__________。
②5~6
min时间段内,平衡移动方向为______________(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母)。
a.增加了H2O(g)的量
b.增加氢气浓度
c.使用催化剂
d.降低温度
③T2℃时(T2>T1),在相同条件下发生上述反应,达到平衡时,CO的浓度__________c1(填“>”“<”或“=”)。
(2)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)?CH3OH(g) ΔH<0
②CO2(g)+H2(g)?CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。
图中的压强由大到小顺序为____________,判断理由是________________________;试解释CO平衡转化率随温度升高而减小的原因:_______________________________。
2.3.2
化学平衡的移动
练习题
答案
1.D 2.C
3.D
4.D
5.A
6.C
7.A 8.A
9.(1)不移动 不变 (2)向左移动 增大
(3)不移动 不变 (4)向右移动 增大
10.(1)0.003
5
mol·L-1 放热 (2)c
11.C
12.D
13.C
14.B 15.B
16.C
17.(1)①< ②吸热 ③加快 加快 >
(2)①正向 ②不
18.(1)①3~4
min ②向右移动 a ③>
(2)p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提高CO的转化率;而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应②为吸热反应,平衡向右移动,又使产生CO的量增大;总结果是随温度升高,CO的转化率降低
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
5
