鲁教版九年级下册7.4 酸碱中和反应(28张ppt)
文档属性
| 名称 | 鲁教版九年级下册7.4 酸碱中和反应(28张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-17 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
酸碱中和反应
目录
CONTENTS
一、酸碱中和反应实质
二、中和反应实际应用
三、溶液酸碱性的判断
四、实验图像题
PART
ONE
酸碱中和反应实质
酸碱中和反应
定义:酸和碱作用生成盐和水的反应,叫中和反应
反应物必须为酸和碱
HCl
+
NaOH
=
NaCl
+
H2O
2HCl
+
Ca(OH)2
=
CaCl2
+
2H2O
H2SO4
+
2NaOH
=
Na2SO4
+
2H2O
酸
碱
盐
水
阳离子:金属离子或铵根离子
阴离子:酸根离子
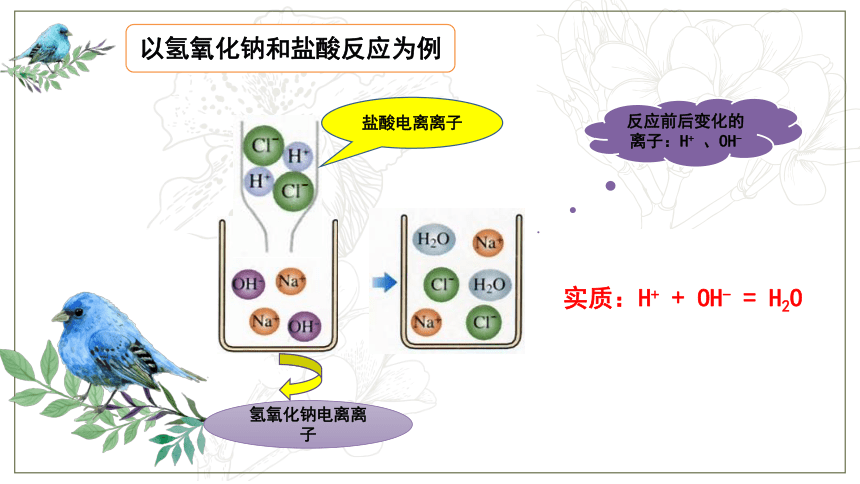
以氢氧化钠和盐酸反应为例
盐酸电离离子
氢氧化钠电离离子
实质:H+
+
OH-
=
H2O
反应前后变化的离子:H+
、OH-
1、下列反应中属于中和反应的是(
)
A、Zn
+
2HCl=
ZnCl2+H2↑
B、CuO
+
2HCl=
CuCl2+
H2O
C、Ba(OH)2+
H2SO4
=
BaSO4↓+
2H2O
D、AgNO3+HCl
=
AgCl↓+
HNO3
2、下列各组物质通常借助指示剂才能证明是否反应的
是(
)
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸
C
D
PART
TWO
中和反应实际应用
改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?能用生石灰代替熟石灰吗?为什么?
熟石灰中和:Ca(OH)2+
H2SO4
=
CaSO4
+
2H2O
可以,
CaO
+
H2O
=
Ca(OH)2
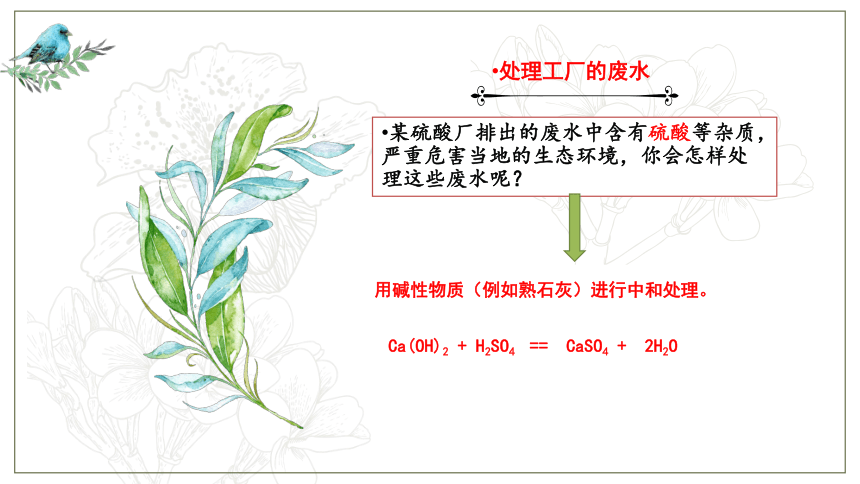
处理工厂的废水
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2
+
H2SO4
==
CaSO4
+
2H2O
用于医药
胃酸的主要成分是盐酸(HCl),胃药的主要成分氢氧化铝。
Al(OH)3
+
3HCl
=
AlCl3
+
3H2O
也可用小苏打中和胃酸
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
1、在我国南方一些地区,分布着酸性土壤,不适应某些作物生长。为改良作物生长条件,当地的农民常用来中和土壤酸性的物质是(
)
A、石灰石
B、熟石灰
C、烧碱
D、醋酸
典例分析
2、在一次化学实验课上,老师让同学们对下面实验进行探究。
探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[实验](1)在第一支试管中加入约2mL蒸馏水,滴入几滴无色酚酞溶液。现象:溶液不变色。
(2)在第二支试管中加入约2mL氯化钠溶液,滴入几滴无色酚酞溶液。现象为:
。
(3)在第三支试管中加入约2mL氢氧化钠溶液,滴入几滴无色酚酞溶液。现象为____________________:结论为:
______________________________
溶液不变色
溶液变红色
氢氧根离子使无色酚酞溶液变红色
B
PART
THREE
溶液酸碱性的判断
溶液酸碱性
溶液酸碱度常用pH来表示,pH的范围通常在0~14之间。
PH
<7,酸性,越小酸性越大
PH
>7,碱性,越大碱性越大
测定pH最简便的方法是使用pH试纸。
测定方法:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取试液,然后在试纸的中间点一下,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。
注意:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
生活中一些常见物质的pH如下图,下列四种物质中酸碱性与众不同的是(
)
A.肥皂水
B.牙膏
C.西瓜汁
D.玉米粥
用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较(
)
A.偏低
B.偏高
C.相等
D.无法比较
C
B
物质
肥皂水
雨水
糖水
柠檬汁
洗洁精
pH
10.2
5.2
7.0
2.5
12.2
小明同学取下列生活中的物质,测得其pH如下表所示:
由此判断:
(1)酸性最强的物质是________。
(2)能使无色酚酞试液变红色的物质是_____
_(填一种物质即可)。
(3)正常雨水的pH约为5.6。小明生活的环境所降的雨水_____(填“属于”或“不属于”)酸雨。
柠檬汁
肥皂水
属于
PART
FOUR
实验图像题
酸碱中和反应图像
无明显现象,只能用酸碱指示剂指示颜色
放出大量的热
12
11
10
9
8
7
6
5
4
3
2
1
0
2
4
6
8
10
12
14
16
18
V/m
L
盐酸与氢氧化钠反应过程中PH值的变化
A
B
A、B点:判断溶液添加
PH<7,代表碱加入酸中
PH>7,代表酸加入碱中
C
C点:代表两种溶液恰好完全反应
溶质成分分析:如图示
(NaCl)
(HCl、NaCl)
(NaOH、NaCl)
(NaOH、NaCl)
(HCl、NaCl)
PH
向稀盐酸中滴加氢氧化钠溶液:
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应,
pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
向氢氧化钠中滴加稀盐酸溶液:
(1)当滴入稀盐酸溶液不足时,pH>7,溶液显碱性,NaOH有剩余。
(2)当滴入稀盐酸溶液与NaOH恰好完全反应,
pH=7,溶液显中性。
(3)当滴入稀盐酸溶液过量时,pH<7,溶液显酸性,氢氧化钠有剩余。
溶
质
成
分
分
析
典例分析
向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg
B.H2O
C.NaOH
D.CaCO3
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液成酸性
B.该实验是将氢氧化钠溶液逐滴滴入到盛有盐酸的烧杯中
C.b点表示盐酸与氢氧化钠恰好完全反应
D.图中c点所示溶液中所含的溶质有NaCl和NaOH
温度图
0
2
4
6
8
10
12
V/m
L
温度
温度最高点为恰好完全反应点
向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )
A.H2O
B.H2SO4
C.NaOH
D.CaCO3
C
如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH大于7
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl﹣
D.反应前后各元素的化合价均无变化
酸和碱能发生中和反应,它在日常生活和工农业生产中有着广泛的应用,如图表示盐酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线及相关的实验操作,请从中获取信息,回答下列问
(1)①烧杯中盛放的是_________溶液。
②曲线上坐标为(18,7)的点所表示的意义__________________。
③曲线上坐标为(15,12)的点表示的溶液中的微粒有______________(用化学用语表示)。
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式
。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:______________
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是
理由是_________________________
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有
。
接下页
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
有NaOH
和
Na2SO4
猜想三
NaOH
和
H2SO4
不能共存
NaOH
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究。
实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作
实验现象
试纸变色,对比比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是
;
②实验方案中也有一个是错误的,错误的原因是
。
有气泡产生
PH试纸直接插入溶液中
方案三中能与Bacl2反应的还有Na2SO4
谢谢聆听
酸碱中和反应
目录
CONTENTS
一、酸碱中和反应实质
二、中和反应实际应用
三、溶液酸碱性的判断
四、实验图像题
PART
ONE
酸碱中和反应实质
酸碱中和反应
定义:酸和碱作用生成盐和水的反应,叫中和反应
反应物必须为酸和碱
HCl
+
NaOH
=
NaCl
+
H2O
2HCl
+
Ca(OH)2
=
CaCl2
+
2H2O
H2SO4
+
2NaOH
=
Na2SO4
+
2H2O
酸
碱
盐
水
阳离子:金属离子或铵根离子
阴离子:酸根离子
以氢氧化钠和盐酸反应为例
盐酸电离离子
氢氧化钠电离离子
实质:H+
+
OH-
=
H2O
反应前后变化的离子:H+
、OH-
1、下列反应中属于中和反应的是(
)
A、Zn
+
2HCl=
ZnCl2+H2↑
B、CuO
+
2HCl=
CuCl2+
H2O
C、Ba(OH)2+
H2SO4
=
BaSO4↓+
2H2O
D、AgNO3+HCl
=
AgCl↓+
HNO3
2、下列各组物质通常借助指示剂才能证明是否反应的
是(
)
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸
C
D
PART
TWO
中和反应实际应用
改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?能用生石灰代替熟石灰吗?为什么?
熟石灰中和:Ca(OH)2+
H2SO4
=
CaSO4
+
2H2O
可以,
CaO
+
H2O
=
Ca(OH)2
处理工厂的废水
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2
+
H2SO4
==
CaSO4
+
2H2O
用于医药
胃酸的主要成分是盐酸(HCl),胃药的主要成分氢氧化铝。
Al(OH)3
+
3HCl
=
AlCl3
+
3H2O
也可用小苏打中和胃酸
NaHCO3
+
HCl
=
NaCl
+
H2O
+
CO2↑
1、在我国南方一些地区,分布着酸性土壤,不适应某些作物生长。为改良作物生长条件,当地的农民常用来中和土壤酸性的物质是(
)
A、石灰石
B、熟石灰
C、烧碱
D、醋酸
典例分析
2、在一次化学实验课上,老师让同学们对下面实验进行探究。
探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[实验](1)在第一支试管中加入约2mL蒸馏水,滴入几滴无色酚酞溶液。现象:溶液不变色。
(2)在第二支试管中加入约2mL氯化钠溶液,滴入几滴无色酚酞溶液。现象为:
。
(3)在第三支试管中加入约2mL氢氧化钠溶液,滴入几滴无色酚酞溶液。现象为____________________:结论为:
______________________________
溶液不变色
溶液变红色
氢氧根离子使无色酚酞溶液变红色
B
PART
THREE
溶液酸碱性的判断
溶液酸碱性
溶液酸碱度常用pH来表示,pH的范围通常在0~14之间。
PH
<7,酸性,越小酸性越大
PH
>7,碱性,越大碱性越大
测定pH最简便的方法是使用pH试纸。
测定方法:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取试液,然后在试纸的中间点一下,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。
注意:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
生活中一些常见物质的pH如下图,下列四种物质中酸碱性与众不同的是(
)
A.肥皂水
B.牙膏
C.西瓜汁
D.玉米粥
用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较(
)
A.偏低
B.偏高
C.相等
D.无法比较
C
B
物质
肥皂水
雨水
糖水
柠檬汁
洗洁精
pH
10.2
5.2
7.0
2.5
12.2
小明同学取下列生活中的物质,测得其pH如下表所示:
由此判断:
(1)酸性最强的物质是________。
(2)能使无色酚酞试液变红色的物质是_____
_(填一种物质即可)。
(3)正常雨水的pH约为5.6。小明生活的环境所降的雨水_____(填“属于”或“不属于”)酸雨。
柠檬汁
肥皂水
属于
PART
FOUR
实验图像题
酸碱中和反应图像
无明显现象,只能用酸碱指示剂指示颜色
放出大量的热
12
11
10
9
8
7
6
5
4
3
2
1
0
2
4
6
8
10
12
14
16
18
V/m
L
盐酸与氢氧化钠反应过程中PH值的变化
A
B
A、B点:判断溶液添加
PH<7,代表碱加入酸中
PH>7,代表酸加入碱中
C
C点:代表两种溶液恰好完全反应
溶质成分分析:如图示
(NaCl)
(HCl、NaCl)
(NaOH、NaCl)
(NaOH、NaCl)
(HCl、NaCl)
PH
向稀盐酸中滴加氢氧化钠溶液:
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应,
pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
向氢氧化钠中滴加稀盐酸溶液:
(1)当滴入稀盐酸溶液不足时,pH>7,溶液显碱性,NaOH有剩余。
(2)当滴入稀盐酸溶液与NaOH恰好完全反应,
pH=7,溶液显中性。
(3)当滴入稀盐酸溶液过量时,pH<7,溶液显酸性,氢氧化钠有剩余。
溶
质
成
分
分
析
典例分析
向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的( )
A.Mg
B.H2O
C.NaOH
D.CaCO3
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液成酸性
B.该实验是将氢氧化钠溶液逐滴滴入到盛有盐酸的烧杯中
C.b点表示盐酸与氢氧化钠恰好完全反应
D.图中c点所示溶液中所含的溶质有NaCl和NaOH
温度图
0
2
4
6
8
10
12
V/m
L
温度
温度最高点为恰好完全反应点
向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )
A.H2O
B.H2SO4
C.NaOH
D.CaCO3
C
如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH大于7
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl﹣
D.反应前后各元素的化合价均无变化
酸和碱能发生中和反应,它在日常生活和工农业生产中有着广泛的应用,如图表示盐酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线及相关的实验操作,请从中获取信息,回答下列问
(1)①烧杯中盛放的是_________溶液。
②曲线上坐标为(18,7)的点所表示的意义__________________。
③曲线上坐标为(15,12)的点表示的溶液中的微粒有______________(用化学用语表示)。
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式
。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:______________
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是
理由是_________________________
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有
。
接下页
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
有NaOH
和
Na2SO4
猜想三
NaOH
和
H2SO4
不能共存
NaOH
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究。
实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作
实验现象
试纸变色,对比比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是
;
②实验方案中也有一个是错误的,错误的原因是
。
有气泡产生
PH试纸直接插入溶液中
方案三中能与Bacl2反应的还有Na2SO4
谢谢聆听
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
