人教版高中化学必修一2.2-离子反应(共20张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.2-离子反应(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 738.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-19 14:43:52 | ||
图片预览







文档简介
(共20张PPT)
第二章
化学物质及其变化
第二节
离子反应
本节课要学习的内容
1.离子反应发生的条件
2.离子共存问题
3.离子反应的应用
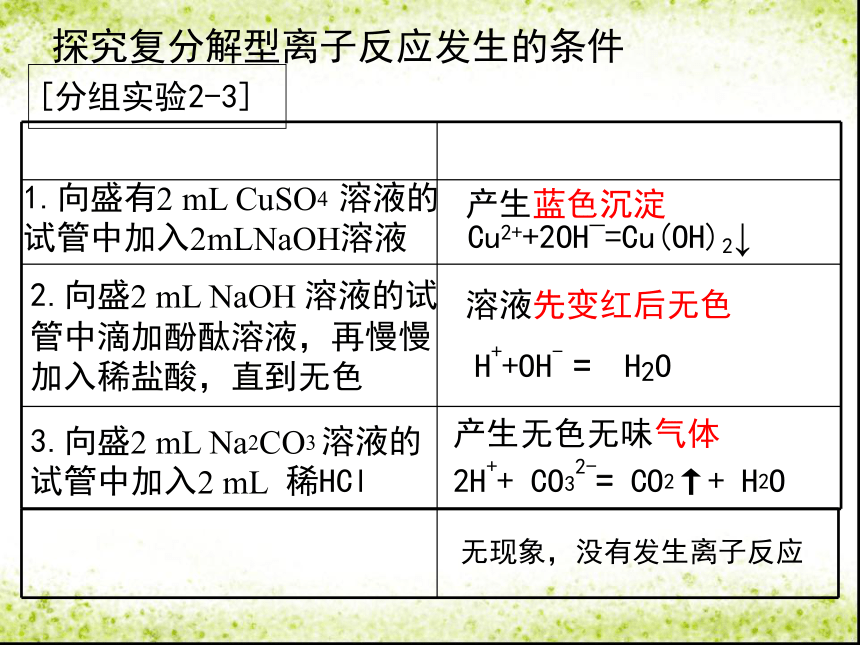
[分组实验2-3]
1.向盛有2
mL
CuSO4
溶液的试管中加入2mLNaOH溶液
2.向盛2
mL
NaOH
溶液的试
管中滴加酚酞溶液,再慢慢
加入稀盐酸,直到无色
3.向盛2
mL
Na2CO3
溶液的试管中加入2
mL
稀HCl
产生蓝色沉淀
溶液先变红后无色
产生无色无味气体
探究复分解型离子反应发生的条件
Cu2++2OH_=Cu(OH)2↓
H++OH-
=
H2O
2H++
CO32-=
CO2↑+
H2O
无现象,没有发生离子反应
【讨论与思考】
1.上述1、2、3实验中,溶液中离子的
数目有何变化?
2.哪些因素可以使离子数目明显减少?
离子反应的实质就是通过反应使某些离子的数目明显减少的过程。
减少
生成难溶物、难电离(水)、
挥发性物质(气体)
⑴
生成难溶物质如:AgCl、BaSO4
、CaCO3
⑵
生成难电离的物质(弱酸、弱碱、水)如:
CH3COOH
、NH3.H2O
⑶
生成挥发性物质(气体)如:NH3、
CO2、SO2、H2S等
共同特点
反应后
离子浓度
减小
一、复分解型离子反应发生的条件
1.下列能发生离子反应的是(
)
A.KCl
溶液与
NaOH溶液混合
B.AgNO3溶液与
NaCl溶液混合
C.NaNO3溶液与KCl溶液混合
D.NaCl溶液与
Ba(OH)2溶液混合
课堂检测
B
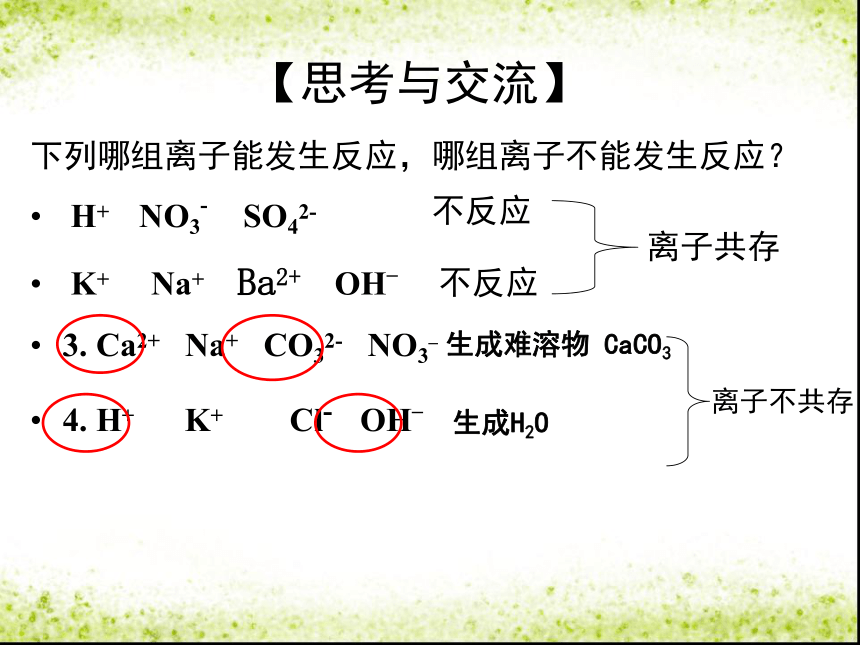
【思考与交流】
下列哪组离子能发生反应,哪组离子不能发生反应?
H+
NO3-
SO42-
K+
Na+
Ba2+
OH_
3.
Ca2+
Na+
CO32-
NO3_
4.
H+
K+
Cl-
OH_
不反应
不反应
生成难溶物
CaCO3
生成H2O
离子共存
离子不共存
二、离子共存问题
1.离子共存是指离子之间不发生反应。
反应不共存,共存不反应。
2.符合下列情况的离子不能大量共存:
(1)因发生复分解反应不共存
(2)因发生氧化还原反应不共存
(3)因发生双水解反应不共存
以后再学
(4)因发生络合反应不共存
因发生复分解反应的离子不能大量共存:
(1)生成难溶物或微溶物的离子。如Ba2+和SO42-、
(2)生成挥发性物质(气体)的离子。如H+和CO32-、
(3)生成难电离的物质的离子。如H+和CH3COO-、
H+和SO32-、H+和HCO3-、H+和HSO3-等。
H+和OH-、
OH-和NH4+等。
Ca2+和OH-、Ag+和Cl-、Cu2+和OH-等。
(4)弱酸的酸式根离子(HCO3-、HSO3-、HS-等)既
不能与H+大量共存,又不能与OH-大量共存。
判断下列各组离子能否大量共存
1.
Ca2+
Na+
SO42-
NO3-
2.
NH4+
K+
OH-
SO42-
3.
H+
K+
HCO3-
SO42-
4.
Na+
K+
CO32-
OH-
生成微溶物
CaSO4
生成
NH3
·
H2O
生成
气体
CO2
能大量共存
练一练:
①溶液为无色时,则不存在有色的离子。
Cu2+(蓝色)、Fe3+(棕黄色)、
Fe2+(浅绿色)、MnO4-(紫红色)等;
溶液透明时,则不能存在沉淀。
②强碱性溶液或pH>7时,则溶液中存在大量OH-;
③强酸性溶液或pH<7时,则溶液中存在大量H+;
3.注意题目附加隐含条件
1.在无色透明溶液中,能大量共存的离子组是(
)。
A、K+、Cu2+、NO3-、SO42-
B、K+、Na+、Cl-、CO32-
C、Mg2+、OH-、NO3-、Cl-
D、K+、Na+、MnO4-、SO42-
随堂练习
B
2.在pH=1的无色透明溶液中能大量共存的离子组是(
)。
A.
K+、Ag+、NO3-、Cl-
B.
Cu2+、Na+、NO3-、SO42-
C.
K+、Na+、S2-、Cl-
D.
Mg2+、Na+、NO3-、SO42-
随堂练习
H+
H+
H+
D
归纳离子共存问题的解题技巧:
三看
一看
颜色
二看
酸碱性
三看
反应
三、离子反应的实际应用
混合物的分离
如选用试剂将混合物中的某离子沉淀后过滤。
2.物质的提纯和鉴定
如粗盐的提纯,除去NaCl中的Ca2+、Mg2+、SO42-
3.清除水中污染物
如明矾净水
【高考链接】
某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-
六种离子。
①甲厂的废水明显呈碱性,故甲厂废水中所含的3种离子是
②乙厂的废水中含有另外3种离子,如果加一定量
(选填:活性炭、硫酸亚铁、铁粉)可以回收其中的金属
(填写金属元素符号)。
③另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的
(填写离子符号)转化为沉淀,经过滤后的废水主要含
,可用来浇灌农田。
OH-
K+
Cl-
铁粉
Ag
Ag+、Cl-、Fe3+、OH-
KNO3
我的收获……
你
说
我
说
课堂小结:
1.离子反应(复分解型)发生的条件
2.离子共存问题
3.离子反应的应用
归纳小结:
(1)
与H+不能大量共存。
(2)
与OH-不能大量共存。
(3)
既不能与H+大量共
存,也不能与OH-大量共存。
弱酸的酸根离子和OH-
如CO32-、SO32-、S2-、PO43-、CH3COO-、ClO-等.
弱碱的阳离子和H+
如NH4+、Cu2+、Fe2+、Fe3+
、Mg2+
等.
多元弱酸的酸式根离子
如HCO3-
、HS-、HSO3-、HPO42-、H2PO4-等.
祝同学们学习进步!
再
见
第二章
化学物质及其变化
第二节
离子反应
本节课要学习的内容
1.离子反应发生的条件
2.离子共存问题
3.离子反应的应用
[分组实验2-3]
1.向盛有2
mL
CuSO4
溶液的试管中加入2mLNaOH溶液
2.向盛2
mL
NaOH
溶液的试
管中滴加酚酞溶液,再慢慢
加入稀盐酸,直到无色
3.向盛2
mL
Na2CO3
溶液的试管中加入2
mL
稀HCl
产生蓝色沉淀
溶液先变红后无色
产生无色无味气体
探究复分解型离子反应发生的条件
Cu2++2OH_=Cu(OH)2↓
H++OH-
=
H2O
2H++
CO32-=
CO2↑+
H2O
无现象,没有发生离子反应
【讨论与思考】
1.上述1、2、3实验中,溶液中离子的
数目有何变化?
2.哪些因素可以使离子数目明显减少?
离子反应的实质就是通过反应使某些离子的数目明显减少的过程。
减少
生成难溶物、难电离(水)、
挥发性物质(气体)
⑴
生成难溶物质如:AgCl、BaSO4
、CaCO3
⑵
生成难电离的物质(弱酸、弱碱、水)如:
CH3COOH
、NH3.H2O
⑶
生成挥发性物质(气体)如:NH3、
CO2、SO2、H2S等
共同特点
反应后
离子浓度
减小
一、复分解型离子反应发生的条件
1.下列能发生离子反应的是(
)
A.KCl
溶液与
NaOH溶液混合
B.AgNO3溶液与
NaCl溶液混合
C.NaNO3溶液与KCl溶液混合
D.NaCl溶液与
Ba(OH)2溶液混合
课堂检测
B
【思考与交流】
下列哪组离子能发生反应,哪组离子不能发生反应?
H+
NO3-
SO42-
K+
Na+
Ba2+
OH_
3.
Ca2+
Na+
CO32-
NO3_
4.
H+
K+
Cl-
OH_
不反应
不反应
生成难溶物
CaCO3
生成H2O
离子共存
离子不共存
二、离子共存问题
1.离子共存是指离子之间不发生反应。
反应不共存,共存不反应。
2.符合下列情况的离子不能大量共存:
(1)因发生复分解反应不共存
(2)因发生氧化还原反应不共存
(3)因发生双水解反应不共存
以后再学
(4)因发生络合反应不共存
因发生复分解反应的离子不能大量共存:
(1)生成难溶物或微溶物的离子。如Ba2+和SO42-、
(2)生成挥发性物质(气体)的离子。如H+和CO32-、
(3)生成难电离的物质的离子。如H+和CH3COO-、
H+和SO32-、H+和HCO3-、H+和HSO3-等。
H+和OH-、
OH-和NH4+等。
Ca2+和OH-、Ag+和Cl-、Cu2+和OH-等。
(4)弱酸的酸式根离子(HCO3-、HSO3-、HS-等)既
不能与H+大量共存,又不能与OH-大量共存。
判断下列各组离子能否大量共存
1.
Ca2+
Na+
SO42-
NO3-
2.
NH4+
K+
OH-
SO42-
3.
H+
K+
HCO3-
SO42-
4.
Na+
K+
CO32-
OH-
生成微溶物
CaSO4
生成
NH3
·
H2O
生成
气体
CO2
能大量共存
练一练:
①溶液为无色时,则不存在有色的离子。
Cu2+(蓝色)、Fe3+(棕黄色)、
Fe2+(浅绿色)、MnO4-(紫红色)等;
溶液透明时,则不能存在沉淀。
②强碱性溶液或pH>7时,则溶液中存在大量OH-;
③强酸性溶液或pH<7时,则溶液中存在大量H+;
3.注意题目附加隐含条件
1.在无色透明溶液中,能大量共存的离子组是(
)。
A、K+、Cu2+、NO3-、SO42-
B、K+、Na+、Cl-、CO32-
C、Mg2+、OH-、NO3-、Cl-
D、K+、Na+、MnO4-、SO42-
随堂练习
B
2.在pH=1的无色透明溶液中能大量共存的离子组是(
)。
A.
K+、Ag+、NO3-、Cl-
B.
Cu2+、Na+、NO3-、SO42-
C.
K+、Na+、S2-、Cl-
D.
Mg2+、Na+、NO3-、SO42-
随堂练习
H+
H+
H+
D
归纳离子共存问题的解题技巧:
三看
一看
颜色
二看
酸碱性
三看
反应
三、离子反应的实际应用
混合物的分离
如选用试剂将混合物中的某离子沉淀后过滤。
2.物质的提纯和鉴定
如粗盐的提纯,除去NaCl中的Ca2+、Mg2+、SO42-
3.清除水中污染物
如明矾净水
【高考链接】
某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-
六种离子。
①甲厂的废水明显呈碱性,故甲厂废水中所含的3种离子是
②乙厂的废水中含有另外3种离子,如果加一定量
(选填:活性炭、硫酸亚铁、铁粉)可以回收其中的金属
(填写金属元素符号)。
③另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的
(填写离子符号)转化为沉淀,经过滤后的废水主要含
,可用来浇灌农田。
OH-
K+
Cl-
铁粉
Ag
Ag+、Cl-、Fe3+、OH-
KNO3
我的收获……
你
说
我
说
课堂小结:
1.离子反应(复分解型)发生的条件
2.离子共存问题
3.离子反应的应用
归纳小结:
(1)
与H+不能大量共存。
(2)
与OH-不能大量共存。
(3)
既不能与H+大量共
存,也不能与OH-大量共存。
弱酸的酸根离子和OH-
如CO32-、SO32-、S2-、PO43-、CH3COO-、ClO-等.
弱碱的阳离子和H+
如NH4+、Cu2+、Fe2+、Fe3+
、Mg2+
等.
多元弱酸的酸式根离子
如HCO3-
、HS-、HSO3-、HPO42-、H2PO4-等.
祝同学们学习进步!
再
见
