黑龙江省哈师大青冈实验中学2021届高三上学期开学考试(8月)化学试题
文档属性
| 名称 | 黑龙江省哈师大青冈实验中学2021届高三上学期开学考试(8月)化学试题 |

|
|
| 格式 | doc | ||
| 文件大小 | 404.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-19 00:00:00 | ||
图片预览



文档简介
____________________________________________________________________________________________
哈师大青冈实验中学2020年8月份考试
高三学年化学试题
可能用到的相对原子质量:Cu:64 O:16 C:12 Fe:56 Cl:35.5
选择题(每小题2分,共42分,每小题只有一个正确答案)
单选题
1.据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是
A.晶体硅 B.二氧化硅 C.铜合金 D.不锈钢
2.硅及其化合物是带来人类文明的重要物质。下列说法正确的是
A.CO2和SiO2都是由相应的分子构成的
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
D.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示
3.下列各组中的两种物质作用时,反应条件(温度、反应物用量、浓度等)改变,不会引起产物改变的是
A.NaOH和CO2 B.Fe粉在Cl2中燃烧
C.Na和O2 D.Cu和HNO3溶液
4.将3.2g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则消耗的硝酸的物质的量一共是
A.0.22mol B.0.2mol C.0.16mol D.0.1mol
5.下列离子方程式正确的是
A.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:
2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓
B.氯化铁溶液腐蚀铜电路板:Cu+Fe3+﹣═Fe2+ +Cu2+
C.已知:2Br﹣+Cl2=2Cl﹣+Br2,Br2+2Fe2+=2Fe3++2Br﹣,向含0.2molFeBr2的溶液中通入标准状况下3.36LCl2时,发生的反应为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣
D.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓
6.下列实验方案合理的是
A.制取少量CO2,可随开随制,随关随停 B.配制一定物质的量浓度的稀硫酸 C.可制得Fe(OH)2,并观察其颜色 D.干燥、收集NH3,并吸收多余的尾气
A.A B.B C.C D.D
7.NA表示阿伏加德罗常数,下列说法正确的是
A.1mol/L Na2CO3溶液中的Na+ 数目为2NA
B.标准状况下,11.2LSO3所含分子数为0.5NA
C.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
D.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
8.高铁酸钠(Na2FeO4)可以对饮用水进行净化处理,可由下列方法制得:
Fe2O3+3Na2O2 2Na2FeO4+Na2O,
关于该反应说法正确的是
A.Na2FeO4属于共价化合物
B.反应中Na2O2是氧化剂
C.生成1 mol Na2FeO4,有6 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
9.白黎芦醇广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用。1 mol该醇和Br2、H2分别反应,消耗Br2、H2的物质的量最多为
A.1 mol,1 mol B.3.5 mol,7 mol
C.3.5 mol,6 mol D.6 mol,7 mol
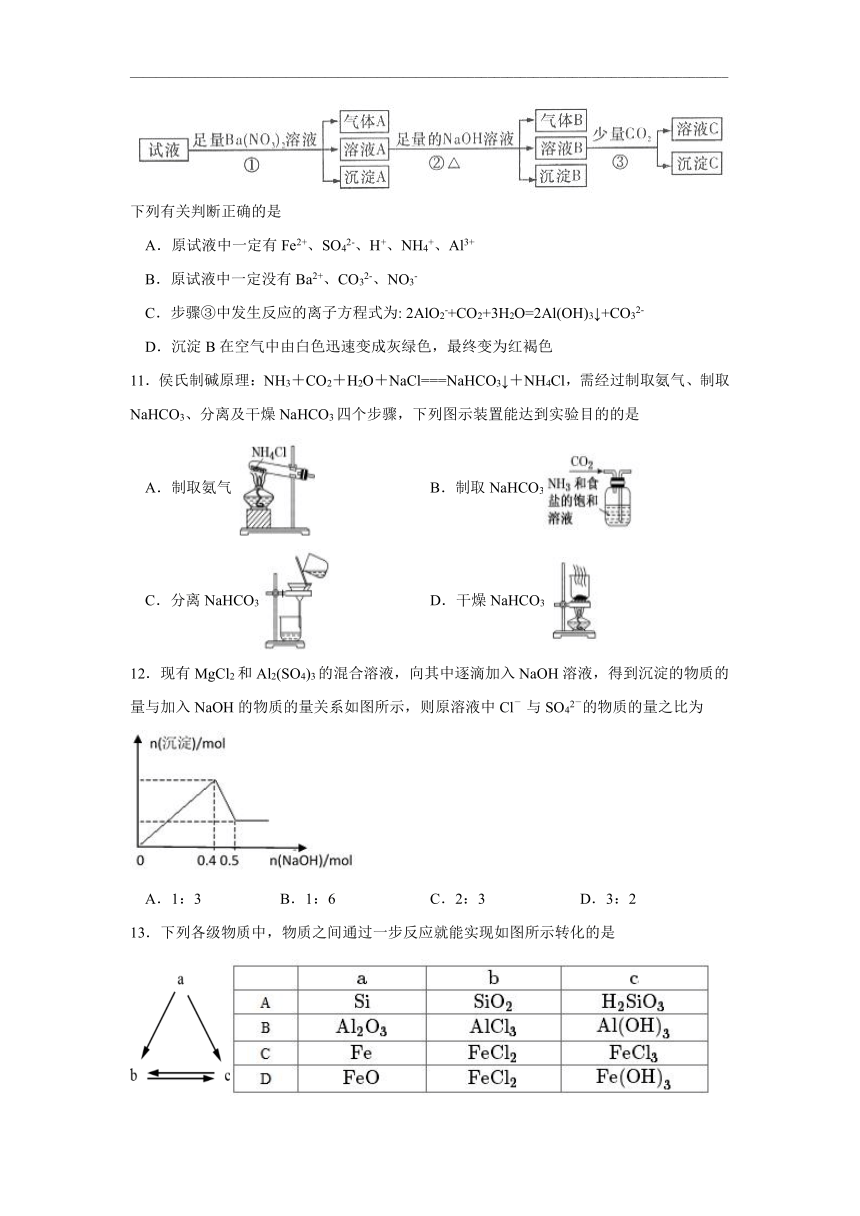
10.某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
下列有关判断正确的是
A.原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B.原试液中一定没有Ba2+、CO32-、NO3-
C.步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
11.侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是
A.制取氨气 B.制取NaHCO3
C.分离NaHCO3 D.干燥NaHCO3
12.现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
A.1:3 B.1:6 C.2:3 D.3:2
13.下列各级物质中,物质之间通过一步反应就能实现如图所示转化的是
A.A B.B C.C D.D
14.下列离子或分子在溶液中能大量共存,通后仍能大量共存的一组是
A. B.
C. D.
15.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比2∶4∶1∶1共存于同一溶液中,那么M可能是
A.Na+ B.OH- C.Cl- D.CO32-
16.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣═Fe3O4+S4O62﹣+2H2O,下列说法错误的是
A.每生成1mol Fe3O4,反应转移的电子总数为4NA
B.Fe2+和S2O32﹣都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为mol
D.x=4
17.根据下列反应:①2Fe3++2I-===2Fe2++I2 ②Br2+2Fe2+===2Fe3++2Br-
判断相关物质的氧化性由强到弱的顺序是
A.I- > Fe2+> Br- B.Br2 > Fe3+ > I2
C.Br2 > I2 > Fe3+ D.I2 > Fe3+> Br2
18.下列有水参加的反应,其中水作氧化剂的是
A.钠与水 B.二氧化氮与水 C.过氧化钠跟水 D.氯气与水
19.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是
A.氧化性强弱:I2B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+、Cl?
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I?+6Cl2=5I2+2Fe3++12Cl?
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I?+3Cl2=2I2+2Fe3++6Cl?
20.下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al ④Al(OH)3 ⑤MgO ⑥(NH4)2CO3
A.①②③④⑥ B.②③④⑤ C.①②③④ D.全部
21.L-多巴可用于帕金森综合症的治疗,其结构简式为 。下列关于L-多巴的说法中,不正确的是
A.分子式为C9H11O4N B.能缩合生成高分子
C.能与酸、碱反应生成盐 D.核磁共振氢谱有8个吸收峰
二、填空题
22.下图为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该NaOH溶液的物质的量浓度为_________mol/L。
(2)现在要配制该浓度的NaOH溶液100ml,需称量_________g固体氢氧化钠。溶液配制的所需的基本步骤如下:
(3)将上述实验步骤A到F按实验过程先后次序排列(不重复)_________。
(4)上述实验步骤A、B、E、F都用到的仪器名称为__________。
(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。
① 摇匀后发现液面低于刻度线再加水_________;
② 容量瓶中原有少量蒸馏水_________;
③ 定容时俯视观察液面_________。
23.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
24.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
回答下列问题:
(1)滤渣的成分为________,操作②的名称为_____________________。
(2)上图溶液B中所发生反应的离子方程式为____________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是____________________________________________________。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要_______________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为____________,其作用是________________________。
②点燃B处酒精灯之前必须进行的操作是____________________________。
25.化合物M是一种局部麻醉药的成分,实验室由芳香烃A合成M的一种路线如下:
已知:(1)B的苯环上有2种化学环境的氢原子
(2)
(3)RXRMgXRCH2CH2OH
回答下列问题:
(1)A的化学名称为_________,C中所含的官能团名称为____________。
(2)①的反应类型是___________,④的反应类型是_____________。
(3)F的核磁共振氢谱只有1组吸收峰,D和H生成M的化学方程式为____________________。
(4)D在一定条件下发生缩聚反应,生成的高分子产物的结构简式为_____________。
(5)L是H的同分异构体,L不能与金属钠反应,核磁共振氢谱只有两组峰,且峰面积比为6∶1,L的结构简式为_____________。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6己二醛[OHC(CH2)4CHO],设计合成路线:_______________________________________
化学试题答案
1.B2.D3.B4.B5.C6.C7.C8.B9.D10.B11.C12.C13.C14.A15.C16.C
17.B18.A19.D20.A21.D
22. 13分 每空2分
6 24.0 CBDFAE(3分) 100ml容量瓶 偏低 无影响 偏高
23.15分 未标注的每空2分
硫氰化钾、苯酚溶液 NaHCO3 制纯碱或作发酵粉 Al2O3+6H+=2Al3++3H2O SiO2+2OH-=SiO32—+H2O AlO2- + CO2 +2H2O=Al(OH)3↓+HCO3- 5.6×10-10mol·L (3分)
24.16分 未标注的每空2分
Fe、Cu 过滤(1分) 4Fe2++O2+8NH3+10H2O===8NH+4Fe(OH)3↓ 取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变(无变化)(或取上层清液少许于试管中,加入K3[Fe(CN)6]溶液不产生蓝色沉淀) 蒸发皿、玻璃棒 C B D 碱石灰 (1分) 防止空气中水蒸气进入前面装置中 检验氢气的纯度
25.14分
甲苯(1分) 硝基、羧基(2分) 取代反应(1分) 加成反应 (1分) ++H2O (2分) (2分) (2分) CH2=CH2CH2BrCH2Br (3分)
哈师大青冈实验中学2020年8月份考试
高三学年化学试题
可能用到的相对原子质量:Cu:64 O:16 C:12 Fe:56 Cl:35.5
选择题(每小题2分,共42分,每小题只有一个正确答案)
单选题
1.据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是
A.晶体硅 B.二氧化硅 C.铜合金 D.不锈钢
2.硅及其化合物是带来人类文明的重要物质。下列说法正确的是
A.CO2和SiO2都是由相应的分子构成的
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
D.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示
3.下列各组中的两种物质作用时,反应条件(温度、反应物用量、浓度等)改变,不会引起产物改变的是
A.NaOH和CO2 B.Fe粉在Cl2中燃烧
C.Na和O2 D.Cu和HNO3溶液
4.将3.2g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则消耗的硝酸的物质的量一共是
A.0.22mol B.0.2mol C.0.16mol D.0.1mol
5.下列离子方程式正确的是
A.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:
2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓
B.氯化铁溶液腐蚀铜电路板:Cu+Fe3+﹣═Fe2+ +Cu2+
C.已知:2Br﹣+Cl2=2Cl﹣+Br2,Br2+2Fe2+=2Fe3++2Br﹣,向含0.2molFeBr2的溶液中通入标准状况下3.36LCl2时,发生的反应为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣
D.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓
6.下列实验方案合理的是
A.制取少量CO2,可随开随制,随关随停 B.配制一定物质的量浓度的稀硫酸 C.可制得Fe(OH)2,并观察其颜色 D.干燥、收集NH3,并吸收多余的尾气
A.A B.B C.C D.D
7.NA表示阿伏加德罗常数,下列说法正确的是
A.1mol/L Na2CO3溶液中的Na+ 数目为2NA
B.标准状况下,11.2LSO3所含分子数为0.5NA
C.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
D.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
8.高铁酸钠(Na2FeO4)可以对饮用水进行净化处理,可由下列方法制得:
Fe2O3+3Na2O2 2Na2FeO4+Na2O,
关于该反应说法正确的是
A.Na2FeO4属于共价化合物
B.反应中Na2O2是氧化剂
C.生成1 mol Na2FeO4,有6 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
9.白黎芦醇广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用。1 mol该醇和Br2、H2分别反应,消耗Br2、H2的物质的量最多为
A.1 mol,1 mol B.3.5 mol,7 mol
C.3.5 mol,6 mol D.6 mol,7 mol
10.某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
下列有关判断正确的是
A.原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B.原试液中一定没有Ba2+、CO32-、NO3-
C.步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
11.侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是
A.制取氨气 B.制取NaHCO3
C.分离NaHCO3 D.干燥NaHCO3
12.现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
A.1:3 B.1:6 C.2:3 D.3:2
13.下列各级物质中,物质之间通过一步反应就能实现如图所示转化的是
A.A B.B C.C D.D
14.下列离子或分子在溶液中能大量共存,通后仍能大量共存的一组是
A. B.
C. D.
15.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比2∶4∶1∶1共存于同一溶液中,那么M可能是
A.Na+ B.OH- C.Cl- D.CO32-
16.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣═Fe3O4+S4O62﹣+2H2O,下列说法错误的是
A.每生成1mol Fe3O4,反应转移的电子总数为4NA
B.Fe2+和S2O32﹣都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为mol
D.x=4
17.根据下列反应:①2Fe3++2I-===2Fe2++I2 ②Br2+2Fe2+===2Fe3++2Br-
判断相关物质的氧化性由强到弱的顺序是
A.I- > Fe2+> Br- B.Br2 > Fe3+ > I2
C.Br2 > I2 > Fe3+ D.I2 > Fe3+> Br2
18.下列有水参加的反应,其中水作氧化剂的是
A.钠与水 B.二氧化氮与水 C.过氧化钠跟水 D.氯气与水
19.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是
A.氧化性强弱:I2
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I?+6Cl2=5I2+2Fe3++12Cl?
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I?+3Cl2=2I2+2Fe3++6Cl?
20.下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al ④Al(OH)3 ⑤MgO ⑥(NH4)2CO3
A.①②③④⑥ B.②③④⑤ C.①②③④ D.全部
21.L-多巴可用于帕金森综合症的治疗,其结构简式为 。下列关于L-多巴的说法中,不正确的是
A.分子式为C9H11O4N B.能缩合生成高分子
C.能与酸、碱反应生成盐 D.核磁共振氢谱有8个吸收峰
二、填空题
22.下图为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该NaOH溶液的物质的量浓度为_________mol/L。
(2)现在要配制该浓度的NaOH溶液100ml,需称量_________g固体氢氧化钠。溶液配制的所需的基本步骤如下:
(3)将上述实验步骤A到F按实验过程先后次序排列(不重复)_________。
(4)上述实验步骤A、B、E、F都用到的仪器名称为__________。
(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。
① 摇匀后发现液面低于刻度线再加水_________;
② 容量瓶中原有少量蒸馏水_________;
③ 定容时俯视观察液面_________。
23.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
24.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
回答下列问题:
(1)滤渣的成分为________,操作②的名称为_____________________。
(2)上图溶液B中所发生反应的离子方程式为____________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是____________________________________________________。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要_______________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为____________,其作用是________________________。
②点燃B处酒精灯之前必须进行的操作是____________________________。
25.化合物M是一种局部麻醉药的成分,实验室由芳香烃A合成M的一种路线如下:
已知:(1)B的苯环上有2种化学环境的氢原子
(2)
(3)RXRMgXRCH2CH2OH
回答下列问题:
(1)A的化学名称为_________,C中所含的官能团名称为____________。
(2)①的反应类型是___________,④的反应类型是_____________。
(3)F的核磁共振氢谱只有1组吸收峰,D和H生成M的化学方程式为____________________。
(4)D在一定条件下发生缩聚反应,生成的高分子产物的结构简式为_____________。
(5)L是H的同分异构体,L不能与金属钠反应,核磁共振氢谱只有两组峰,且峰面积比为6∶1,L的结构简式为_____________。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6己二醛[OHC(CH2)4CHO],设计合成路线:_______________________________________
化学试题答案
1.B2.D3.B4.B5.C6.C7.C8.B9.D10.B11.C12.C13.C14.A15.C16.C
17.B18.A19.D20.A21.D
22. 13分 每空2分
6 24.0 CBDFAE(3分) 100ml容量瓶 偏低 无影响 偏高
23.15分 未标注的每空2分
硫氰化钾、苯酚溶液 NaHCO3 制纯碱或作发酵粉 Al2O3+6H+=2Al3++3H2O SiO2+2OH-=SiO32—+H2O AlO2- + CO2 +2H2O=Al(OH)3↓+HCO3- 5.6×10-10mol·L (3分)
24.16分 未标注的每空2分
Fe、Cu 过滤(1分) 4Fe2++O2+8NH3+10H2O===8NH+4Fe(OH)3↓ 取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变(无变化)(或取上层清液少许于试管中,加入K3[Fe(CN)6]溶液不产生蓝色沉淀) 蒸发皿、玻璃棒 C B D 碱石灰 (1分) 防止空气中水蒸气进入前面装置中 检验氢气的纯度
25.14分
甲苯(1分) 硝基、羧基(2分) 取代反应(1分) 加成反应 (1分) ++H2O (2分) (2分) (2分) CH2=CH2CH2BrCH2Br (3分)
同课章节目录
