人教版高中选修四化学第四节:【难溶电解的溶解平衡】(51张ppt)
文档属性
| 名称 | 人教版高中选修四化学第四节:【难溶电解的溶解平衡】(51张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-20 12:36:29 | ||
图片预览











文档简介
(共51张PPT)
[复习]
1、什么叫饱和溶液?什么叫不饱和溶液?
一定温度下,不能再溶解溶质的溶液叫饱和
溶液。能继续溶解溶质的溶液叫不饱和溶液。
2、溶解性是指:________________________________
溶解性是物质的_______性质。
溶解性大小跟
___________________有关。
一种物质溶解在另一种物质中的能力。
物理
溶质、溶剂的性质
物质的溶解性只是粗略的表示物质的溶解能力的强弱,为了精确表示物质的溶解能力,化学上引入了“溶解度”的概念。
固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。
注意:条件:一定温度
标准:100克溶剂
状态:饱和状态
单位:克
任何物质的溶解是有条件的,在一定的条件下某物质的溶解量也是有限的,不存在无限可溶解的物质。
溶解度与溶解性的关系:20℃
易溶
物质
可溶
物质
微溶
物质
难溶
物质
S>10克
S>1克
S>0.01克
小于0.01克
(1)20℃时100克水里,溶解了36克氯化钠达到饱和状态,20℃时NaCl的溶解度是多少?
(2)20℃时,KClO3在水里的溶解度是
7.4g,这表示什么含义?
此时,溶液中溶质、溶剂、溶液的质量比是
。
练习
36克
20℃时,100克水中最多溶解7.4
克KClO3
7.4:100:107.4
[实验探究]
讨论:
⑴
NaCl在水溶液里达到溶液平衡状态时有何特征?
v(结晶)=v(溶解)
⑵
要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
(3)在饱和NaCl溶液中加入浓盐酸
探究实验
现象:NaCl饱和溶液中析出固体
解释:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(S)
Na+(aq)
+
Cl-(aq)
加浓盐酸Cl-
的浓度增加,平衡向左移,
NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
第三章
水溶液中的离子平衡
第四节
难溶电解质的溶解平衡
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
一、Ag+和Cl-的反应真能进行到底吗?
思考与交流:阅读课本P61
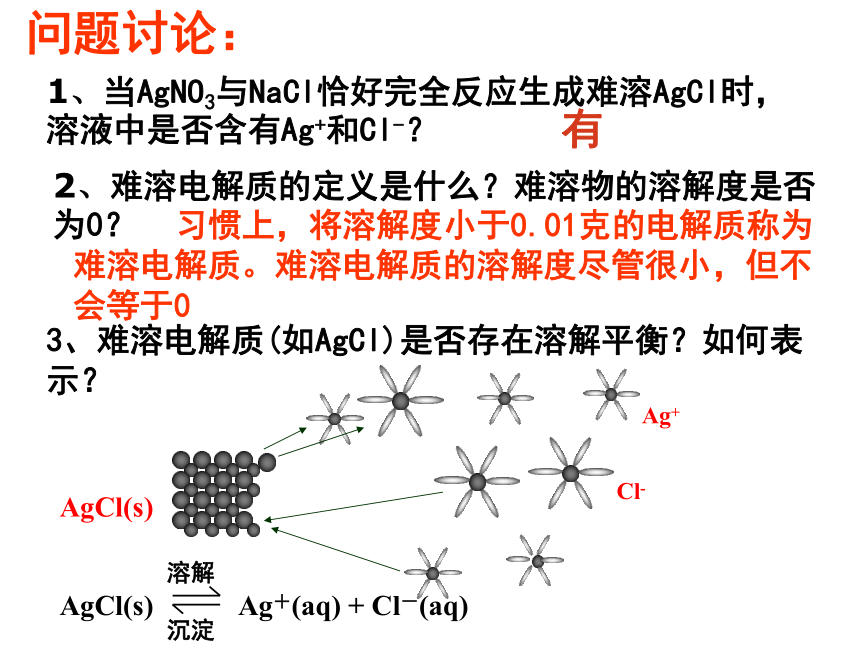
问题讨论:
1、当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?
2、难溶电解质的定义是什么?难溶物的溶解度是否为0?
3、难溶电解质(如AgCl)是否存在溶解平衡?如何表示?
有
习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0
Ag+
Cl-
溶解
AgCl(s)
Ag+(aq)
+
Cl-(aq)
沉淀
AgCl(s)
当v(溶解)=
v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡
1、有沉淀生成的复分解类型离子反应能不能完全进行到底呢?
不能,
沉淀即是难溶电解质,不是绝对不溶,只不过溶解度很小,难溶电解质在水中存在溶解平衡.
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
2、难溶电解质的溶解平衡
3)特征:
逆、等、动、定、变
1)概念:
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
4)影响难溶电解质溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
①内因:电解质本身的性质
②外因:
a)浓度:加水,平衡向溶解方向移动。
b)温度:升温,多数平衡向溶解方向移动。
练:书写碘化银、氢氧化镁溶解平衡的表达式
C)
同离子效应:加入含有相同离子电解质,平衡向结晶的方向移动.
科学视野
溶度积
P65页
1、定义:沉淀溶解平衡中,各离子浓度幂的乘积叫做溶度积(Ksp)
。
2、表达式
3、应用--
Qc为离子积
Qc>
Ksp,溶液过饱和,有沉淀析出。
Qc=Ksp,溶液饱和,沉淀与溶解平衡。
Qc<
Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
MmAn
(s)
mMn+(aq)+
nAm—(aq)
平衡时:Ksp=[c(Mn+)]m·[c(Am—)]n
说明:(1)对同种类型,Ksp越小其溶解度越小
(2)对于化学式中阴阳离子个数比不同的难溶电解质,不能直接比较Ksp的大小来确定其溶解能力的大小,常转化为溶解度来计算。
(3)溶液中各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积
课堂练习
1,
在100mL
0.01mol/LKCl
溶液中,加入
1mL
0.01mol/L
AgNO3
溶液,有沉淀(已知AgCl
KSP=1.8×10-10)
吗?
Ag+沉淀是否完全?
产生沉淀的唯一条件是Qc﹥Ksp
c(Ag+)=9·9×10-5mol/L,
c(Cl-)=
9·9×10-3mol/L
2.在下列溶液中,BaSO4的溶解度最大的是(
)
A)1mol/LH2SO4溶液
B)
2mol/LH2SO4溶液
C)
纯水
D)0
·1mol/LNa2SO4溶液
C
3.CaF2的Ksp=5·3×10-9,在c(F-)=3·0mol/L的溶液中,Ca2+的最大浓度(
)mol/L
1·8×10-9
B)
1·8×10-10
5·9×10-10
D)
5·9×10-9
4.
250c,在含有大量PbI2的饱和溶液中存在平衡
PbI2(s)
Pb2+(aq)
+
2I-(aq),加入KI溶液
正确(
)
A)溶液中Pb2+和I-浓度都增大
B)Ksp增大
C)沉淀溶解平衡向左移动
D)溶液中Pb2+浓度减小
C
Ca2+浓度最大即CaF2此时达饱和状态,Qc=Ksp
CD
5.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。
c(Ag2CrO4)=1·34×10-4mol/L
Ksp=9·62×10-12
二、沉淀反应的应用
1、沉淀的生成
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
(2)方法
a
、调pH
如:工业原料氯化铵中混有氯化铁,加氨水调pH值至7-8
b
、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、
H2S做沉淀剂
Cu2++S2-=CuS↓
Hg2++S2-=HgS↓
Fe3+
+
3NH3·H2O
=
Fe(OH)3↓
+
3NH4+
Cu2++H2S=CuS↓+2H+
Hg2++H2S=HgS↓+2H+
c、同离子效应法,例如硫酸钡在硫酸中
的溶解度比在纯水中小。
d、氧化还原法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
例:已知Fe3+在PH
3—4
之间开始沉淀,在PH
7—8
之间沉淀完全,而Fe2+,Cu2+在
8—9
之间开始沉淀
,11—12
之间沉淀完全。CuCl2中混有少量Fe2+如何除去?
先把Fe2+氧化成Fe3+,然后调PH至7到8使Fe3+转化为Fe(OH)3
沉淀,过滤除去沉淀。
氧化剂可用:氯气,双氧水,氧气等(不引入杂质)
调PH可用:氧化铜,碳酸铜等(不引入杂质)
氧化剂:
硝酸、高锰酸钾、氯气、氧气、双氧水等
调PH:
氨水、氢氧化钠、氧化铜、碳酸铜
思考与交流
1、如果要除去某溶液中的SO42-,你选择加
入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成
不可能使要除去的离子通过沉淀完全除去
a
、调pH
b
、加沉淀剂
c、同离子效应法
d、氧化还原法
【说明】(1)
沉淀剂的选择:要求除去溶液中的某种离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去。
(2)形成沉淀和沉淀完全的条件:由于难溶电解质溶解平衡的存在,在合理选用沉淀剂的同时,有时还要考虑溶液的pH和温度的调控。
(3)通过氧化还原反应等方式改变某离子的存在形式,促使其转变为溶解度更小的难溶电解质以便分离出去
沉淀生成的方法:
2、沉淀的溶解
(1)原理
设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
(2)举例
①
难溶于水的盐溶于酸中
如:CaCO3、FeS、Al(OH)3、Cu(OH)2溶
于盐酸。
分别写出有关的离子方程式
②难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
演示实验:
Mg(OH)2的溶解
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因?
Mg(OH)2
+
2H+
=
Mg2+
+
2H2O
Mg(OH)2
+
2
NH4+
==
Mg2+
2
NH3·H2O
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s)
?
Mg2+(aq)
+
2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
3、沉淀的转化
演示实验3-4、3-5
(1)记录现象,写出相应的方程式
(2)如果将上述两个实验中沉淀生成和转化的操作步骤颠倒顺序,会产生什么结果?
沉淀不会转化。沉淀只是从溶解度小的向溶解度更小的方向转化
⑴
沉淀的转化的实质:使溶液中的离子浓度更小
⑵
沉淀转化的应用
①
锅炉除水垢(CaSO4)
②
一些自然现象的解释
沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
(实验3-4、3-5 沉淀转化)
白色
黄色
黑色
写出有关的化学(或离子)方程式:
1,Cl-+
Ag+
=
AgCl↓
2,
AgCl
+
I-
=
AgI
+
Cl-
3,
2AgI
+
S2-
=
Ag2S
+
2I-
4,
Mg2+
+
2
OH-
=
Mg(OH)2↓
5,
3Mg(OH)2
+
2Fe3+
=
3Mg2+
+
2Fe(OH)3
锅炉水垢中含CaSO4,可先用Na2CO3溶液处理,使之转化为CaCO3,然后用酸除去,从CaSO4到CaCO3的沉淀转化中,存在着两个沉淀溶解平衡。
加入Na2CO3溶液后,CO32-与Ca2+结合生成更难溶的CaCO3沉淀,同时溶液中Ca2+的减少又使CaSO4的溶解平衡向右移动,CaSO4逐渐溶解。
怎样除去锅炉水垢中含有的CaSO4?
CaSO4
SO42-
+
Ca2+
+
CO32-
CaCO3
CaSO4
+
CO32-
=
CaCO3
+
SO42-
自然界中矿物的转化
原生铜的硫化物
CuSO4溶液
氧化、淋滤
渗透、遇闪锌矿(ZnS)
和方铅矿(PbS)
铜蓝(CuS)
【练习】
1)试用平衡移动原理解释下列事实
CaCO3不溶于水,但却能溶于稀盐酸中。
2)石灰乳中存在下列平衡:
Ca(OH)2(s)
Ca2+(aq)+2
OH―
(aq),
加入下列溶液,可使Ca(OH)2减少的是(
)
A.Na2CO3溶液
B.AlCl3溶液
C.NaOH溶液
D.CaCl2溶液
A
B
CaCO3(s)
CO32-(aq)
+
Ca2+(aq)
+H+
HCO3-
H2CO3
→
H2O+CO2↑
CaCO3(s)
CO32-(aq)
+
Ca2+(aq)
4.为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是(
)
A、NaOH
B、Na2CO3
C、氨水
D、MgO
3)在饱和澄清石灰水中加入生石灰反应后,恢复至原来温度下列说法正确的是(
)
A)溶液中钙离子浓度变大
B)溶液中氢氧化钙的质量分数增大
C)溶液的PH不变
D)溶液中钙离子的物质的量减少.
C
D
D
5.已知Ksp[Cu(OH)2
]=2.0
×
10-20
(1)某Cu(SO4)溶液里,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于(
)才能达到目的。
(2)要使0.2
mol/LCuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为(
)。
5
6
6、下列说法正确的是(????
)A、在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B、AgCl的KSP
=
1.8×10-10,在任何含AgCl固体的溶液中c(Ag+)
=
c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10
C、温度一定时,当溶液中Ag+和Cl-浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液
D、向饱和AgCl水溶液中加入盐酸,KSP值变大
C
7.下列说法正确的是
( )A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
D
8.
已知298K时,
氢氧化镁的溶度积常数
Ksp=
5.6×10-12,取适量的氢氧化镁滤液,加入一定量的烧碱达到沉淀溶液平衡,测得pH
=
13,则此温度下残留在溶液中的?c(Mg2+)
=
_________
5.6×10-10mol·L-1
9.
在25℃下,向浓度均为0.1
mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式)。已知25℃Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Cu(OH)2]=2.2×10-20。
Cu(OH)2
10.取5ml
0.002mol·L-1
BaCl2与等体积的
0.02mol·L-1
Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?BaSO4的
Ksp=1.0×10-10)
c(Ba2+)
=
1.2×10-8(mol·L-1)
Ba2+已沉淀完全
11.
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)
=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序是(
)
Ag2CrO4>AgCl>AgI
12.
25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:4.0×10-3mol·L-1HF溶液与4.0×10-4
mol·L-1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
298K:Ksp(CaF2)=1.5×10
-10
PH=4.0,根据图中数据可知c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)=1.5×10-10,此时有少量沉淀产生。
利用Qc与K关系
13.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线
)
如图
2-12-3,下列说法正确的是(
BC
14.
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的(
)
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
C
总结:
⑴.在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点
⑵.溶液在蒸发时,离子浓度的变化分两种情况:ⅰ、原溶液不饱和时,离子浓度要增大都增大;
ⅱ、原溶液饱和时,离子浓度都不变。
⑶.溶度积常数只是温度的函数,与溶液中
溶质的离子浓度无关,在同一曲线上的点,
溶度积常数相同。
[复习]
1、什么叫饱和溶液?什么叫不饱和溶液?
一定温度下,不能再溶解溶质的溶液叫饱和
溶液。能继续溶解溶质的溶液叫不饱和溶液。
2、溶解性是指:________________________________
溶解性是物质的_______性质。
溶解性大小跟
___________________有关。
一种物质溶解在另一种物质中的能力。
物理
溶质、溶剂的性质
物质的溶解性只是粗略的表示物质的溶解能力的强弱,为了精确表示物质的溶解能力,化学上引入了“溶解度”的概念。
固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。
注意:条件:一定温度
标准:100克溶剂
状态:饱和状态
单位:克
任何物质的溶解是有条件的,在一定的条件下某物质的溶解量也是有限的,不存在无限可溶解的物质。
溶解度与溶解性的关系:20℃
易溶
物质
可溶
物质
微溶
物质
难溶
物质
S>10克
S>1克
S>0.01克
小于0.01克
(1)20℃时100克水里,溶解了36克氯化钠达到饱和状态,20℃时NaCl的溶解度是多少?
(2)20℃时,KClO3在水里的溶解度是
7.4g,这表示什么含义?
此时,溶液中溶质、溶剂、溶液的质量比是
。
练习
36克
20℃时,100克水中最多溶解7.4
克KClO3
7.4:100:107.4
[实验探究]
讨论:
⑴
NaCl在水溶液里达到溶液平衡状态时有何特征?
v(结晶)=v(溶解)
⑵
要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
(3)在饱和NaCl溶液中加入浓盐酸
探究实验
现象:NaCl饱和溶液中析出固体
解释:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(S)
Na+(aq)
+
Cl-(aq)
加浓盐酸Cl-
的浓度增加,平衡向左移,
NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
第三章
水溶液中的离子平衡
第四节
难溶电解质的溶解平衡
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
一、Ag+和Cl-的反应真能进行到底吗?
思考与交流:阅读课本P61
问题讨论:
1、当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?
2、难溶电解质的定义是什么?难溶物的溶解度是否为0?
3、难溶电解质(如AgCl)是否存在溶解平衡?如何表示?
有
习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0
Ag+
Cl-
溶解
AgCl(s)
Ag+(aq)
+
Cl-(aq)
沉淀
AgCl(s)
当v(溶解)=
v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡
1、有沉淀生成的复分解类型离子反应能不能完全进行到底呢?
不能,
沉淀即是难溶电解质,不是绝对不溶,只不过溶解度很小,难溶电解质在水中存在溶解平衡.
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
2、难溶电解质的溶解平衡
3)特征:
逆、等、动、定、变
1)概念:
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
4)影响难溶电解质溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
①内因:电解质本身的性质
②外因:
a)浓度:加水,平衡向溶解方向移动。
b)温度:升温,多数平衡向溶解方向移动。
练:书写碘化银、氢氧化镁溶解平衡的表达式
C)
同离子效应:加入含有相同离子电解质,平衡向结晶的方向移动.
科学视野
溶度积
P65页
1、定义:沉淀溶解平衡中,各离子浓度幂的乘积叫做溶度积(Ksp)
。
2、表达式
3、应用--
Qc为离子积
Qc>
Ksp,溶液过饱和,有沉淀析出。
Qc=Ksp,溶液饱和,沉淀与溶解平衡。
Qc<
Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
MmAn
(s)
mMn+(aq)+
nAm—(aq)
平衡时:Ksp=[c(Mn+)]m·[c(Am—)]n
说明:(1)对同种类型,Ksp越小其溶解度越小
(2)对于化学式中阴阳离子个数比不同的难溶电解质,不能直接比较Ksp的大小来确定其溶解能力的大小,常转化为溶解度来计算。
(3)溶液中各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积
课堂练习
1,
在100mL
0.01mol/LKCl
溶液中,加入
1mL
0.01mol/L
AgNO3
溶液,有沉淀(已知AgCl
KSP=1.8×10-10)
吗?
Ag+沉淀是否完全?
产生沉淀的唯一条件是Qc﹥Ksp
c(Ag+)=9·9×10-5mol/L,
c(Cl-)=
9·9×10-3mol/L
2.在下列溶液中,BaSO4的溶解度最大的是(
)
A)1mol/LH2SO4溶液
B)
2mol/LH2SO4溶液
C)
纯水
D)0
·1mol/LNa2SO4溶液
C
3.CaF2的Ksp=5·3×10-9,在c(F-)=3·0mol/L的溶液中,Ca2+的最大浓度(
)mol/L
1·8×10-9
B)
1·8×10-10
5·9×10-10
D)
5·9×10-9
4.
250c,在含有大量PbI2的饱和溶液中存在平衡
PbI2(s)
Pb2+(aq)
+
2I-(aq),加入KI溶液
正确(
)
A)溶液中Pb2+和I-浓度都增大
B)Ksp增大
C)沉淀溶解平衡向左移动
D)溶液中Pb2+浓度减小
C
Ca2+浓度最大即CaF2此时达饱和状态,Qc=Ksp
CD
5.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。
c(Ag2CrO4)=1·34×10-4mol/L
Ksp=9·62×10-12
二、沉淀反应的应用
1、沉淀的生成
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
(2)方法
a
、调pH
如:工业原料氯化铵中混有氯化铁,加氨水调pH值至7-8
b
、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、
H2S做沉淀剂
Cu2++S2-=CuS↓
Hg2++S2-=HgS↓
Fe3+
+
3NH3·H2O
=
Fe(OH)3↓
+
3NH4+
Cu2++H2S=CuS↓+2H+
Hg2++H2S=HgS↓+2H+
c、同离子效应法,例如硫酸钡在硫酸中
的溶解度比在纯水中小。
d、氧化还原法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
例:已知Fe3+在PH
3—4
之间开始沉淀,在PH
7—8
之间沉淀完全,而Fe2+,Cu2+在
8—9
之间开始沉淀
,11—12
之间沉淀完全。CuCl2中混有少量Fe2+如何除去?
先把Fe2+氧化成Fe3+,然后调PH至7到8使Fe3+转化为Fe(OH)3
沉淀,过滤除去沉淀。
氧化剂可用:氯气,双氧水,氧气等(不引入杂质)
调PH可用:氧化铜,碳酸铜等(不引入杂质)
氧化剂:
硝酸、高锰酸钾、氯气、氧气、双氧水等
调PH:
氨水、氢氧化钠、氧化铜、碳酸铜
思考与交流
1、如果要除去某溶液中的SO42-,你选择加
入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成
不可能使要除去的离子通过沉淀完全除去
a
、调pH
b
、加沉淀剂
c、同离子效应法
d、氧化还原法
【说明】(1)
沉淀剂的选择:要求除去溶液中的某种离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去。
(2)形成沉淀和沉淀完全的条件:由于难溶电解质溶解平衡的存在,在合理选用沉淀剂的同时,有时还要考虑溶液的pH和温度的调控。
(3)通过氧化还原反应等方式改变某离子的存在形式,促使其转变为溶解度更小的难溶电解质以便分离出去
沉淀生成的方法:
2、沉淀的溶解
(1)原理
设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
(2)举例
①
难溶于水的盐溶于酸中
如:CaCO3、FeS、Al(OH)3、Cu(OH)2溶
于盐酸。
分别写出有关的离子方程式
②难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
演示实验:
Mg(OH)2的溶解
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因?
Mg(OH)2
+
2H+
=
Mg2+
+
2H2O
Mg(OH)2
+
2
NH4+
==
Mg2+
2
NH3·H2O
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s)
?
Mg2+(aq)
+
2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
3、沉淀的转化
演示实验3-4、3-5
(1)记录现象,写出相应的方程式
(2)如果将上述两个实验中沉淀生成和转化的操作步骤颠倒顺序,会产生什么结果?
沉淀不会转化。沉淀只是从溶解度小的向溶解度更小的方向转化
⑴
沉淀的转化的实质:使溶液中的离子浓度更小
⑵
沉淀转化的应用
①
锅炉除水垢(CaSO4)
②
一些自然现象的解释
沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
(实验3-4、3-5 沉淀转化)
白色
黄色
黑色
写出有关的化学(或离子)方程式:
1,Cl-+
Ag+
=
AgCl↓
2,
AgCl
+
I-
=
AgI
+
Cl-
3,
2AgI
+
S2-
=
Ag2S
+
2I-
4,
Mg2+
+
2
OH-
=
Mg(OH)2↓
5,
3Mg(OH)2
+
2Fe3+
=
3Mg2+
+
2Fe(OH)3
锅炉水垢中含CaSO4,可先用Na2CO3溶液处理,使之转化为CaCO3,然后用酸除去,从CaSO4到CaCO3的沉淀转化中,存在着两个沉淀溶解平衡。
加入Na2CO3溶液后,CO32-与Ca2+结合生成更难溶的CaCO3沉淀,同时溶液中Ca2+的减少又使CaSO4的溶解平衡向右移动,CaSO4逐渐溶解。
怎样除去锅炉水垢中含有的CaSO4?
CaSO4
SO42-
+
Ca2+
+
CO32-
CaCO3
CaSO4
+
CO32-
=
CaCO3
+
SO42-
自然界中矿物的转化
原生铜的硫化物
CuSO4溶液
氧化、淋滤
渗透、遇闪锌矿(ZnS)
和方铅矿(PbS)
铜蓝(CuS)
【练习】
1)试用平衡移动原理解释下列事实
CaCO3不溶于水,但却能溶于稀盐酸中。
2)石灰乳中存在下列平衡:
Ca(OH)2(s)
Ca2+(aq)+2
OH―
(aq),
加入下列溶液,可使Ca(OH)2减少的是(
)
A.Na2CO3溶液
B.AlCl3溶液
C.NaOH溶液
D.CaCl2溶液
A
B
CaCO3(s)
CO32-(aq)
+
Ca2+(aq)
+H+
HCO3-
H2CO3
→
H2O+CO2↑
CaCO3(s)
CO32-(aq)
+
Ca2+(aq)
4.为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是(
)
A、NaOH
B、Na2CO3
C、氨水
D、MgO
3)在饱和澄清石灰水中加入生石灰反应后,恢复至原来温度下列说法正确的是(
)
A)溶液中钙离子浓度变大
B)溶液中氢氧化钙的质量分数增大
C)溶液的PH不变
D)溶液中钙离子的物质的量减少.
C
D
D
5.已知Ksp[Cu(OH)2
]=2.0
×
10-20
(1)某Cu(SO4)溶液里,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于(
)才能达到目的。
(2)要使0.2
mol/LCuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为(
)。
5
6
6、下列说法正确的是(????
)A、在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B、AgCl的KSP
=
1.8×10-10,在任何含AgCl固体的溶液中c(Ag+)
=
c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10
C、温度一定时,当溶液中Ag+和Cl-浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液
D、向饱和AgCl水溶液中加入盐酸,KSP值变大
C
7.下列说法正确的是
( )A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
D
8.
已知298K时,
氢氧化镁的溶度积常数
Ksp=
5.6×10-12,取适量的氢氧化镁滤液,加入一定量的烧碱达到沉淀溶液平衡,测得pH
=
13,则此温度下残留在溶液中的?c(Mg2+)
=
_________
5.6×10-10mol·L-1
9.
在25℃下,向浓度均为0.1
mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式)。已知25℃Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Cu(OH)2]=2.2×10-20。
Cu(OH)2
10.取5ml
0.002mol·L-1
BaCl2与等体积的
0.02mol·L-1
Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?BaSO4的
Ksp=1.0×10-10)
c(Ba2+)
=
1.2×10-8(mol·L-1)
Ba2+已沉淀完全
11.
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)
=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序是(
)
Ag2CrO4>AgCl>AgI
12.
25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:4.0×10-3mol·L-1HF溶液与4.0×10-4
mol·L-1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
298K:Ksp(CaF2)=1.5×10
-10
PH=4.0,根据图中数据可知c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)=1.5×10-10,此时有少量沉淀产生。
利用Qc与K关系
13.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线
)
如图
2-12-3,下列说法正确的是(
BC
14.
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的(
)
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
C
总结:
⑴.在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点
⑵.溶液在蒸发时,离子浓度的变化分两种情况:ⅰ、原溶液不饱和时,离子浓度要增大都增大;
ⅱ、原溶液饱和时,离子浓度都不变。
⑶.溶度积常数只是温度的函数,与溶液中
溶质的离子浓度无关,在同一曲线上的点,
溶度积常数相同。
