1.2 物质的酸碱性 培优练习(含答案)
文档属性
| 名称 | 1.2 物质的酸碱性 培优练习(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 477.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-08-20 17:00:32 | ||
图片预览


文档简介
浙教版九年级科学第一章《物质及其变化》第二节培优练习
一、单选题
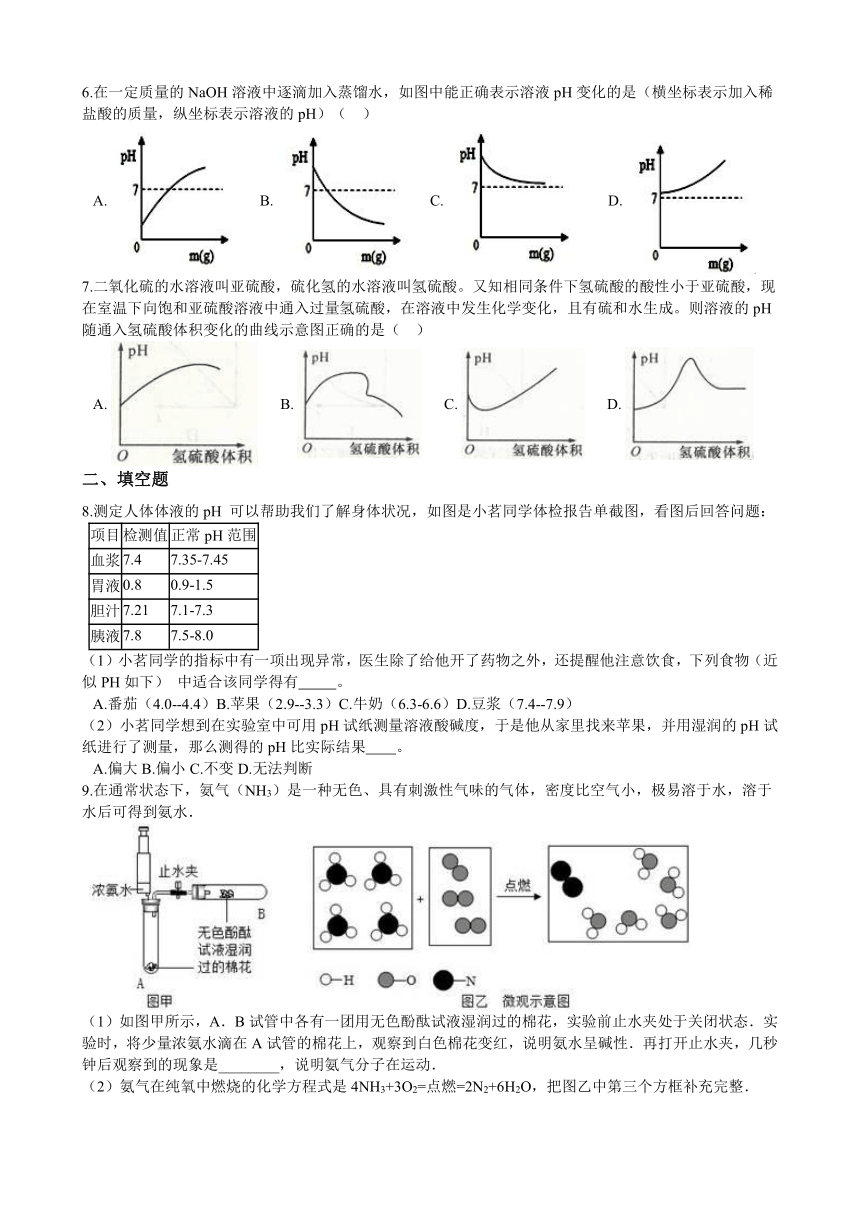
1.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是(??? )
A.?柠檬汁(pH:2~3) ????????????????????????B.?苹果汁(pH:3~4)
C.?西瓜汁(pH:5~6) ??????????????????D.?玉米汁(pH:7~8)
2.下图是身边一些物质pH,则下列有关说法正确的是(??? )
A.?pH试纸浸入溶液中测其酸碱度???????????????????????????B.?厕所清洁剂不会腐蚀大理石地面
C.?蚊虫叮咬后涂牙膏可减轻痛痒?????????????????????????????D.?橘子的酸性强于柠檬
3.一些物质的近似 pH 如图,下列有关说法正确的是(?? )
A.?苹果汁的酸性比纯鲜牛奶的酸性弱??????????????????????B.?肥皂水的碱性比炉具清洁剂的碱性强
C.?厕所清洁剂与炉具清洁剂能混用?????????????????????????D.?人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒
4.三氧化二碳(化学式C2O3)通常情况下是一种无色无味的气体,可溶于水,与水反应生成草酸,且常温下不稳定,其他的化学性质与一氧化碳相似。下列有关三氧化二碳说法正确的是( ???)
A.?三氧化二碳是由2个碳原子和3个氧原子构成的????B.?用干燥的蓝色石蕊试纸检测 C2O3时试纸变红
C.?在空气中充分燃烧的产物为二氧化碳??????????????????D.?不能与氢氧化钠溶液反应生成盐
5.某品牌矿泉水做了如图所示的广告:两个玻璃杯中分别盛有两种水样,水样中分别浸入pH试纸后,左侧一杯中的试纸呈现淡橘黄色(弱酸性),右侧一杯中的试纸呈现淡绿色(弱碱性),广告宣称弱碱性的水对人体健康有利。下列有关叙述中,正确的是(?? )
A.?左侧杯中的矿泉水能使无色酚酞变红色 ??
B.?左侧杯中的矿泉水一定含有氢氧根离子
C.?将右侧杯中的 pH 试纸与标准比色卡对照,能读出水样的pH值为6.72
D.?用 pH 试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上
6.在一定质量的NaOH溶液中逐滴加入蒸馏水,如图中能正确表示溶液pH变化的是(横坐标表示加入稀盐酸的质量,纵坐标表示溶液的pH)(?? )
A.???????B.???????C.???????D.?
7.二氧化硫的水溶液叫亚硫酸,硫化氢的水溶液叫氢硫酸。又知相同条件下氢硫酸的酸性小于亚硫酸,现在室温下向饱和亚硫酸溶液中通入过量氢硫酸,在溶液中发生化学变化,且有硫和水生成。则溶液的pH随通入氢硫酸体积变化的曲线示意图正确的是(?? )
A.???????B.???????C.???????D.?
二、填空题
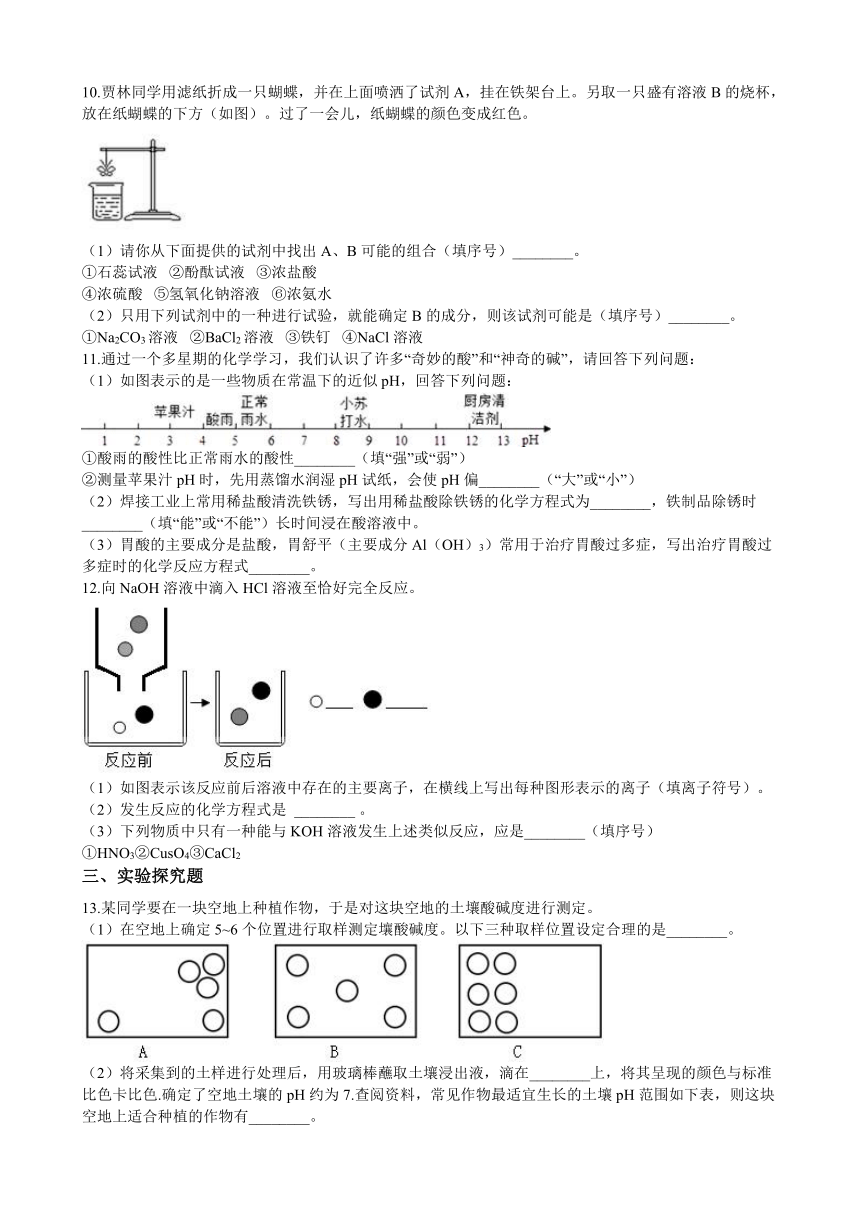
8.测定人体体液的pH 可以帮助我们了解身体状况,如图是小茗同学体检报告单截图,看图后回答问题:
项目
检测值
正常pH范围
血浆
7.4
7.35-7.45
胃液
0.8
0.9-1.5
胆汁
7.21
7.1-7.3
胰液
7.8
7.5-8.0
(1)小茗同学的指标中有一项出现异常,医生除了给他开了药物之外,还提醒他注意饮食,下列食物(近似PH如下) 中适合该同学得有?? ??????。
A.番茄(4.0--4.4)B.苹果(2.9--3.3)C.牛奶(6.3-6.6)D.豆浆(7.4--7.9)
(2)小茗同学想到在实验室中可用pH试纸测量溶液酸碱度,于是他从家里找来苹果,并用湿润的pH试纸进行了测量,那么测得的pH比实际结果? ?????。
A.偏大B.偏小C.不变D.无法判断
9.在通常状态下,氨气(NH3)是一种无色、具有刺激性气味的气体,密度比空气小,极易溶于水,溶于水后可得到氨水.
(1)如图甲所示,A.B试管中各有一团用无色酚酞试液湿润过的棉花,实验前止水夹处于关闭状态.实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性.再打开止水夹,几秒钟后观察到的现象是________,说明氨气分子在运动.
(2)氨气在纯氧中燃烧的化学方程式是4NH3+3O2=点燃=2N2+6H2O,把图乙中第三个方框补充完整.
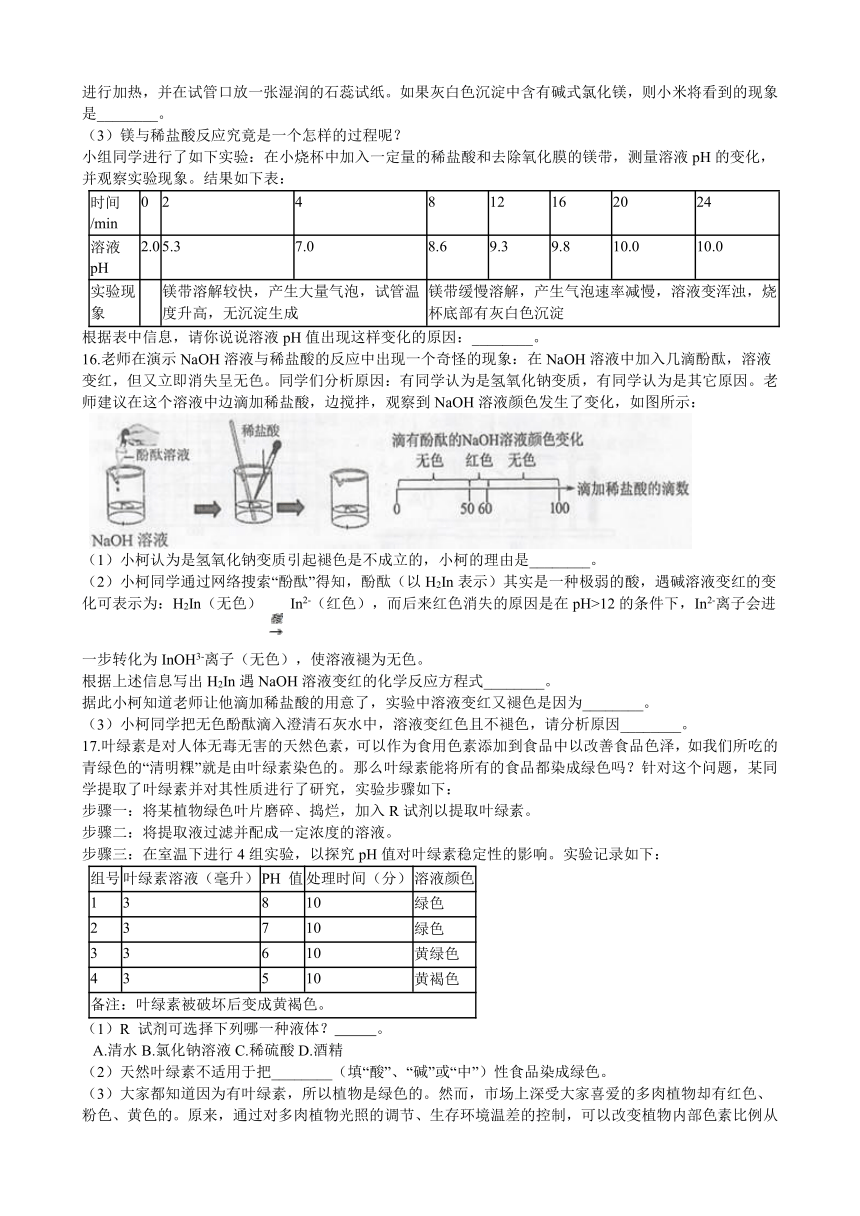
10.贾林同学用滤纸折成一只蝴蝶,并在上面喷洒了试剂A,挂在铁架台上。另取一只盛有溶液B的烧杯,放在纸蝴蝶的下方(如图)。过了一会儿,纸蝴蝶的颜色变成红色。
(1)请你从下面提供的试剂中找出A、B可能的组合(填序号)________。
①石蕊试液? ②酚酞试液? ③浓盐酸?
④浓硫酸? ⑤氢氧化钠溶液? ⑥浓氨水
(2)只用下列试剂中的一种进行试验,就能确定B的成分,则该试剂可能是(填序号)________。
①Na2CO3溶液? ②BaCl2溶液? ③铁钉? ④NaCl溶液
11.通过一个多星期的化学学习,我们认识了许多“奇妙的酸”和“神奇的碱”,请回答下列问题:
(1)如图表示的是一些物质在常温下的近似pH,回答下列问题:
?
①酸雨的酸性比正常雨水的酸性________(填“强”或“弱”)
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏________(“大”或“小”)
(2)焊接工业上常用稀盐酸清洗铁锈,写出用稀盐酸除铁锈的化学方程式为________,铁制品除锈时________(填“能”或“不能”)长时间浸在酸溶液中。???
(3)胃酸的主要成分是盐酸,胃舒平(主要成分Al(OH)3)常用于治疗胃酸过多症,写出治疗胃酸过多症时的化学反应方程式________。
12.向NaOH溶液中滴入HCl溶液至恰好完全反应。
(1)如图表示该反应前后溶液中存在的主要离子,在横线上写出每种图形表示的离子(填离子符号)。
(2)发生反应的化学方程式是 ________?。
(3)下列物质中只有一种能与KOH溶液发生上述类似反应,应是________(填序号)
①HNO3②CusO4③CaCl2
三、实验探究题
13.某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定壤酸碱度。以下三种取样位置设定合理的是________。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在________上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有________。
作物
大蒜
丝瓜
茄子
沙枣
最适pH范围
5.6~6.0
6.0~6.5
6.8~7.3
8.0~8.7
14.氯气(Cl2)是一种黄绿色气体,它可溶于水,得到黄绿色的氯水。它易与氢氧化钠反应,不与硫酸反应。
(1)小明对氯气溶于水的过程中所发生的变化提出了两种假设:
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显________?性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
(2)小明对褪色现象产生了兴趣,查阅资料后了解到氯水有漂白性。氯水中有氯气分子,还有氯气与水反应得到的盐酸和次氯酸(HClO)。他对氯水的漂白性提出了3种假设:
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据________?。
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的________处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。
(3)次氯酸除有漂白性外还有不稳定性。小明设计了一套装置,收集到一试管次氯酸见光分解后生成的气体,将带火星的木条伸入试管,发现木条复燃,说明分解产物中含有________。
15.某兴趣小组为探究金属镁的化学性质,做了镁与稀盐酸反应的实验。小柯同学做镁粉与稀盐酸反应的实验时发现试管温度明显升高,并在试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:
【提出假设】
假设一:可能含有氯化镁
假设二:可能含有镁粉
假设三:可能含有氢氧化镁
【查阅资料】①镁可与热水反应生成氢氧化镁;②氢氧化镁在水中溶解度很小,水溶液呈弱碱性。
【设计并进行实验】各取少量灰白色沉淀加入2支试管中,进行如下实验:
编号
实验操作
实验现象
实验1
加入一定温度的蒸馏水、搅拌
沉淀未见减少
实验2
加入适量稀盐酸
沉淀全部溶解,没有气泡产生
【得出结论】根据实验2现象,说明假设 ?????不成立。
二
【实验思考】
(1)如果假设三成立,请写出实验2中发生的反应方程式:________。
(2)实验后同学们请教老师得知,灰白色沉淀的主要成分是碱式氯化镁(Mg(OH)2·MgCl2),碱式氯化镁受热易分解产生氯化氢气体。为了验证试管中的灰白色沉淀中含有碱式氯化镁,小米把灰白色沉淀放进试管进行加热,并在试管口放一张湿润的石蕊试纸。如果灰白色沉淀中含有碱式氯化镁,则小米将看到的现象是________。
(3)镁与稀盐酸反应究竟是一个怎样的过程呢?
小组同学进行了如下实验:在小烧杯中加入一定量的稀盐酸和去除氧化膜的镁带,测量溶液pH的变化,并观察实验现象。结果如下表:
时间/min
0
2
4
8
12
16
20
24
溶液pH
2.0
5.3
7.0
8.6
9.3
9.8
10.0
10.0
实验现象
镁带溶解较快,产生大量气泡,试管温度升高,无沉淀生成
镁带缓慢溶解,产生气泡速率减慢,溶液变浑浊,烧杯底部有灰白色沉淀
根据表中信息,请你说说溶液pH值出现这样变化的原因:________。
16.老师在演示NaOH溶液与稀盐酸的反应中出现一个奇怪的现象:在NaOH溶液中加入几滴酚酞,溶液变红,但又立即消失呈无色。同学们分析原因:有同学认为是氢氧化钠变质,有同学认为是其它原因。老师建议在这个溶液中边滴加稀盐酸,边搅拌,观察到NaOH溶液颜色发生了变化,如图所示:
(1)小柯认为是氢氧化钠变质引起褪色是不成立的,小柯的理由是________。
(2)小柯同学通过网络搜索“酚酞”得知,酚酞(以H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为:H2In(无色) In2-(红色),而后来红色消失的原因是在pH>12的条件下,In2-离子会进一步转化为InOH3-离子(无色),使溶液褪为无色。
根据上述信息写出H2In遇NaOH溶液变红的化学反应方程式________。
据此小柯知道老师让他滴加稀盐酸的用意了,实验中溶液变红又褪色是因为________。
(3)小柯同学把无色酚酞滴入澄清石灰水中,溶液变红色且不褪色,请分析原因________。
17.叶绿素是对人体无毒无害的天然色素,可以作为食用色素添加到食品中以改善食品色泽,如我们所吃的青绿色的“清明粿”就是由叶绿素染色的。那么叶绿素能将所有的食品都染成绿色吗?针对这个问题,某同学提取了叶绿素并对其性质进行了研究,实验步骤如下:
步骤一:将某植物绿色叶片磨碎、捣烂,加入R试剂以提取叶绿素。
步骤二:将提取液过滤并配成一定浓度的溶液。
步骤三:在室温下进行4组实验,以探究pH值对叶绿素稳定性的影响。实验记录如下:
组号
叶绿素溶液(毫升)
PH 值
处理时间(分)
溶液颜色
1
3
8
10
绿色
2
3
7
10
绿色
3
3
6
10
黄绿色
4
3
5
10
黄褐色
备注:叶绿素被破坏后变成黄褐色。
(1)R 试剂可选择下列哪一种液体? ?????????。
A.清水B.氯化钠溶液C.稀硫酸D.酒精
(2)天然叶绿素不适用于把________(填“酸”、“碱”或“中”)性食品染成绿色。
(3)大家都知道因为有叶绿素,所以植物是绿色的。然而,市场上深受大家喜爱的多肉植物却有红色、粉色、黄色的。原来,通过对多肉植物光照的调节、生存环境温差的控制,可以改变植物内部色素比例从而改变多肉植物颜色。多肉植物由于光照温差的不同而产生的这种性状变化________(填“能”或“不能”)遗传。
18.浣纱初中同学开展了如图所示“溶液酸碱性的检验”的实验活动:
把自制的紫甘蓝(紫色包心菜)如图(1)所示分别滴加到试管中,观察到的现象如表所示:
溶液
白醋
盐酸
食盐水
草木灰水
石灰水
加入紫甘蓝汁后的颜
红色
红色
紫色
蓝
蓝
(1)观察表中的紫甘蓝汁颜色变化情况,紫甘蓝汁________(填“能”或“不能”)作为酸碱指示剂,遇到氢氧化钠溶液显示的颜色是________;
(2)用pH试纸测定图1中部分溶液的酸碱度:白醋pH________7(填“>”、“<”或“=”);
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中可能导致被测溶液的pH数值发生改变的错误操作是________。
答案解析部分
一、单选题
1. D
【分析】酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7,据此判断。
【解答】A.柠檬汁(pH:2~3) <7,呈酸性,故A错误;
B.苹果汁(pH:3~4)<7,呈酸性,故B错误;
C.西瓜汁(pH:5~6)<7,呈酸性,故C错误;
D.玉米汁(pH:7~8) >7,呈碱性,故D正确。
故选D。
2. C
【分析】A、根据pH试纸的使用方法分析;
B、根据酸性物质与大理石成分碳酸钙可反应分析;
C、根据中和反应的应用分析;
D、根据溶液pH小于7呈酸性,越小酸性越强分析。
【解答】A、 pH试纸不能浸入溶液中测其酸碱度,要用玻璃棒滴加,不符合题意;
B、 厕所清洁剂呈酸性,会腐蚀大理石地面?,不符合题意;
C、蚊虫分泌的液体呈酸性,牙膏呈碱性,可缓解痛痒,符合题意;
D、 橘子的pH大于柠檬,酸性比柠檬弱,不符合题意;
故答案为:C。?
3. D
【分析】(1)酸性溶液的pH<7,碱性溶液的pH>7;
(2)当溶液为酸性时,溶液的pH越小,酸性越强;当溶液为碱性时,溶液的pH越小,碱性越弱;
(3)酸与碱发生中和反应生成盐和水。
【解答】A.苹果汁的pH=3左右,纯鲜牛奶的pH在6和7之间;因为苹果汁的pH小,所以它的酸性强,故A错误;?
B.肥皂水的pH=10左右,而炉具清洁剂的pH在12~13之间;因为肥皂水的pH小,所以它的碱性弱,故B错误;
C.厕所清洁剂pH值在1~2之间,为酸性溶液,而炉具清洁剂pH值在12~13之间为碱性溶液,二者不能混用,故C错误;?
D.人被某些蚊虫叮咬后,由于它们的分泌液成酸性,所以感觉疼痛,可涂抹呈碱性的肥皂水,二者发生中和反应减轻痛苦,故D正确。
故选D。
4. C
【分析】(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2) ?C2O3时本身没有酸性,只有溶于水形成草酸,才具有酸性;
(3)根据一氧化碳燃烧的产物分析;
(4)分析草酸是否能和氢氧化钠反应即可。
【解答】A.根据化学式C2O3可知,三氧化二碳分子是由2个碳原子和3个氧原子构成的,故A错误;
B. 用干燥的蓝色石蕊试纸检测 C2O3时,由于没有草酸生产,试纸不会变红,故B错误;
C.一氧化碳在空气中充分燃烧的产物为二氧化碳,而它的性质与一氧化碳相似,故C正确;
D.三氧化二碳溶于水形成草酸,而草酸与氢氧化钠反应生成草酸钠和水,故D错误。
故选C。?
5. D
【分析】(1)酚酞试液遇酸不变色,遇碱变红色;
(2)碱性溶液中一定含有氢氧根离子,酸性溶液中肯定含有氢离子;
(3)酸性溶液的pH<7,碱性溶液的pH>7;
(4)根据测定溶液pH的方法判断。
【解答】A.左侧杯中的矿泉水呈酸性,因此酚酞应该无色,故A错误;
B.左侧杯中的矿泉水呈酸性,肯定不含有氢氧根离子,故B错误;
C.右侧杯中的矿泉水呈碱性,pH值肯定大于7,故C错误;
D.用 pH 试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上,故D正确。
故选D。
6. C
【分析】溶液的氢离子的浓度越大,酸性越强,pH值越小;溶液的氢氧根离子的浓度越大,碱性越弱,pH值越大,据此分析即可。
【解答】在一定质量的NaOH溶液中逐滴加入蒸馏水,溶液中氢氧根离子的浓度减小,那么它的pH值减小;但是无论加入多少水,溶液的pH都不可能小于7.
故选C。
7. D
【分析】根据酸性溶液pH小于7,且酸性越强pH越小及反应过程中物质的变化情况分析。
【解答】酸性溶液pH小于7,且酸性越强pH越小, 室温下向饱和亚硫酸溶液中通入过量氢硫酸,在溶液中发生化学变化,有硫和水生成,随着反应的发生,溶液的酸性变弱,pH会不断变大,图像会是一条上升的曲线,恰好反应时pH等于7,继续通入硫化氢气体会再次显酸性,但由于氢硫酸的酸性弱于亚硫酸,故溶液最后的pH会比开始时大;
故答案为:D。
二、填空题
8. (1)D
(2)A
【分析】(1)根据表格确定该同学的胃酸是否正常,然后根据酸碱中和的原理选择适合的食物;
(2)酸性溶液被稀释后,浓度碱性,酸性减弱,pH增大。
【解答】(1)根据表格可知,该同学的胃液检测值不在正常范围内,即酸性较大,因此应该选择碱性食物进行调整,因为豆浆的Ph>7呈碱性,所以选D;
(2)苹果呈酸性,如果使用湿润的pH试纸,会将被检测的苹果汁稀释,浓度变小,pH增大,故选A。
9. (1)试管B中白色棉花变红
(2)
【分析】(1)浓氨水挥发出氨气,氨气分子在不停的做无规则运动,会向上运动与B中的棉花接触。由于棉花用无色酚酞试液浸润过,所以会变成红色;
(2)根据化学方程式确定生成物中水分子和氮气分子的个数,将不足的补全即可。
【解答】(1)实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性.再打开止水夹,几秒钟后观察到的现象是试管B中白色棉花变红,说明氨气分子在运动;
(1)根据化学方程式; 4NH3+3O22N2+6H2O可知,生成物中应该有2个氮气分子和6个水分子;现在第三个方框中,已经有1个氮气分子和5个水分子,因此只要补充1个氮气分子和1个水分子即可,如下图:
10. (1)①③或②⑥
(2)①③
【分析】(1)石蕊遇酸变红色,酚酞遇碱变红色,据此分析即可;
(2)加入某种试剂后,两种溶液必须出现明显的不同现象,才能确定B的成分。
【解答】(1)如果试剂A为石蕊试液,那么它下面的烧杯中必须会发出一种气体,与水结合形成酸;因为浓盐酸具有挥发性,能够挥发出HCl气体,所以组合A、B可以是:①③;
如果试剂A为酚酞试液,那么它下面的烧杯中必须挥发一种气体,与水结合后成碱性;因为浓氨水能够挥发出氨气,而氨气溶于水呈碱性,所以组合A、B可以是:②⑥;
(2)B要么是浓盐酸,要么是浓氨水。
①碳酸钠与浓盐酸反应生成二氧化碳气体,而浓氨水与碳酸钠不反应,故A符合题意;
②氯化钡溶于与浓盐酸和浓氨水都不反应,故B不合题意;
③铁钉与浓盐酸反应生成氢气,而铁钉与浓氨水不反应,故C符合题意;
④氯化钠溶液与浓盐酸、浓氨水都不反应,故D不合题意。
故选①③。
11. (1)强;大
(2)6HCl+Fe2O3=2FeCl3+3H2O;不能
(3)3HCl+Al(OH)3=AlCl3+3H2O
【分析】(1)①比较酸雨和正常雨水的pH大小,pH值越小,酸性越强;
②酸性溶液的浓度越小,酸性越小,溶液的pH越大;
(2)铁锈与稀盐酸反应生成氯化铁和水,据此写出反应的化学方程式;铁单质与稀盐酸反应生成氯化亚铁和氢气;
(3)稀盐酸与氢氧化铝反应生成氯化铝和水,据此写出反应的化学方程式。
【解答】(1)①酸雨的pH为4~5,正常雨水的pH为5~6,因此酸雨的酸性比正常雨水的酸性强;
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使苹果汁的浓度减小;因为苹果汁呈酸性,所以会使pH值偏大;
(2)焊接工业上常用稀盐酸清洗铁锈,写出用稀盐酸除铁锈的化学方程式为: 6HCl+Fe2O3=2FeCl3+3H2O ;铁制品除锈时不能长时间浸在酸溶液中,因为它会与酸反应生成氢气;
(3) 治疗胃酸过多症时的化学反应方程式 : 3HCl+Al(OH)3=AlCl3+3H2O 。
12. (1)OH-;Na+
(2)HCl+NaOH=NaCl+H2O
(3)①
【分析】酸碱中和反应 实质是氢离子和氢氧根离子结合生成水分子。
【解答】HCl+NaOH=NaCl+H2O,中和反应的实质是氢离子和氢氧根离子结合生成水分子,故最后还存在的离子是钠离子和氯离子。氢氧化钾含有氢氧根,能与之反应的应该含有氢离子。
故答案为:(1)
OH-;Na+;(2) HCl+NaOH=NaCl+H2O;(3) ①
三、实验探究题
13. (1)B
(2)pH试纸;茄子
【分析】(1)在进行取样时,尽可能的在所有范围内进行,避免取样位置过于集中,影响对整个土壤酸碱度的判断;
(2)根据测定溶液pH值的方法进行解答;土壤的pH值在哪种作物的最适pH值范围内,就适合种这种作物。
【解答】(1)根据图片可知,A和C中的取样位置过于集中,很大范围没有取到,而B中六个取样位置平均分布,覆盖面更大,因此合理的是B;
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在pH试纸上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7。
因为7在6.8~7.3之间,所以这块空地适合种植的作物是茄子。
14. (1)酸
(2)盐酸能使紫色石蕊试液变红,且不褪色;
(3)氧气
【分析】(1)根据石蕊试液遇酸性溶液变红分析;
(2)根据盐酸能使石蕊试液变红及除杂时气体要长导管进短导管出分析;
(3)根据氧气的验证方法分析。
【解答】(1)石蕊试液遇酸性溶液变红, 向氯水中加入紫色石蕊试液,发现溶液变红,说明氯水显酸性;
(2) 盐酸能使紫色石蕊试液变红,且不褪色,说明盐酸不具有漂白性,即A假设不成立;气体干燥时为使药品充分接触,要长导管进气,短导管排出,由此画出装置图;
(3)能使木条复燃的气体为氧气;
故答案为:(1)酸;(2)盐酸能使紫色石蕊试液变红,且不褪色; ;(3)氧气。
15. (1)2HCl+Mg(OH)2=MgCl2+2H2O
(2)石蕊试纸变红(石蕊试纸呈现红色)
(3)镁先与稀盐酸反应,溶液pH值升高;当盐酸消耗完,pH值显中性;接着镁就与热水应生成氢氧化镁沉淀,同时溶液pH值升高呈碱性
【分析】【得出结论】如果白色沉淀中含有金属镁,那么它会与稀盐酸反应生成氯化镁和氢气,肯定有气泡产生,据此分析判断;
【实验思考】(1)氢氧化镁和稀盐酸反应,生成氯化镁和水,据此写出假设三中的化学方程式;
(2)碱式氯化镁受热分解产生氯化氢气体,而氯化氢溶于水形成稀盐酸,遇到湿润的石蕊试纸会使其变成红色;
(3)当试管内存在稀盐酸且温度较低时,镁与稀盐酸反应,据此分析溶液pH的改变和温度的改变。当稀盐酸完全反应后,试管内的水温度较高,镁则与水再次发生反应,据此分析沉淀的原因和溶液pH值的改变。
【解答】【得出结论】根据实验2现象,说明白色沉淀中没有金属镁的存在,即假设二不成立。
【实验思考】(1)如果假设三成立,请写出实验2中发生的反应方程式:2HCl+Mg(OH)2=MgCl2+2H2O;
(2)如果灰白色沉淀中含有碱式氯化镁,则小米将看到的现象是:石蕊试纸变红(石蕊试纸呈现红色)。
(3)溶液pH值出现变化的原因是:镁先与稀盐酸反应,溶液pH值升高;当盐酸消耗完,pH值显中性;接着镁就与热水应生成氢氧化镁沉淀,同时溶液pH值升高呈碱性。
16. (1)变质后的碳酸钠溶液也是呈碱性
(2)2NaOH+H2ln=Na2ln+2H2O;酚酞先与氢氧化钠反应产生In2-离(红色),又由于碱性太强,In2-离子进一步转化为InOH3-离子(无色),于是溶液褪为无色。
(3)酚酞一直显红色,因为石灰水的碱性较弱pH<12
【分析】(1)碳酸钠变质的过程,其实就是它与二氧化碳反应生成碳酸钠的过程,碳酸钠虽然是盐,但是它的水溶液呈碱性;
(2)分析氢氧化钠和酚酞变红时的反应产物,然后写出反应的化学方程式;酚酞之所以变色后又无色,是因为溶液的碱性太强,加入稀盐酸,可以使溶液的pH碱性,从而是酚酞再次变色,这个过程足以证明酚酞变色是先后经历了两个过程;
(3)根据右图可知,酚酞要变红色,那么溶液的碱性不能太强,pH<12才行,据此分析原因。
【解答】(1)小柯认为是氢氧化钠变质引起褪色是不成立的,小柯的理由是:变质后的碳酸钠溶液也是呈碱性。
(2)根据 H2In(无色)??In2-(红色) 可知, H2In遇NaOH 反应应该生成 Na2ln和H2O,那么反应的化学方程式为: 2NaOH+H2ln=Na2ln+2H2O;
实验中溶液变红又褪色是因为 : 酚酞先与氢氧化钠反应产生In2-离(红色),又由于碱性太强,In2-离子进一步转化为InOH3-离子(无色),于是溶液褪为无色。
(3)小柯同学把无色酚酞滴入澄清石灰水中,溶液变红色且不褪色,原因为:酚酞一直显红色,因为石灰水的碱性较弱,pH<12。
?
17. (1)D
(2)酸
(3)不能
【分析】(1)叶绿素能够溶解在酒精中。
?(2)对照图表格中的数据观察不同PH值对叶绿素的影响解题即可。
?(3)植物的基因决定性状,如果基因不改变,那么性状也不会改变。
【解答】(1)由于酒精能溶解叶绿素,所以实验时选择用酒精,因此 R 试剂可选择酒精。
?(2)由表格信息可知,酸性条件下可使叶绿素变成黄褐色,所以若用作食品色素,天然叶绿素不适用于pH小于6.0的食品,否则叶绿素会由于酸性而被破坏。?因此天然叶绿素不适用于酸性食品染成绿色。
?(3)属于不可以遗传的变异,这种多肉植物的形成条件是,通过光照、温差控制来改变植物内部色素的比例,植物本身的基因并沒有改变,因此是不可遗传变异,?故多肉植物由于光照温差的不同而产生的这种性状变化不能遗传。
故答案为:(1)D(2)酸(3)?不能
18. (1)能;蓝
(2)<
(3)C
【分析】(1)如果紫甘蓝汁遇到酸和碱时能够呈现不同的颜色,那么它能做酸碱指示剂;根据表格确定它遇到碱时呈现的颜色;
(2)酸溶液的pH<7,碱溶液的pH>7;
(3)如果点滴板是潮湿的,那么会将滴入的溶液稀释,从而使酸溶液的pH增大,使碱溶液的pH减小。
【解答】(1)根据表格可知,紫甘蓝汁遇酸显红色,与中性溶液不变色,遇碱变蓝色,因此它可以作为酸碱指示剂;因为氢氧化钠为碱,那么紫甘蓝汁遇到它的溶液变蓝色;
(2)用pH试纸测定图1中部分溶液的酸碱度:白醋pH<7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中可能导致被测溶液的pH数值发生改变的错误操作是C。
一、单选题
1.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是(??? )
A.?柠檬汁(pH:2~3) ????????????????????????B.?苹果汁(pH:3~4)
C.?西瓜汁(pH:5~6) ??????????????????D.?玉米汁(pH:7~8)
2.下图是身边一些物质pH,则下列有关说法正确的是(??? )
A.?pH试纸浸入溶液中测其酸碱度???????????????????????????B.?厕所清洁剂不会腐蚀大理石地面
C.?蚊虫叮咬后涂牙膏可减轻痛痒?????????????????????????????D.?橘子的酸性强于柠檬
3.一些物质的近似 pH 如图,下列有关说法正确的是(?? )
A.?苹果汁的酸性比纯鲜牛奶的酸性弱??????????????????????B.?肥皂水的碱性比炉具清洁剂的碱性强
C.?厕所清洁剂与炉具清洁剂能混用?????????????????????????D.?人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒
4.三氧化二碳(化学式C2O3)通常情况下是一种无色无味的气体,可溶于水,与水反应生成草酸,且常温下不稳定,其他的化学性质与一氧化碳相似。下列有关三氧化二碳说法正确的是( ???)
A.?三氧化二碳是由2个碳原子和3个氧原子构成的????B.?用干燥的蓝色石蕊试纸检测 C2O3时试纸变红
C.?在空气中充分燃烧的产物为二氧化碳??????????????????D.?不能与氢氧化钠溶液反应生成盐
5.某品牌矿泉水做了如图所示的广告:两个玻璃杯中分别盛有两种水样,水样中分别浸入pH试纸后,左侧一杯中的试纸呈现淡橘黄色(弱酸性),右侧一杯中的试纸呈现淡绿色(弱碱性),广告宣称弱碱性的水对人体健康有利。下列有关叙述中,正确的是(?? )
A.?左侧杯中的矿泉水能使无色酚酞变红色 ??
B.?左侧杯中的矿泉水一定含有氢氧根离子
C.?将右侧杯中的 pH 试纸与标准比色卡对照,能读出水样的pH值为6.72
D.?用 pH 试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上
6.在一定质量的NaOH溶液中逐滴加入蒸馏水,如图中能正确表示溶液pH变化的是(横坐标表示加入稀盐酸的质量,纵坐标表示溶液的pH)(?? )
A.???????B.???????C.???????D.?
7.二氧化硫的水溶液叫亚硫酸,硫化氢的水溶液叫氢硫酸。又知相同条件下氢硫酸的酸性小于亚硫酸,现在室温下向饱和亚硫酸溶液中通入过量氢硫酸,在溶液中发生化学变化,且有硫和水生成。则溶液的pH随通入氢硫酸体积变化的曲线示意图正确的是(?? )
A.???????B.???????C.???????D.?
二、填空题
8.测定人体体液的pH 可以帮助我们了解身体状况,如图是小茗同学体检报告单截图,看图后回答问题:
项目
检测值
正常pH范围
血浆
7.4
7.35-7.45
胃液
0.8
0.9-1.5
胆汁
7.21
7.1-7.3
胰液
7.8
7.5-8.0
(1)小茗同学的指标中有一项出现异常,医生除了给他开了药物之外,还提醒他注意饮食,下列食物(近似PH如下) 中适合该同学得有?? ??????。
A.番茄(4.0--4.4)B.苹果(2.9--3.3)C.牛奶(6.3-6.6)D.豆浆(7.4--7.9)
(2)小茗同学想到在实验室中可用pH试纸测量溶液酸碱度,于是他从家里找来苹果,并用湿润的pH试纸进行了测量,那么测得的pH比实际结果? ?????。
A.偏大B.偏小C.不变D.无法判断
9.在通常状态下,氨气(NH3)是一种无色、具有刺激性气味的气体,密度比空气小,极易溶于水,溶于水后可得到氨水.
(1)如图甲所示,A.B试管中各有一团用无色酚酞试液湿润过的棉花,实验前止水夹处于关闭状态.实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性.再打开止水夹,几秒钟后观察到的现象是________,说明氨气分子在运动.
(2)氨气在纯氧中燃烧的化学方程式是4NH3+3O2=点燃=2N2+6H2O,把图乙中第三个方框补充完整.
10.贾林同学用滤纸折成一只蝴蝶,并在上面喷洒了试剂A,挂在铁架台上。另取一只盛有溶液B的烧杯,放在纸蝴蝶的下方(如图)。过了一会儿,纸蝴蝶的颜色变成红色。
(1)请你从下面提供的试剂中找出A、B可能的组合(填序号)________。
①石蕊试液? ②酚酞试液? ③浓盐酸?
④浓硫酸? ⑤氢氧化钠溶液? ⑥浓氨水
(2)只用下列试剂中的一种进行试验,就能确定B的成分,则该试剂可能是(填序号)________。
①Na2CO3溶液? ②BaCl2溶液? ③铁钉? ④NaCl溶液
11.通过一个多星期的化学学习,我们认识了许多“奇妙的酸”和“神奇的碱”,请回答下列问题:
(1)如图表示的是一些物质在常温下的近似pH,回答下列问题:
?
①酸雨的酸性比正常雨水的酸性________(填“强”或“弱”)
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏________(“大”或“小”)
(2)焊接工业上常用稀盐酸清洗铁锈,写出用稀盐酸除铁锈的化学方程式为________,铁制品除锈时________(填“能”或“不能”)长时间浸在酸溶液中。???
(3)胃酸的主要成分是盐酸,胃舒平(主要成分Al(OH)3)常用于治疗胃酸过多症,写出治疗胃酸过多症时的化学反应方程式________。
12.向NaOH溶液中滴入HCl溶液至恰好完全反应。
(1)如图表示该反应前后溶液中存在的主要离子,在横线上写出每种图形表示的离子(填离子符号)。
(2)发生反应的化学方程式是 ________?。
(3)下列物质中只有一种能与KOH溶液发生上述类似反应,应是________(填序号)
①HNO3②CusO4③CaCl2
三、实验探究题
13.某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定壤酸碱度。以下三种取样位置设定合理的是________。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在________上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有________。
作物
大蒜
丝瓜
茄子
沙枣
最适pH范围
5.6~6.0
6.0~6.5
6.8~7.3
8.0~8.7
14.氯气(Cl2)是一种黄绿色气体,它可溶于水,得到黄绿色的氯水。它易与氢氧化钠反应,不与硫酸反应。
(1)小明对氯气溶于水的过程中所发生的变化提出了两种假设:
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显________?性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
(2)小明对褪色现象产生了兴趣,查阅资料后了解到氯水有漂白性。氯水中有氯气分子,还有氯气与水反应得到的盐酸和次氯酸(HClO)。他对氯水的漂白性提出了3种假设:
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据________?。
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的________处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。
(3)次氯酸除有漂白性外还有不稳定性。小明设计了一套装置,收集到一试管次氯酸见光分解后生成的气体,将带火星的木条伸入试管,发现木条复燃,说明分解产物中含有________。
15.某兴趣小组为探究金属镁的化学性质,做了镁与稀盐酸反应的实验。小柯同学做镁粉与稀盐酸反应的实验时发现试管温度明显升高,并在试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:
【提出假设】
假设一:可能含有氯化镁
假设二:可能含有镁粉
假设三:可能含有氢氧化镁
【查阅资料】①镁可与热水反应生成氢氧化镁;②氢氧化镁在水中溶解度很小,水溶液呈弱碱性。
【设计并进行实验】各取少量灰白色沉淀加入2支试管中,进行如下实验:
编号
实验操作
实验现象
实验1
加入一定温度的蒸馏水、搅拌
沉淀未见减少
实验2
加入适量稀盐酸
沉淀全部溶解,没有气泡产生
【得出结论】根据实验2现象,说明假设 ?????不成立。
二
【实验思考】
(1)如果假设三成立,请写出实验2中发生的反应方程式:________。
(2)实验后同学们请教老师得知,灰白色沉淀的主要成分是碱式氯化镁(Mg(OH)2·MgCl2),碱式氯化镁受热易分解产生氯化氢气体。为了验证试管中的灰白色沉淀中含有碱式氯化镁,小米把灰白色沉淀放进试管进行加热,并在试管口放一张湿润的石蕊试纸。如果灰白色沉淀中含有碱式氯化镁,则小米将看到的现象是________。
(3)镁与稀盐酸反应究竟是一个怎样的过程呢?
小组同学进行了如下实验:在小烧杯中加入一定量的稀盐酸和去除氧化膜的镁带,测量溶液pH的变化,并观察实验现象。结果如下表:
时间/min
0
2
4
8
12
16
20
24
溶液pH
2.0
5.3
7.0
8.6
9.3
9.8
10.0
10.0
实验现象
镁带溶解较快,产生大量气泡,试管温度升高,无沉淀生成
镁带缓慢溶解,产生气泡速率减慢,溶液变浑浊,烧杯底部有灰白色沉淀
根据表中信息,请你说说溶液pH值出现这样变化的原因:________。
16.老师在演示NaOH溶液与稀盐酸的反应中出现一个奇怪的现象:在NaOH溶液中加入几滴酚酞,溶液变红,但又立即消失呈无色。同学们分析原因:有同学认为是氢氧化钠变质,有同学认为是其它原因。老师建议在这个溶液中边滴加稀盐酸,边搅拌,观察到NaOH溶液颜色发生了变化,如图所示:
(1)小柯认为是氢氧化钠变质引起褪色是不成立的,小柯的理由是________。
(2)小柯同学通过网络搜索“酚酞”得知,酚酞(以H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为:H2In(无色) In2-(红色),而后来红色消失的原因是在pH>12的条件下,In2-离子会进一步转化为InOH3-离子(无色),使溶液褪为无色。
根据上述信息写出H2In遇NaOH溶液变红的化学反应方程式________。
据此小柯知道老师让他滴加稀盐酸的用意了,实验中溶液变红又褪色是因为________。
(3)小柯同学把无色酚酞滴入澄清石灰水中,溶液变红色且不褪色,请分析原因________。
17.叶绿素是对人体无毒无害的天然色素,可以作为食用色素添加到食品中以改善食品色泽,如我们所吃的青绿色的“清明粿”就是由叶绿素染色的。那么叶绿素能将所有的食品都染成绿色吗?针对这个问题,某同学提取了叶绿素并对其性质进行了研究,实验步骤如下:
步骤一:将某植物绿色叶片磨碎、捣烂,加入R试剂以提取叶绿素。
步骤二:将提取液过滤并配成一定浓度的溶液。
步骤三:在室温下进行4组实验,以探究pH值对叶绿素稳定性的影响。实验记录如下:
组号
叶绿素溶液(毫升)
PH 值
处理时间(分)
溶液颜色
1
3
8
10
绿色
2
3
7
10
绿色
3
3
6
10
黄绿色
4
3
5
10
黄褐色
备注:叶绿素被破坏后变成黄褐色。
(1)R 试剂可选择下列哪一种液体? ?????????。
A.清水B.氯化钠溶液C.稀硫酸D.酒精
(2)天然叶绿素不适用于把________(填“酸”、“碱”或“中”)性食品染成绿色。
(3)大家都知道因为有叶绿素,所以植物是绿色的。然而,市场上深受大家喜爱的多肉植物却有红色、粉色、黄色的。原来,通过对多肉植物光照的调节、生存环境温差的控制,可以改变植物内部色素比例从而改变多肉植物颜色。多肉植物由于光照温差的不同而产生的这种性状变化________(填“能”或“不能”)遗传。
18.浣纱初中同学开展了如图所示“溶液酸碱性的检验”的实验活动:
把自制的紫甘蓝(紫色包心菜)如图(1)所示分别滴加到试管中,观察到的现象如表所示:
溶液
白醋
盐酸
食盐水
草木灰水
石灰水
加入紫甘蓝汁后的颜
红色
红色
紫色
蓝
蓝
(1)观察表中的紫甘蓝汁颜色变化情况,紫甘蓝汁________(填“能”或“不能”)作为酸碱指示剂,遇到氢氧化钠溶液显示的颜色是________;
(2)用pH试纸测定图1中部分溶液的酸碱度:白醋pH________7(填“>”、“<”或“=”);
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中可能导致被测溶液的pH数值发生改变的错误操作是________。
答案解析部分
一、单选题
1. D
【分析】酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7,据此判断。
【解答】A.柠檬汁(pH:2~3) <7,呈酸性,故A错误;
B.苹果汁(pH:3~4)<7,呈酸性,故B错误;
C.西瓜汁(pH:5~6)<7,呈酸性,故C错误;
D.玉米汁(pH:7~8) >7,呈碱性,故D正确。
故选D。
2. C
【分析】A、根据pH试纸的使用方法分析;
B、根据酸性物质与大理石成分碳酸钙可反应分析;
C、根据中和反应的应用分析;
D、根据溶液pH小于7呈酸性,越小酸性越强分析。
【解答】A、 pH试纸不能浸入溶液中测其酸碱度,要用玻璃棒滴加,不符合题意;
B、 厕所清洁剂呈酸性,会腐蚀大理石地面?,不符合题意;
C、蚊虫分泌的液体呈酸性,牙膏呈碱性,可缓解痛痒,符合题意;
D、 橘子的pH大于柠檬,酸性比柠檬弱,不符合题意;
故答案为:C。?
3. D
【分析】(1)酸性溶液的pH<7,碱性溶液的pH>7;
(2)当溶液为酸性时,溶液的pH越小,酸性越强;当溶液为碱性时,溶液的pH越小,碱性越弱;
(3)酸与碱发生中和反应生成盐和水。
【解答】A.苹果汁的pH=3左右,纯鲜牛奶的pH在6和7之间;因为苹果汁的pH小,所以它的酸性强,故A错误;?
B.肥皂水的pH=10左右,而炉具清洁剂的pH在12~13之间;因为肥皂水的pH小,所以它的碱性弱,故B错误;
C.厕所清洁剂pH值在1~2之间,为酸性溶液,而炉具清洁剂pH值在12~13之间为碱性溶液,二者不能混用,故C错误;?
D.人被某些蚊虫叮咬后,由于它们的分泌液成酸性,所以感觉疼痛,可涂抹呈碱性的肥皂水,二者发生中和反应减轻痛苦,故D正确。
故选D。
4. C
【分析】(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2) ?C2O3时本身没有酸性,只有溶于水形成草酸,才具有酸性;
(3)根据一氧化碳燃烧的产物分析;
(4)分析草酸是否能和氢氧化钠反应即可。
【解答】A.根据化学式C2O3可知,三氧化二碳分子是由2个碳原子和3个氧原子构成的,故A错误;
B. 用干燥的蓝色石蕊试纸检测 C2O3时,由于没有草酸生产,试纸不会变红,故B错误;
C.一氧化碳在空气中充分燃烧的产物为二氧化碳,而它的性质与一氧化碳相似,故C正确;
D.三氧化二碳溶于水形成草酸,而草酸与氢氧化钠反应生成草酸钠和水,故D错误。
故选C。?
5. D
【分析】(1)酚酞试液遇酸不变色,遇碱变红色;
(2)碱性溶液中一定含有氢氧根离子,酸性溶液中肯定含有氢离子;
(3)酸性溶液的pH<7,碱性溶液的pH>7;
(4)根据测定溶液pH的方法判断。
【解答】A.左侧杯中的矿泉水呈酸性,因此酚酞应该无色,故A错误;
B.左侧杯中的矿泉水呈酸性,肯定不含有氢氧根离子,故B错误;
C.右侧杯中的矿泉水呈碱性,pH值肯定大于7,故C错误;
D.用 pH 试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上,故D正确。
故选D。
6. C
【分析】溶液的氢离子的浓度越大,酸性越强,pH值越小;溶液的氢氧根离子的浓度越大,碱性越弱,pH值越大,据此分析即可。
【解答】在一定质量的NaOH溶液中逐滴加入蒸馏水,溶液中氢氧根离子的浓度减小,那么它的pH值减小;但是无论加入多少水,溶液的pH都不可能小于7.
故选C。
7. D
【分析】根据酸性溶液pH小于7,且酸性越强pH越小及反应过程中物质的变化情况分析。
【解答】酸性溶液pH小于7,且酸性越强pH越小, 室温下向饱和亚硫酸溶液中通入过量氢硫酸,在溶液中发生化学变化,有硫和水生成,随着反应的发生,溶液的酸性变弱,pH会不断变大,图像会是一条上升的曲线,恰好反应时pH等于7,继续通入硫化氢气体会再次显酸性,但由于氢硫酸的酸性弱于亚硫酸,故溶液最后的pH会比开始时大;
故答案为:D。
二、填空题
8. (1)D
(2)A
【分析】(1)根据表格确定该同学的胃酸是否正常,然后根据酸碱中和的原理选择适合的食物;
(2)酸性溶液被稀释后,浓度碱性,酸性减弱,pH增大。
【解答】(1)根据表格可知,该同学的胃液检测值不在正常范围内,即酸性较大,因此应该选择碱性食物进行调整,因为豆浆的Ph>7呈碱性,所以选D;
(2)苹果呈酸性,如果使用湿润的pH试纸,会将被检测的苹果汁稀释,浓度变小,pH增大,故选A。
9. (1)试管B中白色棉花变红
(2)
【分析】(1)浓氨水挥发出氨气,氨气分子在不停的做无规则运动,会向上运动与B中的棉花接触。由于棉花用无色酚酞试液浸润过,所以会变成红色;
(2)根据化学方程式确定生成物中水分子和氮气分子的个数,将不足的补全即可。
【解答】(1)实验时,将少量浓氨水滴在A试管的棉花上,观察到白色棉花变红,说明氨水呈碱性.再打开止水夹,几秒钟后观察到的现象是试管B中白色棉花变红,说明氨气分子在运动;
(1)根据化学方程式; 4NH3+3O22N2+6H2O可知,生成物中应该有2个氮气分子和6个水分子;现在第三个方框中,已经有1个氮气分子和5个水分子,因此只要补充1个氮气分子和1个水分子即可,如下图:
10. (1)①③或②⑥
(2)①③
【分析】(1)石蕊遇酸变红色,酚酞遇碱变红色,据此分析即可;
(2)加入某种试剂后,两种溶液必须出现明显的不同现象,才能确定B的成分。
【解答】(1)如果试剂A为石蕊试液,那么它下面的烧杯中必须会发出一种气体,与水结合形成酸;因为浓盐酸具有挥发性,能够挥发出HCl气体,所以组合A、B可以是:①③;
如果试剂A为酚酞试液,那么它下面的烧杯中必须挥发一种气体,与水结合后成碱性;因为浓氨水能够挥发出氨气,而氨气溶于水呈碱性,所以组合A、B可以是:②⑥;
(2)B要么是浓盐酸,要么是浓氨水。
①碳酸钠与浓盐酸反应生成二氧化碳气体,而浓氨水与碳酸钠不反应,故A符合题意;
②氯化钡溶于与浓盐酸和浓氨水都不反应,故B不合题意;
③铁钉与浓盐酸反应生成氢气,而铁钉与浓氨水不反应,故C符合题意;
④氯化钠溶液与浓盐酸、浓氨水都不反应,故D不合题意。
故选①③。
11. (1)强;大
(2)6HCl+Fe2O3=2FeCl3+3H2O;不能
(3)3HCl+Al(OH)3=AlCl3+3H2O
【分析】(1)①比较酸雨和正常雨水的pH大小,pH值越小,酸性越强;
②酸性溶液的浓度越小,酸性越小,溶液的pH越大;
(2)铁锈与稀盐酸反应生成氯化铁和水,据此写出反应的化学方程式;铁单质与稀盐酸反应生成氯化亚铁和氢气;
(3)稀盐酸与氢氧化铝反应生成氯化铝和水,据此写出反应的化学方程式。
【解答】(1)①酸雨的pH为4~5,正常雨水的pH为5~6,因此酸雨的酸性比正常雨水的酸性强;
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使苹果汁的浓度减小;因为苹果汁呈酸性,所以会使pH值偏大;
(2)焊接工业上常用稀盐酸清洗铁锈,写出用稀盐酸除铁锈的化学方程式为: 6HCl+Fe2O3=2FeCl3+3H2O ;铁制品除锈时不能长时间浸在酸溶液中,因为它会与酸反应生成氢气;
(3) 治疗胃酸过多症时的化学反应方程式 : 3HCl+Al(OH)3=AlCl3+3H2O 。
12. (1)OH-;Na+
(2)HCl+NaOH=NaCl+H2O
(3)①
【分析】酸碱中和反应 实质是氢离子和氢氧根离子结合生成水分子。
【解答】HCl+NaOH=NaCl+H2O,中和反应的实质是氢离子和氢氧根离子结合生成水分子,故最后还存在的离子是钠离子和氯离子。氢氧化钾含有氢氧根,能与之反应的应该含有氢离子。
故答案为:(1)
OH-;Na+;(2) HCl+NaOH=NaCl+H2O;(3) ①
三、实验探究题
13. (1)B
(2)pH试纸;茄子
【分析】(1)在进行取样时,尽可能的在所有范围内进行,避免取样位置过于集中,影响对整个土壤酸碱度的判断;
(2)根据测定溶液pH值的方法进行解答;土壤的pH值在哪种作物的最适pH值范围内,就适合种这种作物。
【解答】(1)根据图片可知,A和C中的取样位置过于集中,很大范围没有取到,而B中六个取样位置平均分布,覆盖面更大,因此合理的是B;
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在pH试纸上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7。
因为7在6.8~7.3之间,所以这块空地适合种植的作物是茄子。
14. (1)酸
(2)盐酸能使紫色石蕊试液变红,且不褪色;
(3)氧气
【分析】(1)根据石蕊试液遇酸性溶液变红分析;
(2)根据盐酸能使石蕊试液变红及除杂时气体要长导管进短导管出分析;
(3)根据氧气的验证方法分析。
【解答】(1)石蕊试液遇酸性溶液变红, 向氯水中加入紫色石蕊试液,发现溶液变红,说明氯水显酸性;
(2) 盐酸能使紫色石蕊试液变红,且不褪色,说明盐酸不具有漂白性,即A假设不成立;气体干燥时为使药品充分接触,要长导管进气,短导管排出,由此画出装置图;
(3)能使木条复燃的气体为氧气;
故答案为:(1)酸;(2)盐酸能使紫色石蕊试液变红,且不褪色; ;(3)氧气。
15. (1)2HCl+Mg(OH)2=MgCl2+2H2O
(2)石蕊试纸变红(石蕊试纸呈现红色)
(3)镁先与稀盐酸反应,溶液pH值升高;当盐酸消耗完,pH值显中性;接着镁就与热水应生成氢氧化镁沉淀,同时溶液pH值升高呈碱性
【分析】【得出结论】如果白色沉淀中含有金属镁,那么它会与稀盐酸反应生成氯化镁和氢气,肯定有气泡产生,据此分析判断;
【实验思考】(1)氢氧化镁和稀盐酸反应,生成氯化镁和水,据此写出假设三中的化学方程式;
(2)碱式氯化镁受热分解产生氯化氢气体,而氯化氢溶于水形成稀盐酸,遇到湿润的石蕊试纸会使其变成红色;
(3)当试管内存在稀盐酸且温度较低时,镁与稀盐酸反应,据此分析溶液pH的改变和温度的改变。当稀盐酸完全反应后,试管内的水温度较高,镁则与水再次发生反应,据此分析沉淀的原因和溶液pH值的改变。
【解答】【得出结论】根据实验2现象,说明白色沉淀中没有金属镁的存在,即假设二不成立。
【实验思考】(1)如果假设三成立,请写出实验2中发生的反应方程式:2HCl+Mg(OH)2=MgCl2+2H2O;
(2)如果灰白色沉淀中含有碱式氯化镁,则小米将看到的现象是:石蕊试纸变红(石蕊试纸呈现红色)。
(3)溶液pH值出现变化的原因是:镁先与稀盐酸反应,溶液pH值升高;当盐酸消耗完,pH值显中性;接着镁就与热水应生成氢氧化镁沉淀,同时溶液pH值升高呈碱性。
16. (1)变质后的碳酸钠溶液也是呈碱性
(2)2NaOH+H2ln=Na2ln+2H2O;酚酞先与氢氧化钠反应产生In2-离(红色),又由于碱性太强,In2-离子进一步转化为InOH3-离子(无色),于是溶液褪为无色。
(3)酚酞一直显红色,因为石灰水的碱性较弱pH<12
【分析】(1)碳酸钠变质的过程,其实就是它与二氧化碳反应生成碳酸钠的过程,碳酸钠虽然是盐,但是它的水溶液呈碱性;
(2)分析氢氧化钠和酚酞变红时的反应产物,然后写出反应的化学方程式;酚酞之所以变色后又无色,是因为溶液的碱性太强,加入稀盐酸,可以使溶液的pH碱性,从而是酚酞再次变色,这个过程足以证明酚酞变色是先后经历了两个过程;
(3)根据右图可知,酚酞要变红色,那么溶液的碱性不能太强,pH<12才行,据此分析原因。
【解答】(1)小柯认为是氢氧化钠变质引起褪色是不成立的,小柯的理由是:变质后的碳酸钠溶液也是呈碱性。
(2)根据 H2In(无色)??In2-(红色) 可知, H2In遇NaOH 反应应该生成 Na2ln和H2O,那么反应的化学方程式为: 2NaOH+H2ln=Na2ln+2H2O;
实验中溶液变红又褪色是因为 : 酚酞先与氢氧化钠反应产生In2-离(红色),又由于碱性太强,In2-离子进一步转化为InOH3-离子(无色),于是溶液褪为无色。
(3)小柯同学把无色酚酞滴入澄清石灰水中,溶液变红色且不褪色,原因为:酚酞一直显红色,因为石灰水的碱性较弱,pH<12。
?
17. (1)D
(2)酸
(3)不能
【分析】(1)叶绿素能够溶解在酒精中。
?(2)对照图表格中的数据观察不同PH值对叶绿素的影响解题即可。
?(3)植物的基因决定性状,如果基因不改变,那么性状也不会改变。
【解答】(1)由于酒精能溶解叶绿素,所以实验时选择用酒精,因此 R 试剂可选择酒精。
?(2)由表格信息可知,酸性条件下可使叶绿素变成黄褐色,所以若用作食品色素,天然叶绿素不适用于pH小于6.0的食品,否则叶绿素会由于酸性而被破坏。?因此天然叶绿素不适用于酸性食品染成绿色。
?(3)属于不可以遗传的变异,这种多肉植物的形成条件是,通过光照、温差控制来改变植物内部色素的比例,植物本身的基因并沒有改变,因此是不可遗传变异,?故多肉植物由于光照温差的不同而产生的这种性状变化不能遗传。
故答案为:(1)D(2)酸(3)?不能
18. (1)能;蓝
(2)<
(3)C
【分析】(1)如果紫甘蓝汁遇到酸和碱时能够呈现不同的颜色,那么它能做酸碱指示剂;根据表格确定它遇到碱时呈现的颜色;
(2)酸溶液的pH<7,碱溶液的pH>7;
(3)如果点滴板是潮湿的,那么会将滴入的溶液稀释,从而使酸溶液的pH增大,使碱溶液的pH减小。
【解答】(1)根据表格可知,紫甘蓝汁遇酸显红色,与中性溶液不变色,遇碱变蓝色,因此它可以作为酸碱指示剂;因为氢氧化钠为碱,那么紫甘蓝汁遇到它的溶液变蓝色;
(2)用pH试纸测定图1中部分溶液的酸碱度:白醋pH<7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中可能导致被测溶液的pH数值发生改变的错误操作是C。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
