人教版高中化学必修一2.3-氧化还原反应(共21张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3-氧化还原反应(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-20 21:48:28 | ||
图片预览





文档简介
(共21张PPT)
第3节
氧化还原反应
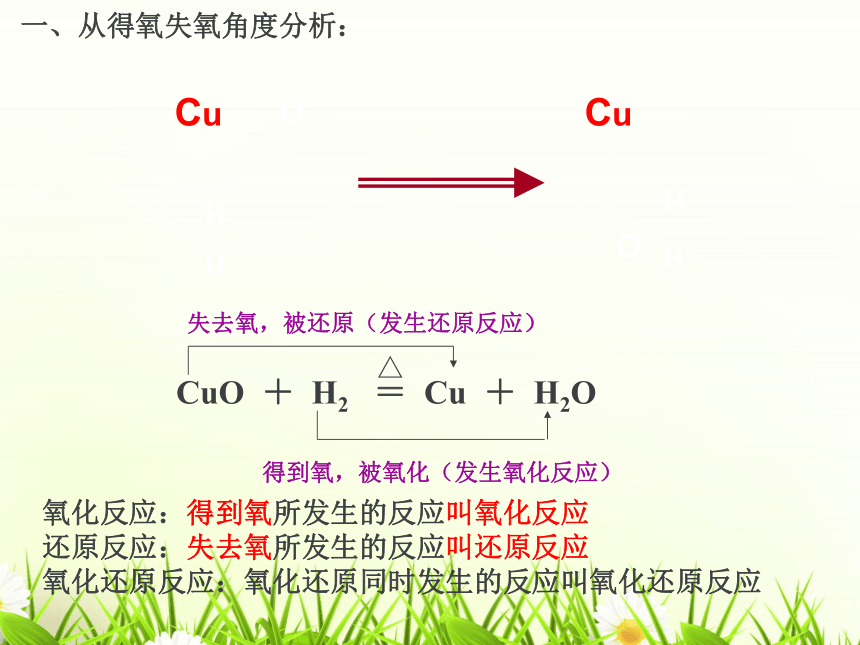
得到氧,被氧化(发生氧化反应)
△
CuO
+
H2
=
Cu
+
H2O
失去氧,被还原(发生还原反应)
Cu
O
H
H
Cu
H
H
O
一、从得氧失氧角度分析:
氧化反应:得到氧所发生的反应叫氧化反应
还原反应:失去氧所发生的反应叫还原反应
氧化还原反应:氧化还原同时发生的反应叫氧化还原反应
判断下列反应是否氧化还原反应
1.2CuO+C
2Cu+CO2
2.Fe2O3+3CO
2Fe+3CO2
高温
高温
3、Fe
+CuSO4
=
FeSO4
+Cu
[问题]以上反应除了包含有得氧失氧的变化之外,
还包含有什么变化?
CuO
+
H2
=
Cu
+
H2O
+2
0
化合价降低
,被氧化(氧化反应)
+3
0
化合价降低
+2
+4
化合价升高
0
+1
化合价升高
,被还原(还原反应)
,被氧化(氧化反应)
,被还原(还原反应)
Fe2O3
+
3CO
=
2Fe
+
3CO2
高温
Fe
+CuSO4
=
FeSO4
+Cu
化合价降低
化合价升高
共同特征:有化合价的升降(变化)
+2
0
0
+1
化合价降低,被还原(还原反应)
化合价升高,被氧化(氧化反应)
CuO
+
H2
=
Cu
+
H2O
[定义]有元素化合价变化的化学反应称为氧化还原反应。
二、从化合价升降角度分析:
结论:
被氧化
被还原
化合价升高
—
—氧化反应
化合价降低
—
—还原反应
[问题]下列反应是否属于氧化还原反应?
2Na+Cl2
=
2NaCl
2H2+Cl2
=
2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
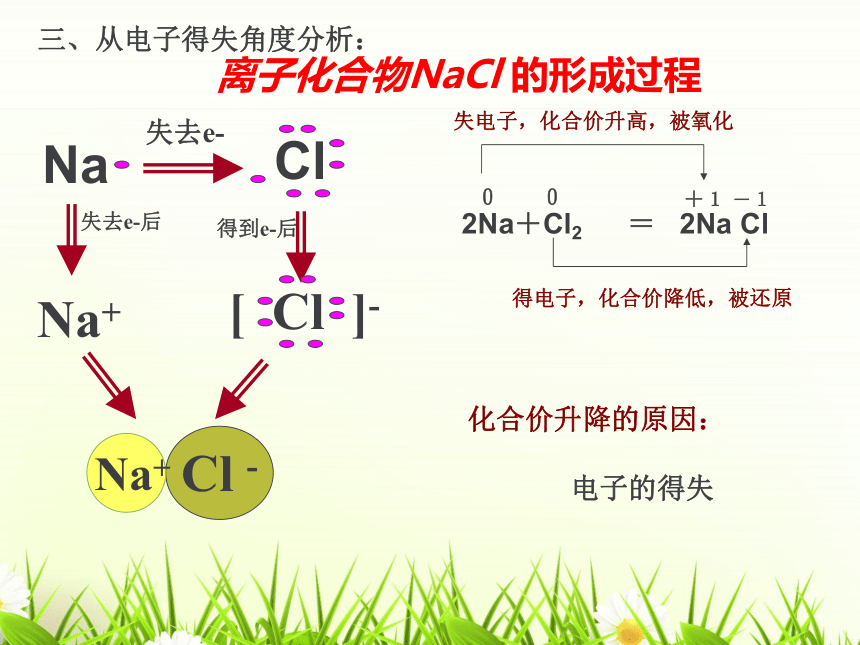
[问题]化合价的升降是什么原因引起的?
2Na+Cl2
=
2Na
Cl
0
0
+1
-1
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
离子化合物NaCl
的形成过程
化合价升降的原因:
电子的得失
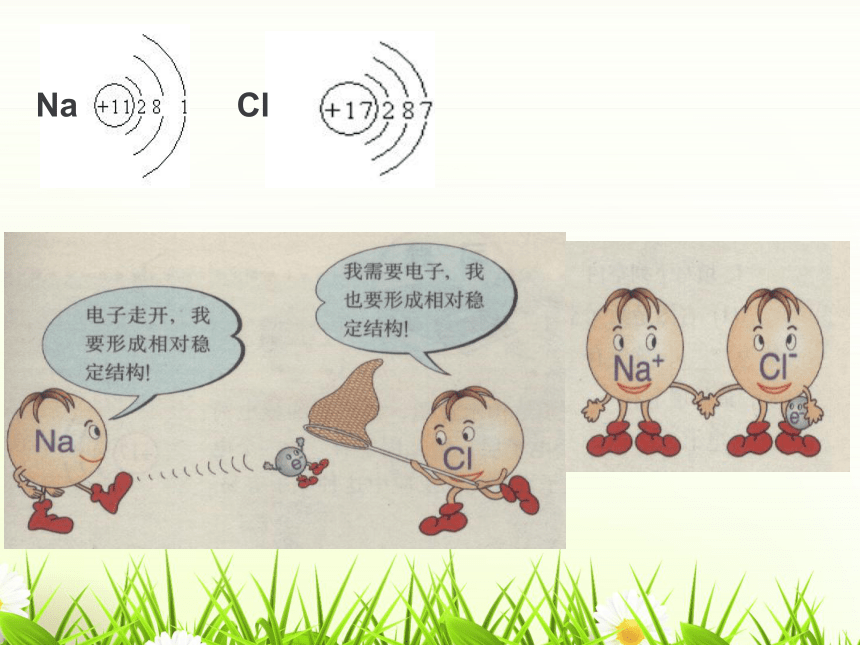
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl
-
Na+
三、从电子得失角度分析:
Na
Cl
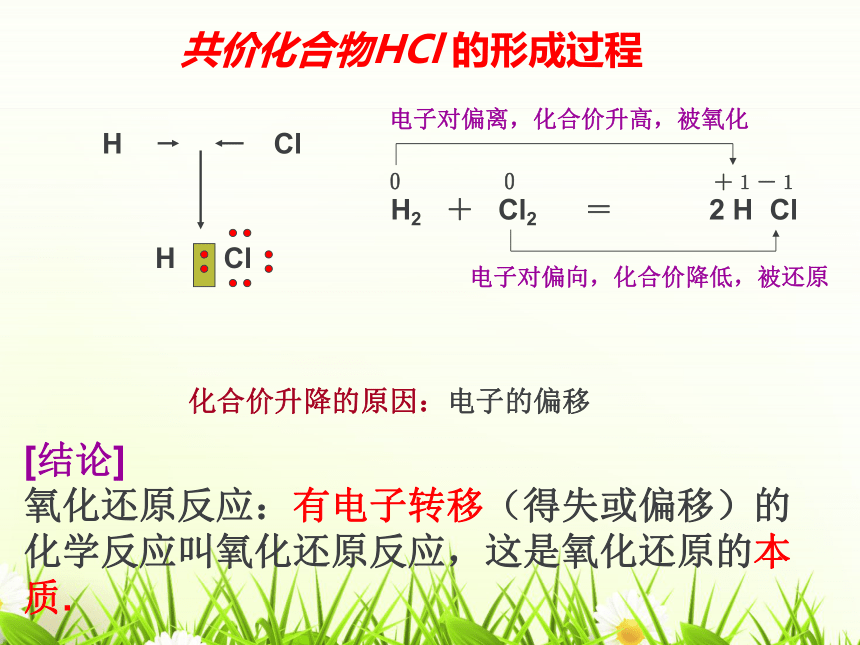
H2
+
Cl2
=
2
H
Cl
0
0
+1-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
[结论]
氧化还原反应:有电子转移(得失或偏移)的化学反应叫氧化还原反应,这是氧化还原的本质.
共价化合物HCl
的形成过程
化合价升降的原因:电子的偏移
H
Cl
H
Cl
氧化还原反应
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
三、双线桥法表示氧化还原反应中电子转移的情况:
例1:CuO
+H2
=
Cu
+
H2O
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
还原剂:
失去电子,作还原剂,化合价升高,
还原剂被氧化,发生氧化反应
氧化剂:得到电子,作氧化剂,化合价降低,
氧化剂被还原,发生还原反应
用双线桥表示电子转移情况,并指出氧化剂和还原剂
1、Fe
+
CuSO4
=
FeSO4
+
Cu
2、
2HClO
=
2HCl
+
O2
↑
3、2H2S
+
SO2
=
3S
+
2H2O
4、3Cu
+8HNO3(稀)=
3Cu(NO3)2
+
2NO↑+
4H2O
5、KClO3
+
6HCl
=
KCl
+
3Cl2
+
3H2O
⑵用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素
(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
四、氧化剂和还原剂
还原产物
氧化产物
氧化剂:
得到电子(元素化合价降低)的物质,
被还原。
还原剂:
失去电子(元素化合价升高)的物质,被氧化。
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
1.根据化合价判断还原性和氧化性:
最高价有氧化性,最低价有还原性,中间价2者都有
练习:下列物质中,只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是(
)
A.F2、K、HCl
B.Cl2、Al、H2
C.NO2、Na、Br2
D.O2、SO2、H2O
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
2.根据化合价变化判断加入氧化剂还是还原剂:
例题:(课后作业3)
下列变化需要加入还原剂才能实现的是(
)
A.
Fe2+→
Fe3+
B.SO2
→
S
C.HCl
→
Cl2
D.NH3
→
NH4+
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化性、还原性强弱的比较:
已知①2FeCl2+Cl2=
2FeCl3
②2FeCl3+2KI=2FeCl2+2KCl+I2
判断氧化性的强弱:
判断还原性的强弱:
⑤.课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。
[结论]
置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
√
×
√
×
√
√
×
×
关系如下图:
非氧化还原反应
Ⅱ.下列反应中属于氧化还原反应的是(
)
A
CaCO3
+
2HCl=
CaCl2
+
CO2↑
+
H2O
B.
Na2O
+
H2O
=
2NaOH
C.
2KMnO4
=
K2MnO4
+
MnO2
+
O2↑
D.
MnO2
+
4HCl
=
MnCl2
+
2H2O
+
Cl2↑
E.
3Fe
+
2O2
=
Fe3O4
CuSO4·5H2O
=
CuSO4
+
5H2O
CDE
练习2:下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.氧化还原反应中一定有电子的得失
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
E.元素由化合态变为游离态,该元素一定被还原
F.
金属阳离子被还原后,一定得到该元素的单质
G.金属只有还原性,非金属只有氧化性
H.有单质参加的化学反应不一定都是氧化还原反应
I.在氧化还原反应中,一种元素被氧化,则一定有另一种元素被还原。
J.反应中不一定所有元素的化合价都变化。
2K2Cr2O7+3C2H6O+8H2SO4=
2K2SO4+2Cr2(SO4)3+3C2H4O2+11H2O
(1)判断该反应是不是氧化还原反应_____
(3)若该反应为氧化还原反应,则__
___
发生氧化反应,
________发生还原反应
是
K2Cr2O7
C2H6O
第3节
氧化还原反应
得到氧,被氧化(发生氧化反应)
△
CuO
+
H2
=
Cu
+
H2O
失去氧,被还原(发生还原反应)
Cu
O
H
H
Cu
H
H
O
一、从得氧失氧角度分析:
氧化反应:得到氧所发生的反应叫氧化反应
还原反应:失去氧所发生的反应叫还原反应
氧化还原反应:氧化还原同时发生的反应叫氧化还原反应
判断下列反应是否氧化还原反应
1.2CuO+C
2Cu+CO2
2.Fe2O3+3CO
2Fe+3CO2
高温
高温
3、Fe
+CuSO4
=
FeSO4
+Cu
[问题]以上反应除了包含有得氧失氧的变化之外,
还包含有什么变化?
CuO
+
H2
=
Cu
+
H2O
+2
0
化合价降低
,被氧化(氧化反应)
+3
0
化合价降低
+2
+4
化合价升高
0
+1
化合价升高
,被还原(还原反应)
,被氧化(氧化反应)
,被还原(还原反应)
Fe2O3
+
3CO
=
2Fe
+
3CO2
高温
Fe
+CuSO4
=
FeSO4
+Cu
化合价降低
化合价升高
共同特征:有化合价的升降(变化)
+2
0
0
+1
化合价降低,被还原(还原反应)
化合价升高,被氧化(氧化反应)
CuO
+
H2
=
Cu
+
H2O
[定义]有元素化合价变化的化学反应称为氧化还原反应。
二、从化合价升降角度分析:
结论:
被氧化
被还原
化合价升高
—
—氧化反应
化合价降低
—
—还原反应
[问题]下列反应是否属于氧化还原反应?
2Na+Cl2
=
2NaCl
2H2+Cl2
=
2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[问题]化合价的升降是什么原因引起的?
2Na+Cl2
=
2Na
Cl
0
0
+1
-1
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
离子化合物NaCl
的形成过程
化合价升降的原因:
电子的得失
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl
-
Na+
三、从电子得失角度分析:
Na
Cl
H2
+
Cl2
=
2
H
Cl
0
0
+1-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
[结论]
氧化还原反应:有电子转移(得失或偏移)的化学反应叫氧化还原反应,这是氧化还原的本质.
共价化合物HCl
的形成过程
化合价升降的原因:电子的偏移
H
Cl
H
Cl
氧化还原反应
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
三、双线桥法表示氧化还原反应中电子转移的情况:
例1:CuO
+H2
=
Cu
+
H2O
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
还原剂:
失去电子,作还原剂,化合价升高,
还原剂被氧化,发生氧化反应
氧化剂:得到电子,作氧化剂,化合价降低,
氧化剂被还原,发生还原反应
用双线桥表示电子转移情况,并指出氧化剂和还原剂
1、Fe
+
CuSO4
=
FeSO4
+
Cu
2、
2HClO
=
2HCl
+
O2
↑
3、2H2S
+
SO2
=
3S
+
2H2O
4、3Cu
+8HNO3(稀)=
3Cu(NO3)2
+
2NO↑+
4H2O
5、KClO3
+
6HCl
=
KCl
+
3Cl2
+
3H2O
⑵用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素
(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
四、氧化剂和还原剂
还原产物
氧化产物
氧化剂:
得到电子(元素化合价降低)的物质,
被还原。
还原剂:
失去电子(元素化合价升高)的物质,被氧化。
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
1.根据化合价判断还原性和氧化性:
最高价有氧化性,最低价有还原性,中间价2者都有
练习:下列物质中,只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是(
)
A.F2、K、HCl
B.Cl2、Al、H2
C.NO2、Na、Br2
D.O2、SO2、H2O
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
2.根据化合价变化判断加入氧化剂还是还原剂:
例题:(课后作业3)
下列变化需要加入还原剂才能实现的是(
)
A.
Fe2+→
Fe3+
B.SO2
→
S
C.HCl
→
Cl2
D.NH3
→
NH4+
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化性、还原性强弱的比较:
已知①2FeCl2+Cl2=
2FeCl3
②2FeCl3+2KI=2FeCl2+2KCl+I2
判断氧化性的强弱:
判断还原性的强弱:
⑤.课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。
[结论]
置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
√
×
√
×
√
√
×
×
关系如下图:
非氧化还原反应
Ⅱ.下列反应中属于氧化还原反应的是(
)
A
CaCO3
+
2HCl=
CaCl2
+
CO2↑
+
H2O
B.
Na2O
+
H2O
=
2NaOH
C.
2KMnO4
=
K2MnO4
+
MnO2
+
O2↑
D.
MnO2
+
4HCl
=
MnCl2
+
2H2O
+
Cl2↑
E.
3Fe
+
2O2
=
Fe3O4
CuSO4·5H2O
=
CuSO4
+
5H2O
CDE
练习2:下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.氧化还原反应中一定有电子的得失
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
E.元素由化合态变为游离态,该元素一定被还原
F.
金属阳离子被还原后,一定得到该元素的单质
G.金属只有还原性,非金属只有氧化性
H.有单质参加的化学反应不一定都是氧化还原反应
I.在氧化还原反应中,一种元素被氧化,则一定有另一种元素被还原。
J.反应中不一定所有元素的化合价都变化。
2K2Cr2O7+3C2H6O+8H2SO4=
2K2SO4+2Cr2(SO4)3+3C2H4O2+11H2O
(1)判断该反应是不是氧化还原反应_____
(3)若该反应为氧化还原反应,则__
___
发生氧化反应,
________发生还原反应
是
K2Cr2O7
C2H6O
