人教版高中化学必修二第一节-化学能与热能(33张PPT)
文档属性
| 名称 | 人教版高中化学必修二第一节-化学能与热能(33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-22 00:00:00 | ||
图片预览








文档简介
(共33张PPT)
第二章
化学反应与能量
第一节
化学能与热能
一飞冲天:“神舟”五号发射实况回放
生活中哪些事实说明了在化学反应中伴随着能量的变化?
【思考与交流】
一、化学键与化学反应中能量变化关系
物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
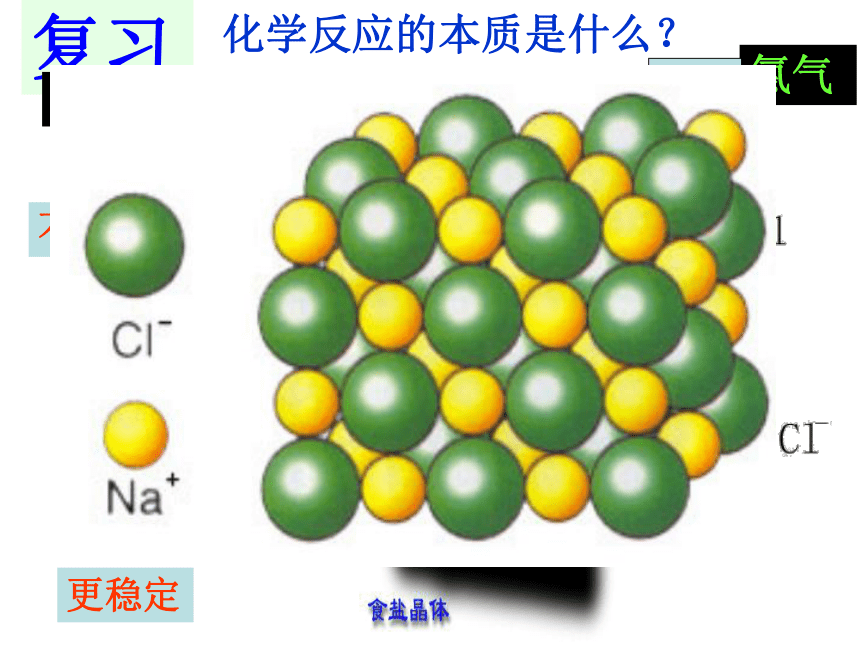
Na+
Cl-
电子转移
不稳定
稳定
更稳定
复习
化学反应的本质是什么?
金属钠
氯气
旧键断裂
新键形成
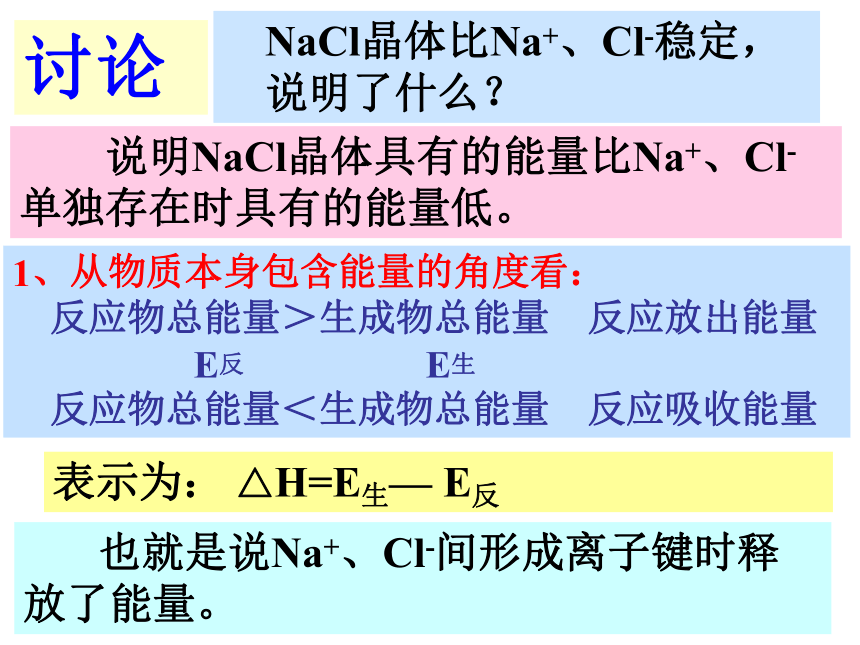
NaCl晶体比Na+、Cl-稳定,说明了什么?
说明NaCl晶体具有的能量比Na+、Cl-单独存在时具有的能量低。
讨论
表示为:
△H=E生—
E反
也就是说Na+、Cl-间形成离子键时释放了能量。
1、从物质本身包含能量的角度看:
反应物总能量>生成物总能量
反应放出能量
E反
E生
反应物总能量<生成物总能量
反应吸收能量
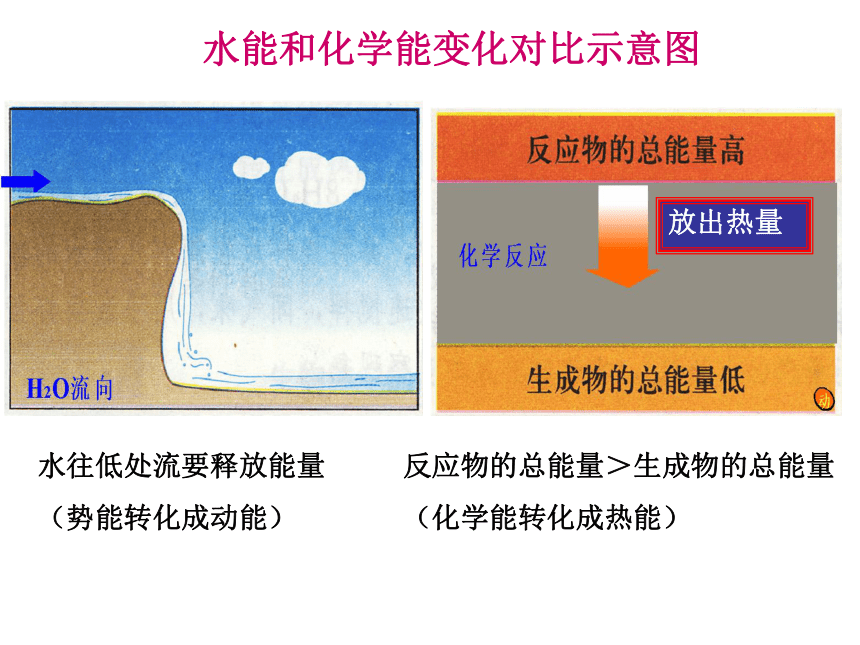
水能和化学能变化对比示意图
水往低处流要释放能量
(势能转化成动能)
反应物的总能量>生成物的总能量
(化学能转化成热能)
放出热量
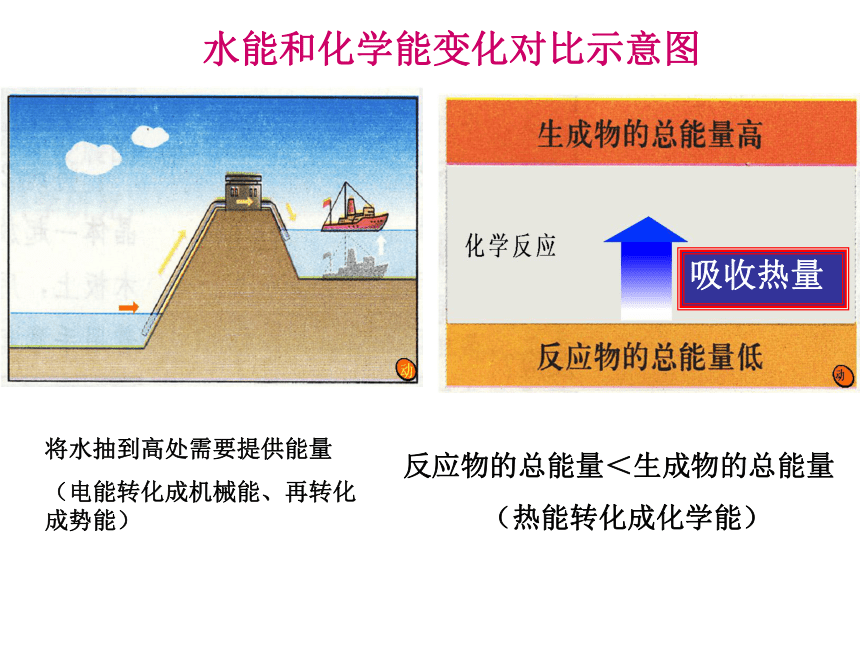
水能和化学能变化对比示意图
将水抽到高处需要提供能量
(电能转化成机械能、再转化成势能)
反应物的总能量<生成物的总能量
(热能转化成化学能)
吸收热量
能量E
反应过程
反应过程
反应物
生成物
能量E
放热反应
吸热反应
反应物
生成物
规
律
若E反>E生,则反应放热,则为放热反应
若E反<E生,则反应吸热,则为吸热反应
☆化学反应过程可以看成是“能量”的储存和释放过程。
化学反应在发生过程中是吸收热量还是放出热量
取决于反应物总能量和和生成物总能量的相对大小。
[小结]
1、化学反应中的能量变化,通常表现为热量的变化
2、化学上把有热量放出的化学反应叫作放热反应
3、化学上把吸收热量的化学反应叫作吸热反应
4、物质能量越高,就越不稳定,能量越低,就越稳定.
H
+
H
→
H–H
;
?H=-436kJ/mol
H-H
→
H
+
H
;
?H=+436kJ/mol
CH4
→
C
+4H
;
?H=+1660kJ/mol
形成(或断裂)1mol化学键时释放(或吸收)的能量叫做键能
C
+4H
→
CH4
;
?H=-1660kJ/mol
键能越大,化学键越牢固,物质越稳定。
2、化学键与化学反应中能量变化关系
●化学键的断裂和形成是化学反应中能量变化的主要原因
当E吸>
E放
反应吸收能量
当E吸<
E放
反应放出能量
2、从键能的角度看:
反应物
生成物
化学反应:
旧化学键断裂
新化学键形成
吸收能量E吸
放出能量E放
任何化学反应都伴随着能量的变化!
表示为:
△H=∑E吸—
∑E放
【归纳小结】
一个化学反应是为放热反应还是吸热反应
取决于:
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小,
即取决于反应物的总能量与生成物的总能量的相对大小。
[练习]
1mol
H-H键的键能是436KJ,
1mol
I
–
I
键的键能是151KJ,
1molH-I
键的健能是299KJ。则H2(g)+I2(g)=2HI(g)的反应是( )
A、吸热反应 B、放热反应
C、分解反应 D、化合反应
BD
二、化学能与热能的相互转化
2、化学反应中的能量变化主要表现为热量的变化——吸热或放热
1、质量守恒定律和能量守恒定律(两条基本定律)
[实验2-1]在一支试管中加入2~3mL 6mol/L的盐酸溶液。再插入用砂纸打磨光的铝条。
现
象
方程式、结论
溶液温度升高
2Al
+
6HCl
=
2AlCl3
+
3H2
↑
放出热量;化学能转化成热能
该反应是放热反应
[实验2—2探究]
:Ba(OH)2·8H2O与NH4Cl的反应
2.整个实验中有哪些创新之处?
1.整个实验的现象、反应化学方程式和结论?
实验2-2
现象:1、玻璃片(小木板)会与小烧杯粘结在一起
2、有少许刺激性气味气体产生
3、有水生成
Ba(OH)2·
8H2O
+
2NH4Cl=BaCl2
+2NH3
+10H2O
结论:该反应是吸热反应
[思考与交流]如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?应该如何设计并进行实验?
设计实验装置和操作时应从两个方面考虑,一是注重“量”的问题。二是尽量减小实验误差。
实验2-3
盐酸温度/℃
NaOH溶液温度/
℃
中和反应后温度/
℃
结论:中和反应是放热反应。
实质:H+
+
OH-
=
H2O
反应后温度升高
室温
室温
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
(每生成1mol水放出57.3KJ的热量)
一是注重“量”的问题
用稀溶液进行中和反应,减小溶解热的干扰。
用强酸和强碱溶液反应,减少电离热效应的干扰;
每次取等量的酸碱进行反应。
做平行实验取平均值
二是尽量减小实验误差
增强保温隔热措施,减少实验中热量的损失
不断搅拌,使热量分散均匀。
温度计的精确度要高。
中和热的测定
装置
-----碎泡沫塑料
---玻璃搅拌器
---温度计
在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如上图所示。该实验也可在保温杯中进行。
例、
如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量
(填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体.
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体.
(3)Mg+2H+=Mg2++H2?
(4)小于
[交流与思考]
试归纳常见的放热反应和吸热反应。
常见的放热反应:
(1)所有燃烧反应
(2)中和反应
(3)大多数化合反应
(例外C+CO2=CO)
(4)活泼金属跟水或酸反应
(5)物质的缓慢氧化
常见的吸热反应:
(1)大多数分解反应(特殊爆炸反应为吸热)
(2)晶体间的反应
(3)以C、H2、CO为还原剂的氧化还原反应。
△
[讨论]放热反应都能自发进行吗?吸热反应都需要加热才能反应吗?
化学能的应用
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
如:
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
【自主学习】
启示:
生物化学过程在利用“能源”上更为合理、有效。
能源的利用反映着人类进步,也促进人类的发展。
但是,人类在利用能源造福人类的同时,也造成了环境的污染。
常见的能源主要有以下十种:
太阳能、化石能源、水能、
风能、潮汐能、地热能、生物质能、核能以
及氢能。
为了保护我们的地球,应该减少化石燃料的使用,开发新技术,使燃料充分燃烧;努力开发无污染、可再生的洁净能源。
1、足够的空气
2、燃料与空气充分接触
[交流与思考]
使燃料充分燃烧需要哪些条件?
随堂练习
1.
下列说法正确的是
(
)
A.
大多数的化合反应是释放能量的反应
B.
大多数分解反应是吸收能量的反应
C.
释放能量的反应都不需要加热
D.
吸收能量的反应都需要加热
AB
2.
下列反应既属于氧化还原反应,又属于吸热反应的是
(
)
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C
第二章
化学反应与能量
第一节
化学能与热能
一飞冲天:“神舟”五号发射实况回放
生活中哪些事实说明了在化学反应中伴随着能量的变化?
【思考与交流】
一、化学键与化学反应中能量变化关系
物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
Na+
Cl-
电子转移
不稳定
稳定
更稳定
复习
化学反应的本质是什么?
金属钠
氯气
旧键断裂
新键形成
NaCl晶体比Na+、Cl-稳定,说明了什么?
说明NaCl晶体具有的能量比Na+、Cl-单独存在时具有的能量低。
讨论
表示为:
△H=E生—
E反
也就是说Na+、Cl-间形成离子键时释放了能量。
1、从物质本身包含能量的角度看:
反应物总能量>生成物总能量
反应放出能量
E反
E生
反应物总能量<生成物总能量
反应吸收能量
水能和化学能变化对比示意图
水往低处流要释放能量
(势能转化成动能)
反应物的总能量>生成物的总能量
(化学能转化成热能)
放出热量
水能和化学能变化对比示意图
将水抽到高处需要提供能量
(电能转化成机械能、再转化成势能)
反应物的总能量<生成物的总能量
(热能转化成化学能)
吸收热量
能量E
反应过程
反应过程
反应物
生成物
能量E
放热反应
吸热反应
反应物
生成物
规
律
若E反>E生,则反应放热,则为放热反应
若E反<E生,则反应吸热,则为吸热反应
☆化学反应过程可以看成是“能量”的储存和释放过程。
化学反应在发生过程中是吸收热量还是放出热量
取决于反应物总能量和和生成物总能量的相对大小。
[小结]
1、化学反应中的能量变化,通常表现为热量的变化
2、化学上把有热量放出的化学反应叫作放热反应
3、化学上把吸收热量的化学反应叫作吸热反应
4、物质能量越高,就越不稳定,能量越低,就越稳定.
H
+
H
→
H–H
;
?H=-436kJ/mol
H-H
→
H
+
H
;
?H=+436kJ/mol
CH4
→
C
+4H
;
?H=+1660kJ/mol
形成(或断裂)1mol化学键时释放(或吸收)的能量叫做键能
C
+4H
→
CH4
;
?H=-1660kJ/mol
键能越大,化学键越牢固,物质越稳定。
2、化学键与化学反应中能量变化关系
●化学键的断裂和形成是化学反应中能量变化的主要原因
当E吸>
E放
反应吸收能量
当E吸<
E放
反应放出能量
2、从键能的角度看:
反应物
生成物
化学反应:
旧化学键断裂
新化学键形成
吸收能量E吸
放出能量E放
任何化学反应都伴随着能量的变化!
表示为:
△H=∑E吸—
∑E放
【归纳小结】
一个化学反应是为放热反应还是吸热反应
取决于:
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小,
即取决于反应物的总能量与生成物的总能量的相对大小。
[练习]
1mol
H-H键的键能是436KJ,
1mol
I
–
I
键的键能是151KJ,
1molH-I
键的健能是299KJ。则H2(g)+I2(g)=2HI(g)的反应是( )
A、吸热反应 B、放热反应
C、分解反应 D、化合反应
BD
二、化学能与热能的相互转化
2、化学反应中的能量变化主要表现为热量的变化——吸热或放热
1、质量守恒定律和能量守恒定律(两条基本定律)
[实验2-1]在一支试管中加入2~3mL 6mol/L的盐酸溶液。再插入用砂纸打磨光的铝条。
现
象
方程式、结论
溶液温度升高
2Al
+
6HCl
=
2AlCl3
+
3H2
↑
放出热量;化学能转化成热能
该反应是放热反应
[实验2—2探究]
:Ba(OH)2·8H2O与NH4Cl的反应
2.整个实验中有哪些创新之处?
1.整个实验的现象、反应化学方程式和结论?
实验2-2
现象:1、玻璃片(小木板)会与小烧杯粘结在一起
2、有少许刺激性气味气体产生
3、有水生成
Ba(OH)2·
8H2O
+
2NH4Cl=BaCl2
+2NH3
+10H2O
结论:该反应是吸热反应
[思考与交流]如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?应该如何设计并进行实验?
设计实验装置和操作时应从两个方面考虑,一是注重“量”的问题。二是尽量减小实验误差。
实验2-3
盐酸温度/℃
NaOH溶液温度/
℃
中和反应后温度/
℃
结论:中和反应是放热反应。
实质:H+
+
OH-
=
H2O
反应后温度升高
室温
室温
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
(每生成1mol水放出57.3KJ的热量)
一是注重“量”的问题
用稀溶液进行中和反应,减小溶解热的干扰。
用强酸和强碱溶液反应,减少电离热效应的干扰;
每次取等量的酸碱进行反应。
做平行实验取平均值
二是尽量减小实验误差
增强保温隔热措施,减少实验中热量的损失
不断搅拌,使热量分散均匀。
温度计的精确度要高。
中和热的测定
装置
-----碎泡沫塑料
---玻璃搅拌器
---温度计
在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如上图所示。该实验也可在保温杯中进行。
例、
如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量
(填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体.
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体.
(3)Mg+2H+=Mg2++H2?
(4)小于
[交流与思考]
试归纳常见的放热反应和吸热反应。
常见的放热反应:
(1)所有燃烧反应
(2)中和反应
(3)大多数化合反应
(例外C+CO2=CO)
(4)活泼金属跟水或酸反应
(5)物质的缓慢氧化
常见的吸热反应:
(1)大多数分解反应(特殊爆炸反应为吸热)
(2)晶体间的反应
(3)以C、H2、CO为还原剂的氧化还原反应。
△
[讨论]放热反应都能自发进行吗?吸热反应都需要加热才能反应吗?
化学能的应用
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
如:
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
【自主学习】
启示:
生物化学过程在利用“能源”上更为合理、有效。
能源的利用反映着人类进步,也促进人类的发展。
但是,人类在利用能源造福人类的同时,也造成了环境的污染。
常见的能源主要有以下十种:
太阳能、化石能源、水能、
风能、潮汐能、地热能、生物质能、核能以
及氢能。
为了保护我们的地球,应该减少化石燃料的使用,开发新技术,使燃料充分燃烧;努力开发无污染、可再生的洁净能源。
1、足够的空气
2、燃料与空气充分接触
[交流与思考]
使燃料充分燃烧需要哪些条件?
随堂练习
1.
下列说法正确的是
(
)
A.
大多数的化合反应是释放能量的反应
B.
大多数分解反应是吸收能量的反应
C.
释放能量的反应都不需要加热
D.
吸收能量的反应都需要加热
AB
2.
下列反应既属于氧化还原反应,又属于吸热反应的是
(
)
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C
