人教版高中化学选修5-3.1:醇 酚(69张PPT)
文档属性
| 名称 | 人教版高中化学选修5-3.1:醇 酚(69张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-22 00:00:00 | ||
图片预览







文档简介
(共69张PPT)
新课标人教版高中化学选修5
借
问
酒
家
何
处
有
?
牧
童
遥
指
杏
花
村。
明
月
几
时
有
?
把
酒
问
青
天
!
第三章
烃的含氧衍生物
第一节
醇
酚
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
一、
醇、酚的区别
醇
醇
酚
醇
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
酚
①
②
③
④
⑤
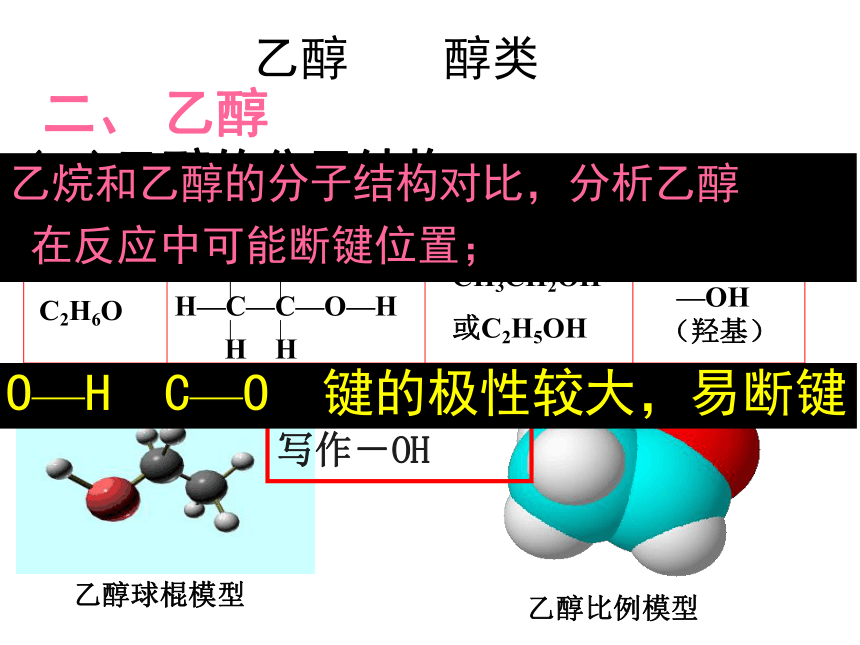
乙醇
醇类
二、?乙醇
(一)乙醇的分子结构
分子式
结构式
结构简式
官能团
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
乙醇比例模型
乙醇球棍模型
官能团:羟基
写作-OH
乙烷和乙醇的分子结构对比,分析乙醇
在反应中可能断键位置;
O—H
C—O
键的极性较大,易断键
(二)、乙醇物理性质:
重要有机溶剂,能溶解多种有机物和无机物
颜色:
无色
状态:
液态
气味:
特殊香味
熔点:
-117.3℃
沸点:
78.5℃
易挥发
密度:
比水小
20℃时0.789g/cm3
溶解性:
与水任意比互溶
工业酒精
约含乙醇96%以上(质量分数)
无水酒精
99.5%以上(质量分数)
医用酒精
75%(体积分数)
如何检验酒精是否含水?
用无水硫酸铜检验
.变蓝色.
④
①
③
H—C—C—O—H
H
H
H
H
②
乙醇的结构式:
我们已经学习过乙醇的一些性质。请与同学交流你所知道的乙醇的化学性质,试列举乙醇发生的化学反应,并指出在反应过程中乙醇分子中的哪些化学键发生了断裂?
交流与讨论:
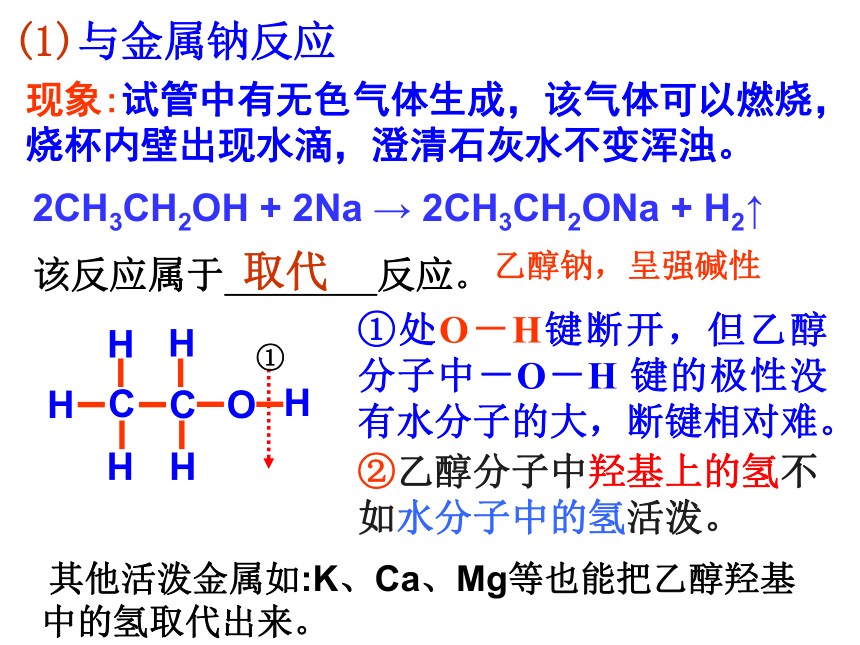
(三)、?乙醇的化学性质
现象:试管中有无色气体生成,该气体可以燃烧,烧杯内壁出现水滴,澄清石灰水不变浑浊。
(1)与金属钠反应
乙醇钠,呈强碱性
2CH3CH2OH
+
2Na
→
2CH3CH2ONa
+
H2↑
①处O-H键断开,但乙醇分子中-O-H
键的极性没有水分子的大,断键相对难。
①
H
H
C
H
H
C
H
O
H
该反应属于
反应。
取代
②乙醇分子中羟基上的氢不如水分子中的氢活泼。
其他活泼金属如:K、Ca、Mg等也能把乙醇羟基中的氢取代出来。
问题与思考:
1、钠和乙醇与钠和水反应比较,哪一个更剧烈?
2、如何检验反应中生成的气体是氢气?
3、钠和乙醇反应时,乙醇分子中哪个键发生了断裂?
A、C-H
B、C-C
C、C-O
D、O-H
4、该实验说明羟基中氢原子的活泼性顺序为:
H-OH
C2H5-OH
钠与水的
反应剧烈
D、O-H
>
H—OH
C2H5—OH
由于羟基所连的原子或原子团不一样,从而导致羟基氢的活泼性不一样。
如:
H—OH
>
C2H5—OH
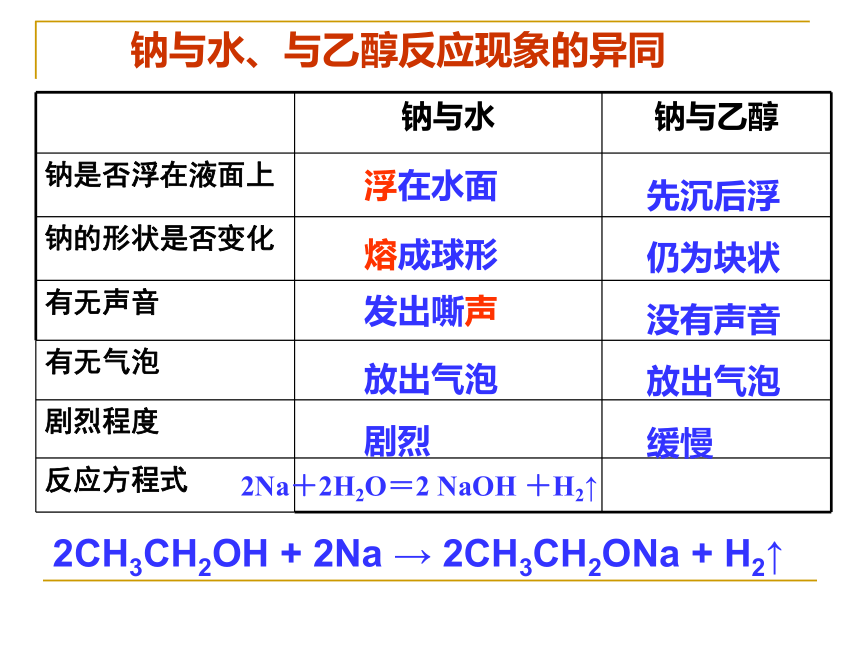
钠与水、与乙醇反应现象的异同
钠与水
钠与乙醇
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
先沉后浮
仍为块状
没有声音
放出气泡
缓慢
2Na+2H2O=2
NaOH
+H2↑
2CH3CH2OH
+
2Na
→
2CH3CH2ONa
+
H2↑
浮在水面
熔成球形
发出嘶声
放出气泡
剧烈
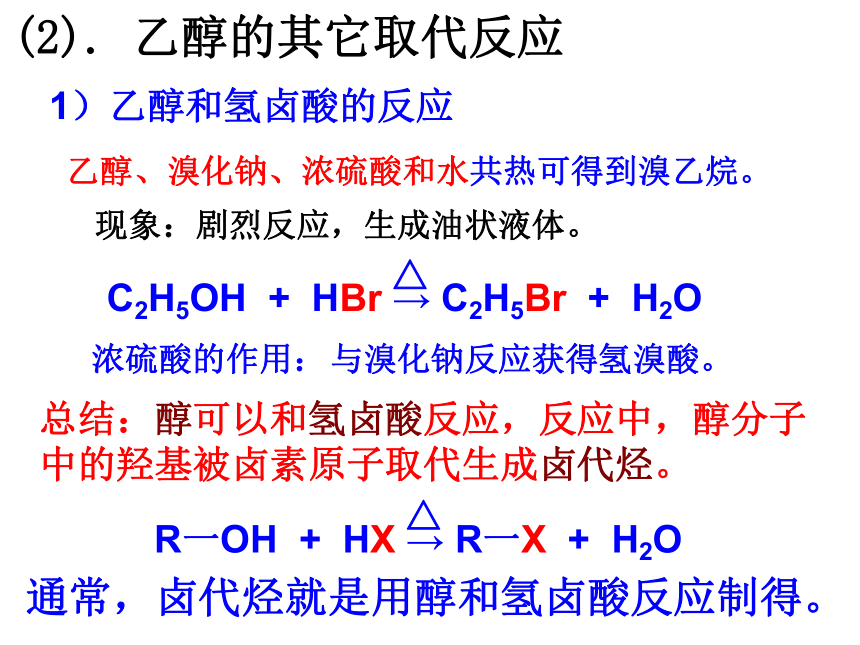
(2).
乙醇的其它取代反应
C2H5OH
+
HBr
→
C2H5Br
+
H2O
△
1)乙醇和氢卤酸的反应
乙醇、溴化钠、浓硫酸和水共热可得到溴乙烷。
现象:剧烈反应,生成油状液体。
总结:醇可以和氢卤酸反应,反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
R一OH
+
HX
→
R一X
+
H2O
△
通常,卤代烃就是用醇和氢卤酸反应制得。
浓硫酸的作用:
与溴化钠反应获得氢溴酸。
(取代反应)
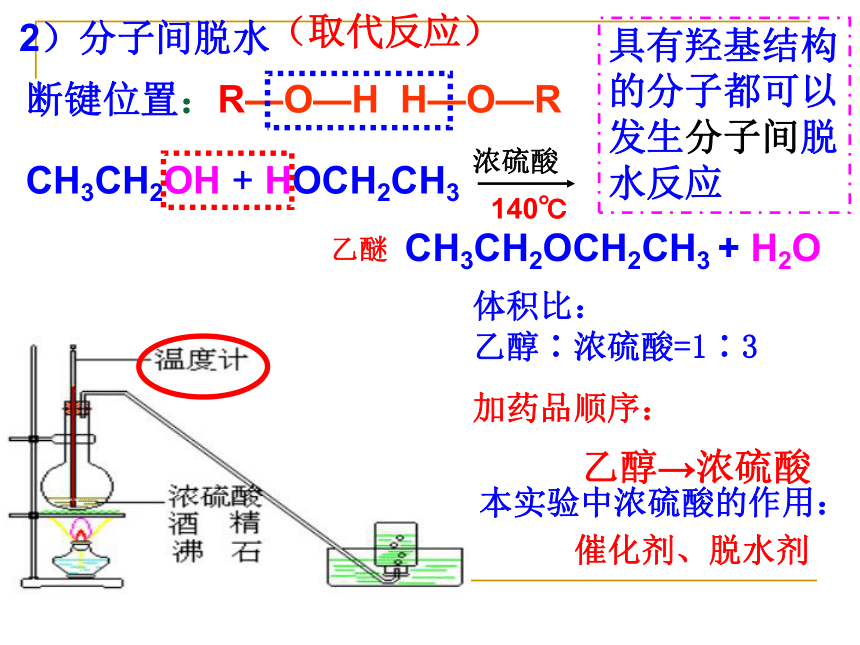
2)分子间脱水
断键位置:R—O—H
H—O—R
CH3CH2OH
+
HOCH2CH3
浓硫酸
140℃
CH3CH2OCH2CH3
+
H2O
具有羟基结构的分子都可以发生分子间脱水反应
乙醚
本实验中浓硫酸的作用:
催化剂、脱水剂
体积比:
乙醇∶浓硫酸=1∶3
加药品顺序:
乙醇→浓硫酸
3)酯化反应
18
18
O
O
CH3—C—OH+H—O—C2H5
CH3—C—O—C2H5
+
H2O
浓H2SO4
实质:酸脱羟基、醇脱羟基上的氢原子。(一般)
注意:可逆反应
C2H5O—NO2
+
H2O
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
C2H5OH
+
HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
如:
醇还可以与一些无机含氧酸(如
H2SO4、HNO3等)发生酯化反应。
(取代反应)
(3)氧化反应
CH3CH2OH
+
3O2
2CO2
+
3H2O
点燃
②能使酸性高锰酸钾溶液褪色
说明乙醇有还原性,且最终被氧化为乙酸
(淡蓝色火焰)
①
燃烧
③催化氧化
(实验3-3)
2Cu
+
O2
2CuO
△
CH3CH2OH
+
CuO
→
CH3CHO
+
Cu
+
H2O
△
红色变为黑色
Cu丝黑色又变为红色,液体产生特殊气味(乙醛的气味)
现象:
总:
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
Cu
△
Cu是催化剂,但实际起氧化作用的是CuO。
li
chuan
of
hu
bei
有机物的氧化反应、还原反应的含义:
氧化反应:有机物分子中失去氢原子或加
入氧原子的反应(失H或加O)
还原反应:有机物分子中加入氢原子或失去
氧原子的反应(加H或失O)
醇被氧化的机理:去
H
的反应
①-③位断键
①
③
R2—C—O—H
R1
H
+
O2
2
生成醛或酮
+
2H2
O
—C=O
R1
R2
2
Cu
△
②
★连接-OH的碳原子上必须有H,
才发生去氢氧化(催化氧化)。
练习写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
2
+
O2
→
2CH3CH2C-H
+
2H2O
=
O
Cu
△
2
+
O2
→
2CH3-C-CH3
+2
H2O
=
O
Cu
△
催化剂为铜或银
催化氧化类型小结
:
叔醇(—OH在叔碳——碳原子上没有H),则不能去氢氧化。
C
OH
R2
R1
R3
(3).
(2).
2
CH—OH
+
O2
R2
R1
Cu
△
(1).
2R—CH2—OH
+
O2
Cu
△
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛.
羟基碳上至少有2个氢原子的醇被氧化成醛。
O
=
2R—C—H
+
2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
羟基碳上只有有1个氢原子的醇被氧化成酮。
O
=
2R1—C—R2
+
2H2O
醇的催化氧化也可以用银作催化剂。
饮美酒可以去天堂
酒后驾车导致车祸不断
一念之间,想喝吗?
2CrO3(红色)+
3C2H5OH
+
3H2SO4
Cr2(SO4)3(绿色)+
3CH3CHO
+
6H2O
(4)乙醇的脱水反应
选五P52
实验3-1
现象:大试管内剧烈反应,小试管内收集到无色气体。
乙醇可以在Al2O3、浓硫酸或石棉绒等催化剂的作用下发生脱水反应。实验室利用乙醇和浓硫酸的共热脱水反应来获得乙烯或乙醚。
H
H
H
H
H
C
C
OH
H
H
H
H
C
C
浓H2SO4
1700C
+
H2O
(消去反应)
分子内脱水
断键位置:
H
C
C
OH
制乙烯实验装置
为何使液体温度迅速升到170℃?
酒精与浓硫酸体积比为何
要为1∶3?
放入几片碎瓷片作用是什么?
用排水集气法收集
浓硫酸的作用是什么?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
1、放入几片碎瓷片作用是什么?
防止暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
思考:能发生消去反应的醇,分子结构特点是什么?是不是所有的醇都能发生消去反应?
与乙醇同类的烃的衍生物,它们能否发生象乙醇那样的消去反应?
CH3OH
CH3一C一CH2一OH
CH3
CH3
CH3一C一OH
CH3
CH3
结论:醇发生消去反应的条件:与-OH相连的碳原子相邻的碳原子有氢原子。(所有的醇
能发生取代反应)
学与问
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸、加热到170℃
P50溴乙烷与乙醇都能发生消去反应,它们有什么异同?
小结:
乙醇的结构
乙醇的化学性质
1、乙醇的结构式
2、乙醇的电子式
3、乙醇的结构简式
1、跟金属的反应
2、氧化反应
3、脱水反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应
断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
②
④
②
①
③
①
、②
①
①
(四)、无水乙醇的制备
工业酒精:96%、无水酒精:99.5%
工业酒精与新制的生石灰混合,加热
蒸馏。
酒精中是否含水的验证:无水硫酸
铜是否变蓝
(五)、?工业制乙醇
1.?发酵法
2.?乙烯水化法
CH3—CH2OH
CH2=CH2
+
H—OH
催化剂
高温高压
五:乙醇的用途:
乙
醇
饮
料
化工原料
溶
剂
医
药
燃料
1
2
3
4
5
75%的酒精
可作消毒剂
大量乙醇以饮料形式生产和消费,血
液中乙醇的正常含量为0.001%,一般
人当血液中乙醇含量达到0.1%即处于
强烈兴奋状态,达到0.2%就沉醉,
超过0.3%就会引起酒精中毒,昏迷
甚至死亡。
乙醇是一种抗震性能好、无污染的理想燃料,用
乙醇代替汽油,有与汽油混用和单独使用两种方法,目前应用较广的是与汽油混用法。一般在汽油中掺入10%--20%的酒精。这种混合燃料,由于酒精的抗
震性能好,不再加入四乙基铅,从而减少汽车尾
气对环境的污染。
三、醇类
(一).醇的概念:
烃分子中含有跟链烃基或苯环侧链上得碳结合的羟基(—OH)的化合物。
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
OH
苯酚
OH
CH3
邻甲基苯酚
羟基与苯环直接相连而形成的化合物称为酚。
(二).醇的分类
1、根据羟基所连烃基的种类
2、根据醇分子结构中羟基的数目,醇可分为一元醇、二元醇、三元醇……
CnH2n+1OH
或
CnH2n+2O
饱和一元醇通式:
含两个以上羟基的醇属于多元醇
分类的依据:2.所含羟基的数目
一元醇:只含一个羟基
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
二元醇:含两个羟基
多元醇:多个羟基
下列醇分别属于哪一类
练习
C
H
3
C
H
2
O
H
C
H
2
=
C
H
C
H
2
O
H
O
H
C
H
2
O
H
①
②
③
④
⑤
⑥
蒸馏
蒸馏
Mg粉
CaO
⑴甲醇
(3)乙二醇
(4)丙三醇
无色液体,有酒味,有毒,俗称木精或木醇.人饮用10ml就能使眼睛失明,再多则能致死。可作车用燃料,是新的可再生能源。工业酒精中含少量甲醇
无色、黏稠有甜味的液体,易溶于水和乙醇。
俗称甘油,是无色、黏稠有甜味的液体,吸湿性强,具有护肤作用。能跟水、酒精以任意比混溶。
无色透明液体,具有特殊香味的液体,密度为0.789g/cm3,沸点78.5℃,易挥发,能与水以任意比互溶,能够溶解多种无机物和有机物,是一种良好的有机溶剂.
⑵乙醇
工业酒精(96%)
无水酒精(99.5%)
绝对酒精(100%)
酒精中是否含水的验证:用无水硫酸铜是否变蓝。
(三)、常见醇
乙二醇可用于汽车作防冻剂,
丙三醇可用于配制化妆品。
名称
相对分子质量
沸点/℃
甲醇
32
64.7
乙烷
30
-88.6
乙醇
46
78.5
丙烷
44
-42.1
丙醇
60
97.2
丁烷
58
-0.5
表3-1相对分子质量相近的醇与烷烃的沸点比较
(四)、
醇的物理通性
思考与交流
结论:
原因:
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着氢键。
表3-2
含相同碳原子数不同羟基数的醇的沸点比较
名称
分子中羟基数目
沸点/℃
乙醇
1
78.5
乙二醇
2
197.3
1-丙醇
1
97.2
1,2-二丙醇
2
188
1,2,3-丙三醇
3
259
醇分子中的羟基的氧原子与另一之间醇分子中的羟基的氢原子相互吸引,形成氢键,使醇的沸点高于烷烃,同样道理,使醇易溶于水。
醇的沸点变化规律:
(1)同碳原子数醇,羟基数目越多,沸点越高。(氢键数目增多)
(2)羟基数目相同的类醇,碳原子数越多。沸点越高。(相对分子
质量增大)
醇的溶解性变化规律:随碳原子的数目增多,醇的溶解性减小
1、取代反应
(2)
分子间脱水
(3)酯化反应
(4)HX反应:
(1)与活泼金属的反应(取代反应)
(五)、醇类化学性质:
2、消去反应(分子内脱水)
判断醇类发生消去反应的条件
醇分子结构中含有β-H(邻碳有氢)
卤代烃与醇都能发生消去反应,它们有什么异同点?
相同:
分子结构中都必须含有β-H
不同点:
官能团不同、反应条件不同、断键不同、产物不同
Weishan
an
High
School
3.氧化反应:
(1)燃烧:
(2)催化氧化:
条件:
Cu、Ag作催化剂同时加热
2CH3CH2OH
+
O2
2CH3CHO+2H2O
Cu或Ag
△
(3)强氧化剂氧化
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
(六)醇的命名
(2)编号位
(1)选主链
(3)写名称
选含—OH的最长碳链为主链.主链尽可能多的包含羟基或连接羟基的碳原子
从离—OH最近的一端起编号
取代基位置—
取代基名称
—
羟基位置—
母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)
资料卡片
CH2OH
苯甲醇
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或甘油、丙三醇)
CH3CHCH3
OH
2—丙醇
CH3—CH2—CH—CH3
OH
CH3—CH—C—OH
CH3
CH2—CH3
CH3
②
③
[练习]
写出下列醇的名称
CH3—CH—CH2—OH
CH3
①
2—甲基—1—丙醇
2—丁醇
2,3—二甲基—3—戊醇
(七)醇的同分异构体
醇类的同分异构体可有:
(1)碳链异构、
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
练习:
写出C4H10O
四、酚
(一).苯酚的物理性质
颜色
气味
状态
密度
溶解性
毒性
纯苯酚无色,露置在空气中因被氧化而显粉红色。
有特殊气味
常温下固态,熔点不高(43
℃),沸点
181.7℃
大于水,通常情况在水中为乳状
常温时苯酚在水中溶解度不大,高于
65℃时能与水混溶。易溶于乙醇、苯等
有毒,强腐
蚀性
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心,如果不慎沾到皮肤上,应立即用酒精洗涤。
O
H
或
C6H5O
H
结构式:
分子式:
结构简式:
(二)、苯酚的分子结构
C6H6O
比例模型
球棍模型
苯酚分子中除-OH上的H原子以外的所有原子都在同一平面上,且-OH上的H也可能出现在该平面
乙醇和苯酚中都有-OH,其性质是否相同?(结合甲烷与甲苯分别与高锰酸钾溶液混合的现象)预测-OH与苯环相连后使-OH的活泼性有何变化?
结合乙醇-OH和水中的H的活泼性比较,试用实验方法来比较乙醇和苯酚-OH上的H的活泼性?
(三).苯酚的化学性质
1、苯酚的酸性
澄清
浑浊
(三)、苯酚的化学性质
结论:
苯环对侧链(羟基)的影响导致酚羟基中的氧氢键易断,显酸性
石炭酸
苯氧离子
苯酚酸性强弱的探究
现象
原因或方程式
与盐酸反应
与CO2反应
与指示剂作用
Na2CO3反应
结论:
苯酚酸性极弱,不使指示剂变色
酸性:H2CO3
>
C6H5OH
>
HCO3-
:苯酚钠与CO2反应只生成HCO3-
酸性极弱
变浑浊
变浑浊
不变色
颜色变浅
2.苯酚与溴水的反应
实验3-4
(白色)
观察现象并思考实验中应注意问题
此反应很灵敏,常用于苯酚的定性检验和定量测定。
(取代反应)
实验中苯酚不能过量,否则产生的三溴苯酚易溶于苯酚而观察不到白色沉淀。
注意:
结论:
侧链(羟基)对苯环的影响导致苯环上与羟基邻、对位的氢原子活泼,易被取代
3.苯酚的显色反应
苯酚溶液
苯酚与溴水的反应很灵敏,常用于苯酚的定性检验和定量测定,也可利用苯酚的这一性质检验FeCl3。也常用FeCl3来检验酚羟基的存在(显色)。
FeCl3
紫色
实验与观察现象
Fe3+
紫色
溶液
苯酚、苯与溴取代反应的比较
比较
苯酚
苯
反应物
反应条件
取代氢原子数
反应速率
结论
浓溴水
液溴
不需要催化剂
Fe作催化剂
三个
一个
快
稍慢
苯酚与溴的取代反应比苯容易,
即-OH对苯环的影响:使苯环邻对位上的氢原子更活泼
4、氧化反应
具有强还原性
苯酚易被空气中的氧气氧化而呈粉红色
思考:苯酚能否使高锰酸钾酸性溶液褪色?
对-苯醌
苯酚溶液
高锰酸钾酸性溶液
褪色
结论:
苯酚能使高锰酸钾酸性溶液褪色
学与问P54
化合物的性质主要是由官能团决定的,但官能团所连接的烃基对官能团的性质也有一定的影响。苯酚分子中苯环上连有一羟基,由于羟基对苯环的影响,使得苯酚分子中苯环上的氢原子比苯分子中的氢原子更活泼,因此苯酚比苯更易发生取代反应。
当羟基所连接的烃基不同时,羟基的性质也不同。因此,苯酚分子中由于苯环对羟基的影响,使羟基中的氢原子性质较活泼,容易发生电离,因此显示弱酸性;而在乙醇分子中,由于乙基对羟基的影响使羟基上的氢原子反而不容易发生电离(比水还难电离),因此不显示酸性。
由此可见:不同的烃基与羟基相连,可以影响物质的化学性质。
(四)苯酚的用途
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
1、怎样分离苯酚和苯的混合物
加入NaOH溶液→分液→在苯酚钠溶液中加酸或通入CO2
2、如何鉴别苯酚
B
利用与浓溴水生成三溴苯酚白色沉淀
A
利用与三价铁离子的显色反应
巩固练习
2.下列各醇不能发生消去反应的是(
)
A.CH3OH
B.C2H5OH
C.(CH3)3C-OH
D.(CH3)3C-CH2-OH
AD
3.
有组成为CH4O和C3H8O的混合物,在一定条件下进行脱水反应,可能生成其它有机化合物的种数有(
)
A.5
B.6
C.7
D.8
A
已知乙醇的分子式是C2H6O,根据碳四价、氢一价的价键规则,它有两种可能的结构:
CH3CH2
OH
CH3
O
CH3
实验设计考虑
:
仪器、方法、药品、注意事项等
思考:
1、为什么要冷却后再读数?
2、为什么量筒中的导管要充满水且要插入水中?
3、请你回去再设计一种量气装置。
实验的操作如下:
1、从分液漏斗中逐滴把无水乙醇加入到烧瓶中,并控制反应速率,酒精加完后关闭活塞。
2、在广口瓶中加入适量的水。
3、待烧瓶冷却后对量筒读数。
4、把定量VmL无水乙醇完全倒入分液漏斗中。
5、检查装置的气密性。
6、将几小块钠(足量)放入烧瓶中。
正确的操作顺序是
。
5
6
4
2
1
3
或
5
2
6
4
1
3
若上述实验的数据是在标准状态下测定的,无水乙醇的密度为p
g/cm-3,充分反应后量筒内液面读数为a
mL,则一个
乙醇分子中能被置换的氢原子数为
。(用含a、V、p的式子表示)
n(H)=23
a
/5600
Vp
你知道吗?
日本利用蟹壳清除工业废水中有毒物质—苯酚
据报道,研究人员向含苯酚的工业废水中添加遇热凝固的脱乙酰壳多糖(从蟹壳中提炼)和少量能使苯酚变成苯酚类化合物的酶,然后将其加热到37至45摄氏度,脱乙酰壳多糖受热凝固并把苯酚类化合物和酶包裹其间。然后,滤去沉淀的脱乙酰壳多糖,并使其温度降到30摄氏度以下,这时脱乙酰壳多糖由固态变成液态,苯酚类化合物和酶从中分离。研究人员通过实验证实,按照这种方法处理过的工业废水中苯酚含量能达到环保要求。同时,脱乙酰壳多糖几乎可以100%回收再利用,酶也有70%左右能再利用。
【练习】
1、右面四种物质中:
①与氢氧化钠溶液发生反应的是[? ?
];
②与溴水发生取代反应的是[?? ?
];
B
D?
B
D
苯酚
溶液显紫色
乙醇
FeCl3
溶液
溶液无明显变化
氢氧化钠
有红褐色沉淀生成
硫氰化钾
溶液现血红色
2、有四种无色溶液,分别为苯酚、乙醇、氢氧化钠、硫氰化钾,请选用一种试剂,把它们区别开来。
先加入足量的烧碱溶液,然后再分液(上层即为苯)。
[练习]
如何除去混在苯中的苯酚?能不能采用先加入溴水再过滤的方法?
不能用溴水。因为虽然苯酚会和溴水反应生成的2,4,6—三溴苯酚难溶于水,但易溶于苯中而不易分离。再就是,从除杂彻底的角度来说,加溴水要过量,而过量的溴又混入了苯中。因此不能用溴水来除去苯中的苯酚
有关物质的结构比较
物质
官能团
结构特点
类别
脂肪醇
芳香醇
酚
CH3CH2OH
—OH
—OH
羟基与链烃基相连
羟基与芳烃
基侧链相连
羟基与苯环
直接相连
—OH
—CH2OH
—OH
新课标人教版高中化学选修5
借
问
酒
家
何
处
有
?
牧
童
遥
指
杏
花
村。
明
月
几
时
有
?
把
酒
问
青
天
!
第三章
烃的含氧衍生物
第一节
醇
酚
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
一、
醇、酚的区别
醇
醇
酚
醇
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
酚
①
②
③
④
⑤
乙醇
醇类
二、?乙醇
(一)乙醇的分子结构
分子式
结构式
结构简式
官能团
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
乙醇比例模型
乙醇球棍模型
官能团:羟基
写作-OH
乙烷和乙醇的分子结构对比,分析乙醇
在反应中可能断键位置;
O—H
C—O
键的极性较大,易断键
(二)、乙醇物理性质:
重要有机溶剂,能溶解多种有机物和无机物
颜色:
无色
状态:
液态
气味:
特殊香味
熔点:
-117.3℃
沸点:
78.5℃
易挥发
密度:
比水小
20℃时0.789g/cm3
溶解性:
与水任意比互溶
工业酒精
约含乙醇96%以上(质量分数)
无水酒精
99.5%以上(质量分数)
医用酒精
75%(体积分数)
如何检验酒精是否含水?
用无水硫酸铜检验
.变蓝色.
④
①
③
H—C—C—O—H
H
H
H
H
②
乙醇的结构式:
我们已经学习过乙醇的一些性质。请与同学交流你所知道的乙醇的化学性质,试列举乙醇发生的化学反应,并指出在反应过程中乙醇分子中的哪些化学键发生了断裂?
交流与讨论:
(三)、?乙醇的化学性质
现象:试管中有无色气体生成,该气体可以燃烧,烧杯内壁出现水滴,澄清石灰水不变浑浊。
(1)与金属钠反应
乙醇钠,呈强碱性
2CH3CH2OH
+
2Na
→
2CH3CH2ONa
+
H2↑
①处O-H键断开,但乙醇分子中-O-H
键的极性没有水分子的大,断键相对难。
①
H
H
C
H
H
C
H
O
H
该反应属于
反应。
取代
②乙醇分子中羟基上的氢不如水分子中的氢活泼。
其他活泼金属如:K、Ca、Mg等也能把乙醇羟基中的氢取代出来。
问题与思考:
1、钠和乙醇与钠和水反应比较,哪一个更剧烈?
2、如何检验反应中生成的气体是氢气?
3、钠和乙醇反应时,乙醇分子中哪个键发生了断裂?
A、C-H
B、C-C
C、C-O
D、O-H
4、该实验说明羟基中氢原子的活泼性顺序为:
H-OH
C2H5-OH
钠与水的
反应剧烈
D、O-H
>
H—OH
C2H5—OH
由于羟基所连的原子或原子团不一样,从而导致羟基氢的活泼性不一样。
如:
H—OH
>
C2H5—OH
钠与水、与乙醇反应现象的异同
钠与水
钠与乙醇
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
先沉后浮
仍为块状
没有声音
放出气泡
缓慢
2Na+2H2O=2
NaOH
+H2↑
2CH3CH2OH
+
2Na
→
2CH3CH2ONa
+
H2↑
浮在水面
熔成球形
发出嘶声
放出气泡
剧烈
(2).
乙醇的其它取代反应
C2H5OH
+
HBr
→
C2H5Br
+
H2O
△
1)乙醇和氢卤酸的反应
乙醇、溴化钠、浓硫酸和水共热可得到溴乙烷。
现象:剧烈反应,生成油状液体。
总结:醇可以和氢卤酸反应,反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
R一OH
+
HX
→
R一X
+
H2O
△
通常,卤代烃就是用醇和氢卤酸反应制得。
浓硫酸的作用:
与溴化钠反应获得氢溴酸。
(取代反应)
2)分子间脱水
断键位置:R—O—H
H—O—R
CH3CH2OH
+
HOCH2CH3
浓硫酸
140℃
CH3CH2OCH2CH3
+
H2O
具有羟基结构的分子都可以发生分子间脱水反应
乙醚
本实验中浓硫酸的作用:
催化剂、脱水剂
体积比:
乙醇∶浓硫酸=1∶3
加药品顺序:
乙醇→浓硫酸
3)酯化反应
18
18
O
O
CH3—C—OH+H—O—C2H5
CH3—C—O—C2H5
+
H2O
浓H2SO4
实质:酸脱羟基、醇脱羟基上的氢原子。(一般)
注意:可逆反应
C2H5O—NO2
+
H2O
CH3COOCH3
+
H2O
CH3COOH
+
HOCH3
浓H2SO4
C2H5OH
+
HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
如:
醇还可以与一些无机含氧酸(如
H2SO4、HNO3等)发生酯化反应。
(取代反应)
(3)氧化反应
CH3CH2OH
+
3O2
2CO2
+
3H2O
点燃
②能使酸性高锰酸钾溶液褪色
说明乙醇有还原性,且最终被氧化为乙酸
(淡蓝色火焰)
①
燃烧
③催化氧化
(实验3-3)
2Cu
+
O2
2CuO
△
CH3CH2OH
+
CuO
→
CH3CHO
+
Cu
+
H2O
△
红色变为黑色
Cu丝黑色又变为红色,液体产生特殊气味(乙醛的气味)
现象:
总:
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
Cu
△
Cu是催化剂,但实际起氧化作用的是CuO。
li
chuan
of
hu
bei
有机物的氧化反应、还原反应的含义:
氧化反应:有机物分子中失去氢原子或加
入氧原子的反应(失H或加O)
还原反应:有机物分子中加入氢原子或失去
氧原子的反应(加H或失O)
醇被氧化的机理:去
H
的反应
①-③位断键
①
③
R2—C—O—H
R1
H
+
O2
2
生成醛或酮
+
2H2
O
—C=O
R1
R2
2
Cu
△
②
★连接-OH的碳原子上必须有H,
才发生去氢氧化(催化氧化)。
练习写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
2
+
O2
→
2CH3CH2C-H
+
2H2O
=
O
Cu
△
2
+
O2
→
2CH3-C-CH3
+2
H2O
=
O
Cu
△
催化剂为铜或银
催化氧化类型小结
:
叔醇(—OH在叔碳——碳原子上没有H),则不能去氢氧化。
C
OH
R2
R1
R3
(3).
(2).
2
CH—OH
+
O2
R2
R1
Cu
△
(1).
2R—CH2—OH
+
O2
Cu
△
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛.
羟基碳上至少有2个氢原子的醇被氧化成醛。
O
=
2R—C—H
+
2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
羟基碳上只有有1个氢原子的醇被氧化成酮。
O
=
2R1—C—R2
+
2H2O
醇的催化氧化也可以用银作催化剂。
饮美酒可以去天堂
酒后驾车导致车祸不断
一念之间,想喝吗?
2CrO3(红色)+
3C2H5OH
+
3H2SO4
Cr2(SO4)3(绿色)+
3CH3CHO
+
6H2O
(4)乙醇的脱水反应
选五P52
实验3-1
现象:大试管内剧烈反应,小试管内收集到无色气体。
乙醇可以在Al2O3、浓硫酸或石棉绒等催化剂的作用下发生脱水反应。实验室利用乙醇和浓硫酸的共热脱水反应来获得乙烯或乙醚。
H
H
H
H
H
C
C
OH
H
H
H
H
C
C
浓H2SO4
1700C
+
H2O
(消去反应)
分子内脱水
断键位置:
H
C
C
OH
制乙烯实验装置
为何使液体温度迅速升到170℃?
酒精与浓硫酸体积比为何
要为1∶3?
放入几片碎瓷片作用是什么?
用排水集气法收集
浓硫酸的作用是什么?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
1、放入几片碎瓷片作用是什么?
防止暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
思考:能发生消去反应的醇,分子结构特点是什么?是不是所有的醇都能发生消去反应?
与乙醇同类的烃的衍生物,它们能否发生象乙醇那样的消去反应?
CH3OH
CH3一C一CH2一OH
CH3
CH3
CH3一C一OH
CH3
CH3
结论:醇发生消去反应的条件:与-OH相连的碳原子相邻的碳原子有氢原子。(所有的醇
能发生取代反应)
学与问
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸、加热到170℃
P50溴乙烷与乙醇都能发生消去反应,它们有什么异同?
小结:
乙醇的结构
乙醇的化学性质
1、乙醇的结构式
2、乙醇的电子式
3、乙醇的结构简式
1、跟金属的反应
2、氧化反应
3、脱水反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应
断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
②
④
②
①
③
①
、②
①
①
(四)、无水乙醇的制备
工业酒精:96%、无水酒精:99.5%
工业酒精与新制的生石灰混合,加热
蒸馏。
酒精中是否含水的验证:无水硫酸
铜是否变蓝
(五)、?工业制乙醇
1.?发酵法
2.?乙烯水化法
CH3—CH2OH
CH2=CH2
+
H—OH
催化剂
高温高压
五:乙醇的用途:
乙
醇
饮
料
化工原料
溶
剂
医
药
燃料
1
2
3
4
5
75%的酒精
可作消毒剂
大量乙醇以饮料形式生产和消费,血
液中乙醇的正常含量为0.001%,一般
人当血液中乙醇含量达到0.1%即处于
强烈兴奋状态,达到0.2%就沉醉,
超过0.3%就会引起酒精中毒,昏迷
甚至死亡。
乙醇是一种抗震性能好、无污染的理想燃料,用
乙醇代替汽油,有与汽油混用和单独使用两种方法,目前应用较广的是与汽油混用法。一般在汽油中掺入10%--20%的酒精。这种混合燃料,由于酒精的抗
震性能好,不再加入四乙基铅,从而减少汽车尾
气对环境的污染。
三、醇类
(一).醇的概念:
烃分子中含有跟链烃基或苯环侧链上得碳结合的羟基(—OH)的化合物。
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
OH
苯酚
OH
CH3
邻甲基苯酚
羟基与苯环直接相连而形成的化合物称为酚。
(二).醇的分类
1、根据羟基所连烃基的种类
2、根据醇分子结构中羟基的数目,醇可分为一元醇、二元醇、三元醇……
CnH2n+1OH
或
CnH2n+2O
饱和一元醇通式:
含两个以上羟基的醇属于多元醇
分类的依据:2.所含羟基的数目
一元醇:只含一个羟基
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
二元醇:含两个羟基
多元醇:多个羟基
下列醇分别属于哪一类
练习
C
H
3
C
H
2
O
H
C
H
2
=
C
H
C
H
2
O
H
O
H
C
H
2
O
H
①
②
③
④
⑤
⑥
蒸馏
蒸馏
Mg粉
CaO
⑴甲醇
(3)乙二醇
(4)丙三醇
无色液体,有酒味,有毒,俗称木精或木醇.人饮用10ml就能使眼睛失明,再多则能致死。可作车用燃料,是新的可再生能源。工业酒精中含少量甲醇
无色、黏稠有甜味的液体,易溶于水和乙醇。
俗称甘油,是无色、黏稠有甜味的液体,吸湿性强,具有护肤作用。能跟水、酒精以任意比混溶。
无色透明液体,具有特殊香味的液体,密度为0.789g/cm3,沸点78.5℃,易挥发,能与水以任意比互溶,能够溶解多种无机物和有机物,是一种良好的有机溶剂.
⑵乙醇
工业酒精(96%)
无水酒精(99.5%)
绝对酒精(100%)
酒精中是否含水的验证:用无水硫酸铜是否变蓝。
(三)、常见醇
乙二醇可用于汽车作防冻剂,
丙三醇可用于配制化妆品。
名称
相对分子质量
沸点/℃
甲醇
32
64.7
乙烷
30
-88.6
乙醇
46
78.5
丙烷
44
-42.1
丙醇
60
97.2
丁烷
58
-0.5
表3-1相对分子质量相近的醇与烷烃的沸点比较
(四)、
醇的物理通性
思考与交流
结论:
原因:
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着氢键。
表3-2
含相同碳原子数不同羟基数的醇的沸点比较
名称
分子中羟基数目
沸点/℃
乙醇
1
78.5
乙二醇
2
197.3
1-丙醇
1
97.2
1,2-二丙醇
2
188
1,2,3-丙三醇
3
259
醇分子中的羟基的氧原子与另一之间醇分子中的羟基的氢原子相互吸引,形成氢键,使醇的沸点高于烷烃,同样道理,使醇易溶于水。
醇的沸点变化规律:
(1)同碳原子数醇,羟基数目越多,沸点越高。(氢键数目增多)
(2)羟基数目相同的类醇,碳原子数越多。沸点越高。(相对分子
质量增大)
醇的溶解性变化规律:随碳原子的数目增多,醇的溶解性减小
1、取代反应
(2)
分子间脱水
(3)酯化反应
(4)HX反应:
(1)与活泼金属的反应(取代反应)
(五)、醇类化学性质:
2、消去反应(分子内脱水)
判断醇类发生消去反应的条件
醇分子结构中含有β-H(邻碳有氢)
卤代烃与醇都能发生消去反应,它们有什么异同点?
相同:
分子结构中都必须含有β-H
不同点:
官能团不同、反应条件不同、断键不同、产物不同
Weishan
an
High
School
3.氧化反应:
(1)燃烧:
(2)催化氧化:
条件:
Cu、Ag作催化剂同时加热
2CH3CH2OH
+
O2
2CH3CHO+2H2O
Cu或Ag
△
(3)强氧化剂氧化
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
(六)醇的命名
(2)编号位
(1)选主链
(3)写名称
选含—OH的最长碳链为主链.主链尽可能多的包含羟基或连接羟基的碳原子
从离—OH最近的一端起编号
取代基位置—
取代基名称
—
羟基位置—
母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)
资料卡片
CH2OH
苯甲醇
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或甘油、丙三醇)
CH3CHCH3
OH
2—丙醇
CH3—CH2—CH—CH3
OH
CH3—CH—C—OH
CH3
CH2—CH3
CH3
②
③
[练习]
写出下列醇的名称
CH3—CH—CH2—OH
CH3
①
2—甲基—1—丙醇
2—丁醇
2,3—二甲基—3—戊醇
(七)醇的同分异构体
醇类的同分异构体可有:
(1)碳链异构、
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
练习:
写出C4H10O
四、酚
(一).苯酚的物理性质
颜色
气味
状态
密度
溶解性
毒性
纯苯酚无色,露置在空气中因被氧化而显粉红色。
有特殊气味
常温下固态,熔点不高(43
℃),沸点
181.7℃
大于水,通常情况在水中为乳状
常温时苯酚在水中溶解度不大,高于
65℃时能与水混溶。易溶于乙醇、苯等
有毒,强腐
蚀性
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心,如果不慎沾到皮肤上,应立即用酒精洗涤。
O
H
或
C6H5O
H
结构式:
分子式:
结构简式:
(二)、苯酚的分子结构
C6H6O
比例模型
球棍模型
苯酚分子中除-OH上的H原子以外的所有原子都在同一平面上,且-OH上的H也可能出现在该平面
乙醇和苯酚中都有-OH,其性质是否相同?(结合甲烷与甲苯分别与高锰酸钾溶液混合的现象)预测-OH与苯环相连后使-OH的活泼性有何变化?
结合乙醇-OH和水中的H的活泼性比较,试用实验方法来比较乙醇和苯酚-OH上的H的活泼性?
(三).苯酚的化学性质
1、苯酚的酸性
澄清
浑浊
(三)、苯酚的化学性质
结论:
苯环对侧链(羟基)的影响导致酚羟基中的氧氢键易断,显酸性
石炭酸
苯氧离子
苯酚酸性强弱的探究
现象
原因或方程式
与盐酸反应
与CO2反应
与指示剂作用
Na2CO3反应
结论:
苯酚酸性极弱,不使指示剂变色
酸性:H2CO3
>
C6H5OH
>
HCO3-
:苯酚钠与CO2反应只生成HCO3-
酸性极弱
变浑浊
变浑浊
不变色
颜色变浅
2.苯酚与溴水的反应
实验3-4
(白色)
观察现象并思考实验中应注意问题
此反应很灵敏,常用于苯酚的定性检验和定量测定。
(取代反应)
实验中苯酚不能过量,否则产生的三溴苯酚易溶于苯酚而观察不到白色沉淀。
注意:
结论:
侧链(羟基)对苯环的影响导致苯环上与羟基邻、对位的氢原子活泼,易被取代
3.苯酚的显色反应
苯酚溶液
苯酚与溴水的反应很灵敏,常用于苯酚的定性检验和定量测定,也可利用苯酚的这一性质检验FeCl3。也常用FeCl3来检验酚羟基的存在(显色)。
FeCl3
紫色
实验与观察现象
Fe3+
紫色
溶液
苯酚、苯与溴取代反应的比较
比较
苯酚
苯
反应物
反应条件
取代氢原子数
反应速率
结论
浓溴水
液溴
不需要催化剂
Fe作催化剂
三个
一个
快
稍慢
苯酚与溴的取代反应比苯容易,
即-OH对苯环的影响:使苯环邻对位上的氢原子更活泼
4、氧化反应
具有强还原性
苯酚易被空气中的氧气氧化而呈粉红色
思考:苯酚能否使高锰酸钾酸性溶液褪色?
对-苯醌
苯酚溶液
高锰酸钾酸性溶液
褪色
结论:
苯酚能使高锰酸钾酸性溶液褪色
学与问P54
化合物的性质主要是由官能团决定的,但官能团所连接的烃基对官能团的性质也有一定的影响。苯酚分子中苯环上连有一羟基,由于羟基对苯环的影响,使得苯酚分子中苯环上的氢原子比苯分子中的氢原子更活泼,因此苯酚比苯更易发生取代反应。
当羟基所连接的烃基不同时,羟基的性质也不同。因此,苯酚分子中由于苯环对羟基的影响,使羟基中的氢原子性质较活泼,容易发生电离,因此显示弱酸性;而在乙醇分子中,由于乙基对羟基的影响使羟基上的氢原子反而不容易发生电离(比水还难电离),因此不显示酸性。
由此可见:不同的烃基与羟基相连,可以影响物质的化学性质。
(四)苯酚的用途
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
1、怎样分离苯酚和苯的混合物
加入NaOH溶液→分液→在苯酚钠溶液中加酸或通入CO2
2、如何鉴别苯酚
B
利用与浓溴水生成三溴苯酚白色沉淀
A
利用与三价铁离子的显色反应
巩固练习
2.下列各醇不能发生消去反应的是(
)
A.CH3OH
B.C2H5OH
C.(CH3)3C-OH
D.(CH3)3C-CH2-OH
AD
3.
有组成为CH4O和C3H8O的混合物,在一定条件下进行脱水反应,可能生成其它有机化合物的种数有(
)
A.5
B.6
C.7
D.8
A
已知乙醇的分子式是C2H6O,根据碳四价、氢一价的价键规则,它有两种可能的结构:
CH3CH2
OH
CH3
O
CH3
实验设计考虑
:
仪器、方法、药品、注意事项等
思考:
1、为什么要冷却后再读数?
2、为什么量筒中的导管要充满水且要插入水中?
3、请你回去再设计一种量气装置。
实验的操作如下:
1、从分液漏斗中逐滴把无水乙醇加入到烧瓶中,并控制反应速率,酒精加完后关闭活塞。
2、在广口瓶中加入适量的水。
3、待烧瓶冷却后对量筒读数。
4、把定量VmL无水乙醇完全倒入分液漏斗中。
5、检查装置的气密性。
6、将几小块钠(足量)放入烧瓶中。
正确的操作顺序是
。
5
6
4
2
1
3
或
5
2
6
4
1
3
若上述实验的数据是在标准状态下测定的,无水乙醇的密度为p
g/cm-3,充分反应后量筒内液面读数为a
mL,则一个
乙醇分子中能被置换的氢原子数为
。(用含a、V、p的式子表示)
n(H)=23
a
/5600
Vp
你知道吗?
日本利用蟹壳清除工业废水中有毒物质—苯酚
据报道,研究人员向含苯酚的工业废水中添加遇热凝固的脱乙酰壳多糖(从蟹壳中提炼)和少量能使苯酚变成苯酚类化合物的酶,然后将其加热到37至45摄氏度,脱乙酰壳多糖受热凝固并把苯酚类化合物和酶包裹其间。然后,滤去沉淀的脱乙酰壳多糖,并使其温度降到30摄氏度以下,这时脱乙酰壳多糖由固态变成液态,苯酚类化合物和酶从中分离。研究人员通过实验证实,按照这种方法处理过的工业废水中苯酚含量能达到环保要求。同时,脱乙酰壳多糖几乎可以100%回收再利用,酶也有70%左右能再利用。
【练习】
1、右面四种物质中:
①与氢氧化钠溶液发生反应的是[? ?
];
②与溴水发生取代反应的是[?? ?
];
B
D?
B
D
苯酚
溶液显紫色
乙醇
FeCl3
溶液
溶液无明显变化
氢氧化钠
有红褐色沉淀生成
硫氰化钾
溶液现血红色
2、有四种无色溶液,分别为苯酚、乙醇、氢氧化钠、硫氰化钾,请选用一种试剂,把它们区别开来。
先加入足量的烧碱溶液,然后再分液(上层即为苯)。
[练习]
如何除去混在苯中的苯酚?能不能采用先加入溴水再过滤的方法?
不能用溴水。因为虽然苯酚会和溴水反应生成的2,4,6—三溴苯酚难溶于水,但易溶于苯中而不易分离。再就是,从除杂彻底的角度来说,加溴水要过量,而过量的溴又混入了苯中。因此不能用溴水来除去苯中的苯酚
有关物质的结构比较
物质
官能团
结构特点
类别
脂肪醇
芳香醇
酚
CH3CH2OH
—OH
—OH
羟基与链烃基相连
羟基与芳烃
基侧链相连
羟基与苯环
直接相连
—OH
—CH2OH
—OH
