人教版高中化学选修四第二节 水的电离和溶液的酸碱性(30张PPT)
文档属性
| 名称 | 人教版高中化学选修四第二节 水的电离和溶液的酸碱性(30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 585.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-22 21:24:29 | ||
图片预览


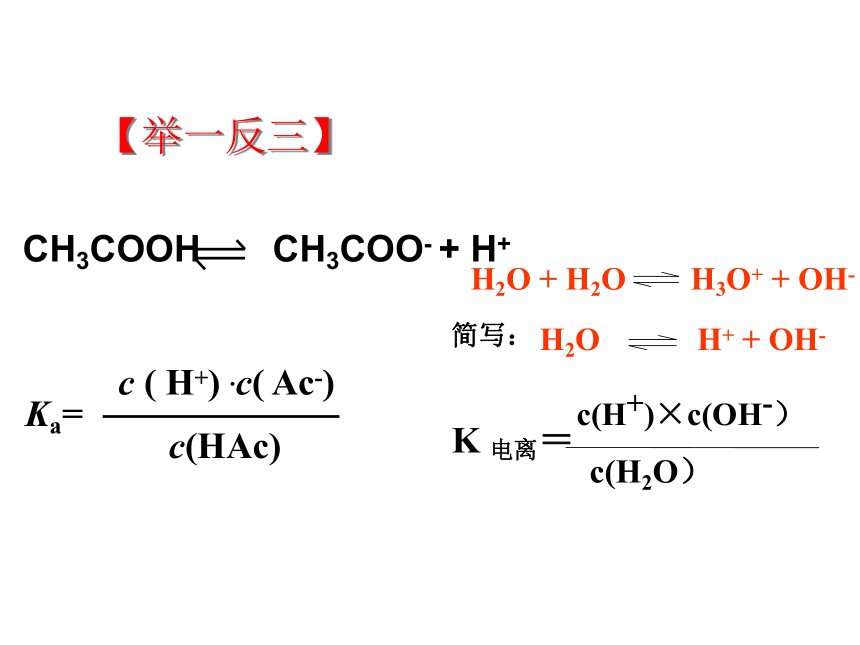


文档简介
(共31张PPT)
第二节
水的电离和溶液的酸碱性
下列化合物中,
①
NaCl②
NaOH
③
NH3·H2O
④
CH3COOH
⑤
H2SO4
⑥
AgCl
⑦
H2O
属于强电解质是
属于弱电解质是
①②⑤⑥
③④⑦
【温故知新】
【思考与交流】
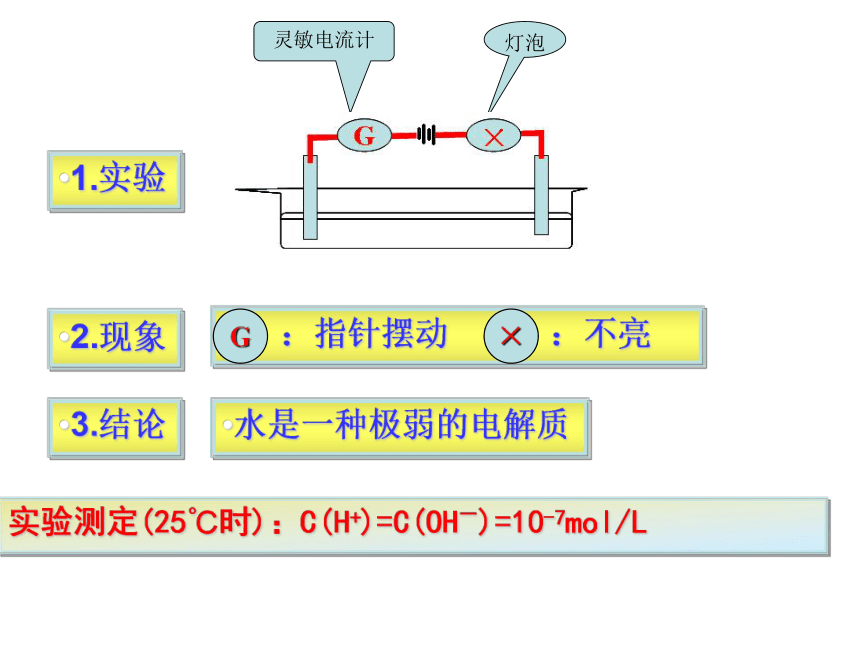
你能设计一个实验方案证明水是电解质吗?
1.实验
2.现象
:指针摆动
:不亮
G
×
3.结论
水是一种极弱的电解质
实验测定(25℃时):C(H+)=C(OH-)=10-7mol/L
灵敏电流计
灯泡
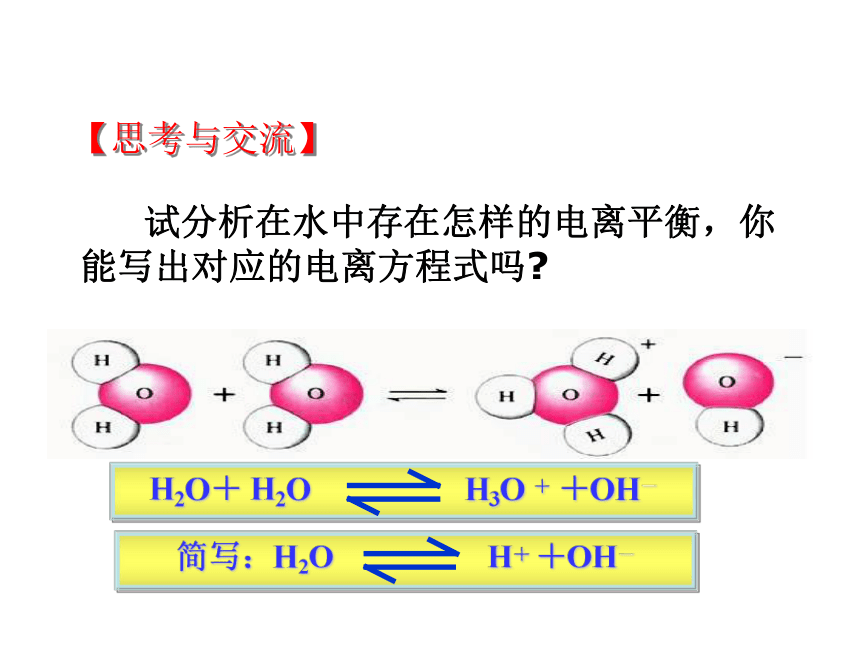
【思考与交流】
试分析在水中存在怎样的电离平衡,你能写出对应的电离方程式吗?
H2O+
H2O
H3O
+
+OH-
简写:H2O
H+
+OH-
(电离过程吸热)
H2O
H+
+
OH-
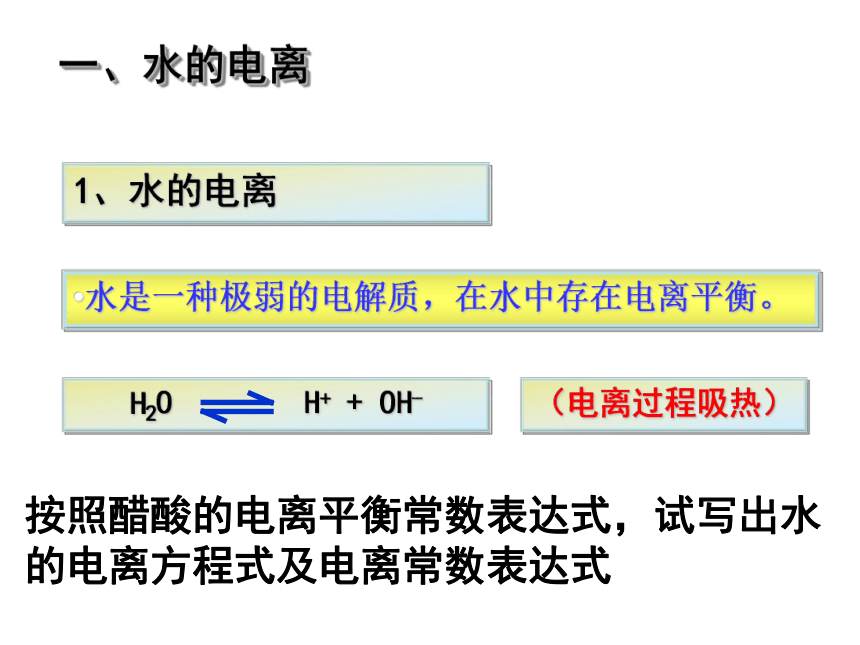
一、水的电离
1、水的电离
水是一种极弱的电解质,在水中存在电离平衡。
按照醋酸的电离平衡常数表达式,试写出水的电离方程式及电离常数表达式
H2O
+
H2O
H3O+
+
OH-
H2O
H+
+
OH-
简写:
K
电离=
c(H+)×c(OH-)
c(H2O)
Ka=
c
(
H+)
.c(
Ac-)
c(HAc)
CH3COOH
CH3COO-
+
H+
【举一反三】
因为水的电离其微弱,
c(H2O)可以视为常数,其中常数K电离与常数c(H2O)的积为一个新的常数,这个新的常数叫做水的离子积常数,简称水的离子积KW。
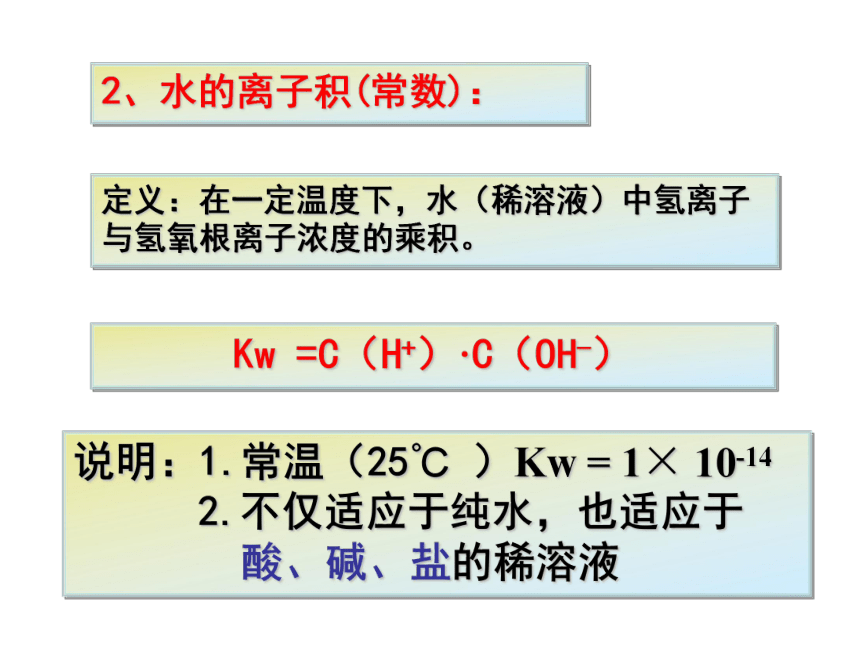
Kw
=C(H+)·C(OH-)
说明:1.常温(25℃
)Kw
=
1×
10-14
2.不仅适应于纯水,也适应于
酸、碱、盐的稀溶液
2、水的离子积(常数):
定义:在一定温度下,水(稀溶液)中氢离子与氢氧根离子浓度的乘积。
【思考与交流】
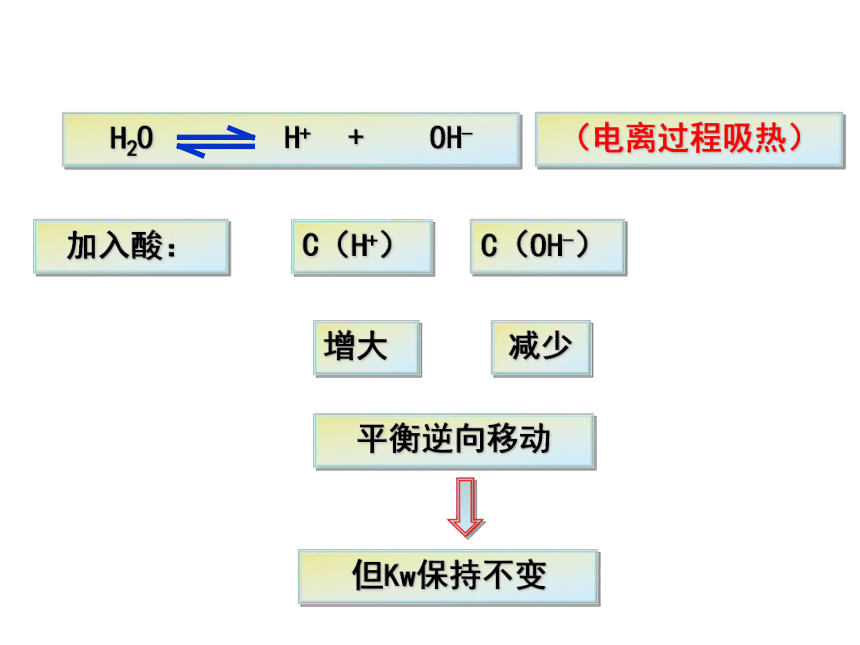
1、在水中加入盐酸后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
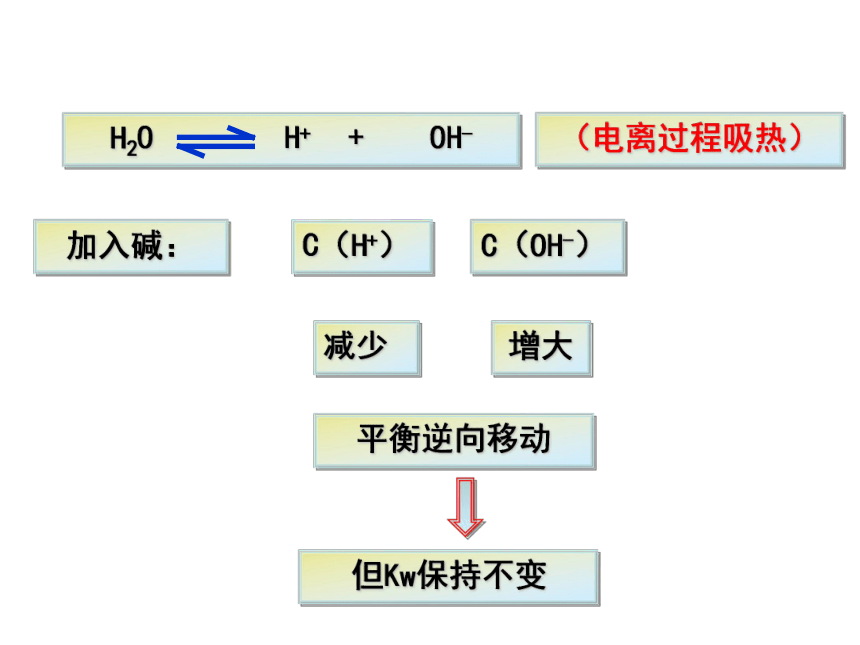
2、在水中加入碱(NaOH)后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
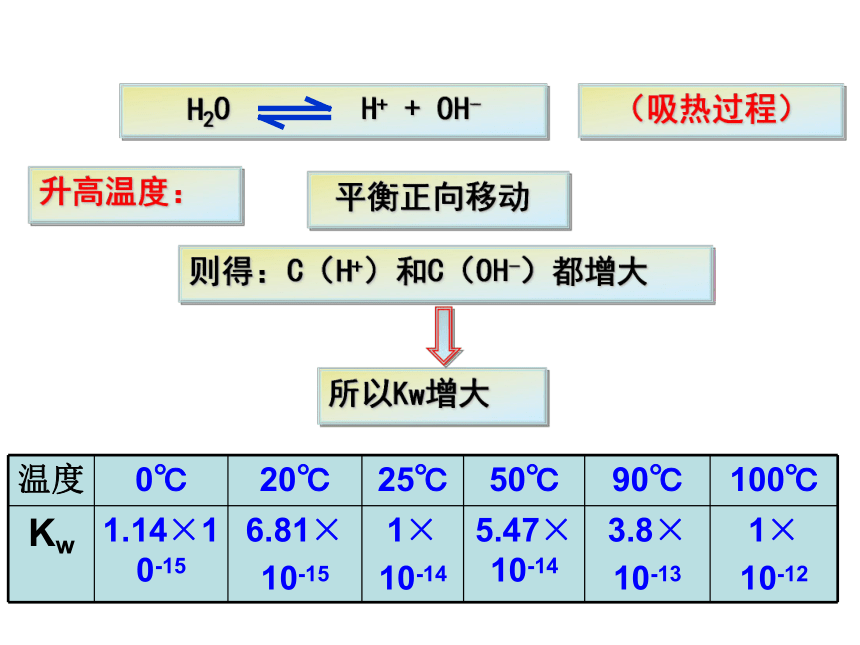
3、升高温度后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
加入酸:
增大
减少
平衡逆向移动
但Kw保持不变
(电离过程吸热)
H2O
H+
+
OH-
C(H+)
C(OH-)
加入碱:
减少
增大
平衡逆向移动
但Kw保持不变
(电离过程吸热)
H2O
H+
+
OH-
C(H+)
C(OH-)
升高温度:
平衡正向移动
则得:C(H+)和C(OH-)都增大
所以Kw增大
(吸热过程)
H2O
H+
+
OH-
温度
0℃
20℃
25℃
50℃
90℃
100℃
Kw
1.14×10-15
6.81×
10-15
1×
10-14
5.47×10-14
3.8×
10-13
1×
10-12
二、影响水的电离平衡的因素
1、酸
2、碱
3、温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大
对水电离平衡的影响
c(H+)
mol/L
c(OH-)
mol/L
c(H+)与
c(OH-)比较
溶液
酸碱性
纯水
HCl
NaOH
在常温下,在水溶液中酸碱性情况,完成下列表格
无
=10-7
=10-7
c(H+)=c(OH-)
中性
逆移
>10-7
<10-7
c(H+)>c(OH-)
酸性
逆移
<10-7
>10-7
c(H+)碱性
【分析与探究】
三、1、在常温下溶液的酸、碱性跟C(H+)、C(OH-)的关系
中性溶液:
酸性溶液:
碱性溶液:
注
意
③水溶液中H+与OH-始终共存,在稀溶液中Kw为常数
①酸性溶液:C(H+)>C(OH-)
;C(H+)越大酸性越强
②碱性溶液:C(H+);C(OH-)越大碱性越强
C(H+)=C(OH-)=1×10-7mol/L
C(H+)>C(OH-)
C(H+)>1×10-7mol/L
C(H+)C(H+)<1×10-7mol/L
④在水溶液中,水电离出的C(H+)=C(OH-)
2、溶液中C(H+)、C(OH-)的计算
例:计算下列溶液中C(H+)与C(OH-)
(1)1×10-3mol/LHCl溶液
(2)0.05mol/LBa(OH)2溶液
解:
C(H+)=
由Kw
=
C(H+)·
C(OH-),得
C(OH-)=
C(HCl)=1×10-3
mol/L
Kw
C(H+)
=
1×10-14
1×10-11
mol/l
=
1×10-3
mol/l
解:
C(0H-)=
由Kw
=
C(H+)·
C(OH-),得
C(H+)=
2C[Ba(OH)2]=0.1
mol/L
Kw
C(OH-)
=
1×10-14
1×10-13
mol/l
=
0.1mol/l
思考与收获:
在酸性溶液中:
Kw
=
C(H+)酸·
C(OH-)水
在碱性溶液中:
Kw
=
C(H+)水C(OH-)碱·
在溶液中水电离:
C(H+)水=
C(OH-)水
(2)常温下,浓度为1×10-5mol/l的NaOH溶液中,由水电离产生的C(OH-)是多少?
练习1.(1)常温下,浓度为1×10-5mol/l的盐酸溶液中,由水电离产生的C(OH-)
是多少?水电离产生的
C(H+)呢?
(1)解:C水(H+)=C水(OH-)
=
1×10-9
mol/l
1×10-14
1×10-5
=
Kw
C(H+)
=
(2)解:C水(OH-)=
C水(H+)
=
1×10-9
mol/l
1×10-14
1×10-5
=
C(OH-)
=
Kw
【学以致用】
mol/l
mol/l
D、BaCl2
C、NaHSO4
B、NaCl
A、NaOH
2、常温下,某溶液中由水电离产生的C(H+)=10-9
mol/l,则此溶液有可能是(
)
A
C
【课堂总结】
H2O
H+
+
OH-
一、水的电离
1、水的电离
Kw
=C(H+)·C(OH-)
2、水的离子积(常数):
二、影响水的电离平衡的因素
三、溶液的酸、碱性跟C(H+)、C(OH-)的关系
在常温下(25℃)
Kw
=1.0×10-14
c(OH-)
c(H+)
Kw=c(H+)?c(OH-)
pH
pH=-lg{c(H+)}
(碱性溶液)
(酸性溶液)
c(H+)
=
10-
PH
溶液pH的计算
pOH
pH=-lg{c(OH-)}
c(H+)
=
10-
POH
pH
+
pOH
=14
酸或碱浓度C
1.酸或碱溶液的pH
2.酸碱溶液的稀释前后pH的变化
(1)由于强酸或强碱在水中完全电离,加水稀释后不会有溶质进一步电离,故仅仅是体积增大的因素导致酸溶液中的CH+或碱溶液中的COH-减小.
规律:pH=a的強酸稀释10n倍,pH值增大n个单位,pH=
a+n
规律:pH=b的強碱稀释10n倍,pH值减小n个单位,pH=
b-
n
(2)弱酸或弱碱由于在水中不完全电离,加水稀释同时,能促使其分子进一步电离,故导致相应CH+或COH-减小的幅度降低.
pH值的变化比强酸或强碱小。
规律:pH=a弱酸稀释10n倍,pH值增大小于n个单位,pH<
a+n
规律:pH=b弱碱稀释10n倍,pH值减小小于n个单位,pH>
b-
n
思考
:pH=5的盐酸稀释1000倍,为何pH≠8?如何计算?
例.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是
①????
a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等。
A.①②
B.③④
C.①③
D.②④
A
3.溶液简单混合
(不发生反应,忽略混合时体积变化)
(1)若不等体积混合
:
①強酸与強酸混合
:先求
c(H+)总=
,再求pH.
c1V1+c2V2
V1+V2
②強碱与強碱混合
:先求
c(OH-)总=
,后求pOH,
再求pH.
c1V1+c2V2
V1+V2
(2)若等体积混合,且△pH≧2
:
①強酸与強酸混合
:
pH混
=
pH小
+
0.3
②強碱与強碱混合
:
pH混
=
pH大
_
0.3
4.强酸和强碱混合(发生中和反应,忽略体积变化)
可能情况有三种:
①若酸和碱恰好中和.即n(H+)=
n(OH-),
pH=7
②若酸过量,求出过量的c(H+),再求pH值
③若碱过量,求出过量的c(OH-),再求出c(H+)后求pH值
特例:若强酸与强碱等体积混合
:
①若pH酸+pH碱=14,则完全中和
pH=7.
②若pH酸+pH碱>14,
则碱过量
pH
>
7
③若pH酸+pH碱<14,
则酸过量
pH
<
7
5.酸与碱的pH之和为14,等体积混合
①若为强酸与强碱,则pH=7
②若为强酸与弱碱,则pH>7
③若为弱酸与强碱,则pH<7
例.在25℃时,若10体积某强酸溶液与1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸溶液的pH与该强碱溶液的pH之间应满足的关系是
。
酸与碱溶液的pH之和为15
范例:甲溶液pH=2,
乙溶液pH=12.
当两者等体积混和后,有关pH值变化的叙述正确的是
(
)
A.pH>7
B.pH=7
C.pH<7
D.前面三种情况都有可能
D
【例】
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0
B.9.5
C.10.5
D.11.0
C
例:pH=8和pH=10的两种NaOH溶液等体积混合,该混合溶液的pH值是多少?
例:将0.1mol/L的盐酸和0.04
mol/L氢氧化钡
溶液以等体积混合后,该溶液的pH是多少?
例:若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
(
)
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
B
练习.
25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va
<
Vb和a=0.5b。请填写下列空白:
(1)a值可否等于3(填“可”或“否”)
,其理由是
;
(2)
a值可否等于5(填“可”或“否”)
,其理由是
;
(3)a的取值范围是
。
否
若a=3,则b=6<7,溶液显酸性,与题意不符。故a≠3
否
若a=5,则b=10,恰好中和时:10-5×Va=
10-(14-10)×Vb,
Va/Vb=10>1,与题给条件Va
<
Vb矛盾,故
a≠5
3.5<
a
<14/3
第二节
水的电离和溶液的酸碱性
下列化合物中,
①
NaCl②
NaOH
③
NH3·H2O
④
CH3COOH
⑤
H2SO4
⑥
AgCl
⑦
H2O
属于强电解质是
属于弱电解质是
①②⑤⑥
③④⑦
【温故知新】
【思考与交流】
你能设计一个实验方案证明水是电解质吗?
1.实验
2.现象
:指针摆动
:不亮
G
×
3.结论
水是一种极弱的电解质
实验测定(25℃时):C(H+)=C(OH-)=10-7mol/L
灵敏电流计
灯泡
【思考与交流】
试分析在水中存在怎样的电离平衡,你能写出对应的电离方程式吗?
H2O+
H2O
H3O
+
+OH-
简写:H2O
H+
+OH-
(电离过程吸热)
H2O
H+
+
OH-
一、水的电离
1、水的电离
水是一种极弱的电解质,在水中存在电离平衡。
按照醋酸的电离平衡常数表达式,试写出水的电离方程式及电离常数表达式
H2O
+
H2O
H3O+
+
OH-
H2O
H+
+
OH-
简写:
K
电离=
c(H+)×c(OH-)
c(H2O)
Ka=
c
(
H+)
.c(
Ac-)
c(HAc)
CH3COOH
CH3COO-
+
H+
【举一反三】
因为水的电离其微弱,
c(H2O)可以视为常数,其中常数K电离与常数c(H2O)的积为一个新的常数,这个新的常数叫做水的离子积常数,简称水的离子积KW。
Kw
=C(H+)·C(OH-)
说明:1.常温(25℃
)Kw
=
1×
10-14
2.不仅适应于纯水,也适应于
酸、碱、盐的稀溶液
2、水的离子积(常数):
定义:在一定温度下,水(稀溶液)中氢离子与氢氧根离子浓度的乘积。
【思考与交流】
1、在水中加入盐酸后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
2、在水中加入碱(NaOH)后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
3、升高温度后,水中的C(H+)和C(OH-)会发生怎样的变化,水的离子积是否发生改变?
加入酸:
增大
减少
平衡逆向移动
但Kw保持不变
(电离过程吸热)
H2O
H+
+
OH-
C(H+)
C(OH-)
加入碱:
减少
增大
平衡逆向移动
但Kw保持不变
(电离过程吸热)
H2O
H+
+
OH-
C(H+)
C(OH-)
升高温度:
平衡正向移动
则得:C(H+)和C(OH-)都增大
所以Kw增大
(吸热过程)
H2O
H+
+
OH-
温度
0℃
20℃
25℃
50℃
90℃
100℃
Kw
1.14×10-15
6.81×
10-15
1×
10-14
5.47×10-14
3.8×
10-13
1×
10-12
二、影响水的电离平衡的因素
1、酸
2、碱
3、温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大
对水电离平衡的影响
c(H+)
mol/L
c(OH-)
mol/L
c(H+)与
c(OH-)比较
溶液
酸碱性
纯水
HCl
NaOH
在常温下,在水溶液中酸碱性情况,完成下列表格
无
=10-7
=10-7
c(H+)=c(OH-)
中性
逆移
>10-7
<10-7
c(H+)>c(OH-)
酸性
逆移
<10-7
>10-7
c(H+)
【分析与探究】
三、1、在常温下溶液的酸、碱性跟C(H+)、C(OH-)的关系
中性溶液:
酸性溶液:
碱性溶液:
注
意
③水溶液中H+与OH-始终共存,在稀溶液中Kw为常数
①酸性溶液:C(H+)>C(OH-)
;C(H+)越大酸性越强
②碱性溶液:C(H+)
C(H+)=C(OH-)=1×10-7mol/L
C(H+)>C(OH-)
C(H+)>1×10-7mol/L
C(H+)
④在水溶液中,水电离出的C(H+)=C(OH-)
2、溶液中C(H+)、C(OH-)的计算
例:计算下列溶液中C(H+)与C(OH-)
(1)1×10-3mol/LHCl溶液
(2)0.05mol/LBa(OH)2溶液
解:
C(H+)=
由Kw
=
C(H+)·
C(OH-),得
C(OH-)=
C(HCl)=1×10-3
mol/L
Kw
C(H+)
=
1×10-14
1×10-11
mol/l
=
1×10-3
mol/l
解:
C(0H-)=
由Kw
=
C(H+)·
C(OH-),得
C(H+)=
2C[Ba(OH)2]=0.1
mol/L
Kw
C(OH-)
=
1×10-14
1×10-13
mol/l
=
0.1mol/l
思考与收获:
在酸性溶液中:
Kw
=
C(H+)酸·
C(OH-)水
在碱性溶液中:
Kw
=
C(H+)水C(OH-)碱·
在溶液中水电离:
C(H+)水=
C(OH-)水
(2)常温下,浓度为1×10-5mol/l的NaOH溶液中,由水电离产生的C(OH-)是多少?
练习1.(1)常温下,浓度为1×10-5mol/l的盐酸溶液中,由水电离产生的C(OH-)
是多少?水电离产生的
C(H+)呢?
(1)解:C水(H+)=C水(OH-)
=
1×10-9
mol/l
1×10-14
1×10-5
=
Kw
C(H+)
=
(2)解:C水(OH-)=
C水(H+)
=
1×10-9
mol/l
1×10-14
1×10-5
=
C(OH-)
=
Kw
【学以致用】
mol/l
mol/l
D、BaCl2
C、NaHSO4
B、NaCl
A、NaOH
2、常温下,某溶液中由水电离产生的C(H+)=10-9
mol/l,则此溶液有可能是(
)
A
C
【课堂总结】
H2O
H+
+
OH-
一、水的电离
1、水的电离
Kw
=C(H+)·C(OH-)
2、水的离子积(常数):
二、影响水的电离平衡的因素
三、溶液的酸、碱性跟C(H+)、C(OH-)的关系
在常温下(25℃)
Kw
=1.0×10-14
c(OH-)
c(H+)
Kw=c(H+)?c(OH-)
pH
pH=-lg{c(H+)}
(碱性溶液)
(酸性溶液)
c(H+)
=
10-
PH
溶液pH的计算
pOH
pH=-lg{c(OH-)}
c(H+)
=
10-
POH
pH
+
pOH
=14
酸或碱浓度C
1.酸或碱溶液的pH
2.酸碱溶液的稀释前后pH的变化
(1)由于强酸或强碱在水中完全电离,加水稀释后不会有溶质进一步电离,故仅仅是体积增大的因素导致酸溶液中的CH+或碱溶液中的COH-减小.
规律:pH=a的強酸稀释10n倍,pH值增大n个单位,pH=
a+n
规律:pH=b的強碱稀释10n倍,pH值减小n个单位,pH=
b-
n
(2)弱酸或弱碱由于在水中不完全电离,加水稀释同时,能促使其分子进一步电离,故导致相应CH+或COH-减小的幅度降低.
pH值的变化比强酸或强碱小。
规律:pH=a弱酸稀释10n倍,pH值增大小于n个单位,pH<
a+n
规律:pH=b弱碱稀释10n倍,pH值减小小于n个单位,pH>
b-
n
思考
:pH=5的盐酸稀释1000倍,为何pH≠8?如何计算?
例.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是
①????
a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等。
A.①②
B.③④
C.①③
D.②④
A
3.溶液简单混合
(不发生反应,忽略混合时体积变化)
(1)若不等体积混合
:
①強酸与強酸混合
:先求
c(H+)总=
,再求pH.
c1V1+c2V2
V1+V2
②強碱与強碱混合
:先求
c(OH-)总=
,后求pOH,
再求pH.
c1V1+c2V2
V1+V2
(2)若等体积混合,且△pH≧2
:
①強酸与強酸混合
:
pH混
=
pH小
+
0.3
②強碱与強碱混合
:
pH混
=
pH大
_
0.3
4.强酸和强碱混合(发生中和反应,忽略体积变化)
可能情况有三种:
①若酸和碱恰好中和.即n(H+)=
n(OH-),
pH=7
②若酸过量,求出过量的c(H+),再求pH值
③若碱过量,求出过量的c(OH-),再求出c(H+)后求pH值
特例:若强酸与强碱等体积混合
:
①若pH酸+pH碱=14,则完全中和
pH=7.
②若pH酸+pH碱>14,
则碱过量
pH
>
7
③若pH酸+pH碱<14,
则酸过量
pH
<
7
5.酸与碱的pH之和为14,等体积混合
①若为强酸与强碱,则pH=7
②若为强酸与弱碱,则pH>7
③若为弱酸与强碱,则pH<7
例.在25℃时,若10体积某强酸溶液与1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸溶液的pH与该强碱溶液的pH之间应满足的关系是
。
酸与碱溶液的pH之和为15
范例:甲溶液pH=2,
乙溶液pH=12.
当两者等体积混和后,有关pH值变化的叙述正确的是
(
)
A.pH>7
B.pH=7
C.pH<7
D.前面三种情况都有可能
D
【例】
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0
B.9.5
C.10.5
D.11.0
C
例:pH=8和pH=10的两种NaOH溶液等体积混合,该混合溶液的pH值是多少?
例:将0.1mol/L的盐酸和0.04
mol/L氢氧化钡
溶液以等体积混合后,该溶液的pH是多少?
例:若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
(
)
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
B
练习.
25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va
<
Vb和a=0.5b。请填写下列空白:
(1)a值可否等于3(填“可”或“否”)
,其理由是
;
(2)
a值可否等于5(填“可”或“否”)
,其理由是
;
(3)a的取值范围是
。
否
若a=3,则b=6<7,溶液显酸性,与题意不符。故a≠3
否
若a=5,则b=10,恰好中和时:10-5×Va=
10-(14-10)×Vb,
Va/Vb=10>1,与题给条件Va
<
Vb矛盾,故
a≠5
3.5<
a
<14/3
