人教版选修5高中化学3.4-有机合成(69张PPT)
文档属性
| 名称 | 人教版选修5高中化学3.4-有机合成(69张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-22 00:00:00 | ||
图片预览











文档简介
(共69张PPT)
有机合成
化学选修五
第三章
烃的含氧衍生物
教学目标
1.
熟悉各类有机物的性质和相互转化关系;
2.
初步认识逆向合成法的思维方法。
学习重点:逆向合成法
神七宇航员翟志刚的太空漫步
宇航员的服装能使太空的人处于加压状态,供给宇航员生命所需的氧气,控制温度和湿度,防止辐射,还要经得起微流星的冲击。
宇航服中已经应用了一百三十多种新型材料。其中多数是有机合成材料。
密闭头盔由透明聚碳酸酯组成,密闭服由耐高温的防火聚酰胺纤维织物等特殊材料组成。宇航服面罩是由碳材料制成的金刚石膜。
有机合成
我们世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
有机合成
化学是一门创造性的学科,利用一百多种化学元素,以空气、水、煤、石油、矿物和生物等原料通过化学过程制取社会需要的各种物质。现在,化合物的种类几乎每几年翻上一番,目前已达3700多万种。
有机合成
一、有机合成的过程
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
1、有机合成的概念
2、有机合成的任务
有机合成的任务包括目标化合物分子骨架的构建和官能团的转化。
有机合成过程示意图
基础原料
辅助原料
副产物
副产物
中间体
中间体
辅助原料
辅助原料
目标化合物
3、有机合成的过程
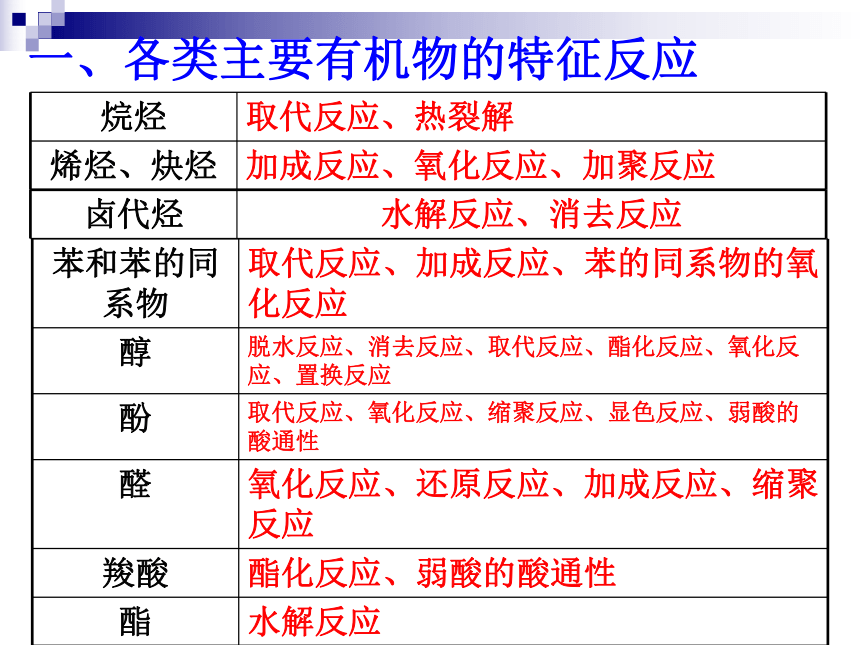
一、各类主要有机物的特征反应
卤代烃
水解反应、消去反应
烷烃
取代反应、热裂解
烯烃、炔烃
加成反应、氧化反应、加聚反应
苯和苯的同系物
取代反应、加成反应、苯的同系物的氧化反应
醇
脱水反应、消去反应、取代反应、酯化反应、氧化反应、置换反应
酚
取代反应、氧化反应、缩聚反应、显色反应、弱酸的酸通性
醛
氧化反应、还原反应、加成反应、缩聚反应
羧酸
酯化反应、弱酸的酸通性
酯
水解反应
卤代烃:
1、水解反应
2、消去反应
通式:
R-X
代表物:
C2H5-Br
主要化学性质
CnH2n+1-X
官能团:
-X
NaOH水溶液、加热
NaOH醇溶液、加热
邻碳有氢
醇
1、与钠反应
6、与HX取代反应
代表物:
C2H5-OH
主要化学性质
CnH2n+1-OH
官能团:
-OH
饱和一元醇通式:
CnH2n+2O
3、消去反应
2、分子间脱水
5、氧化反应
4、酯化反应
浓硫酸、加热
浓硫酸、加热
邻碳有氢
浓硫酸、加热
催化氧化、酸性高锰酸钾褪色
加热
酚
1、有弱酸性
通式:
代表物:
C6H5-OH
主要化学性质
CnH2n-6-O
官能团:
-OH
2、取代反应
3、显色反应
4、氧化反应
5、加成反应
羟基邻位和对位
羧酸
1、酸的通性
2、酯化反应
代表物:
CH3COOH
主要化学性质
CnH2nO2
官能团:
-COOH
饱和一元羧酸通式:
浓硫酸、加热
醛
1、加成反应
2、氧化反应
通式:
R-CHO
代表物:
CH3CHO
主要化学性质
CnH2nO
官能团:
-CHO
饱和一元醛通式:
又叫还原反应
酯
水解反应
通式:
R-COOR,
代表物:
CH3COOCH2CH3
主要化学性质
CnH2nO2
官能团:
-COO-C
饱和一元酯通式:
水解生成相应的酸和醇
二、有机物的几点特性:
1、能使酸性KMnO4褪色的有机物:
2、因化学反应能使溴水褪色的有机物:
3、互为类别异构的物质:
烯烃、炔烃、苯的同系物、
苯酚、
醇、醛、裂化汽油。
烯烃、炔烃、苯酚、醛
裂化汽油。
单烯烃与环烷烃(CnH2n)
二烯烃与炔烃、环烯烃(CnH2n-2)
醇与醚(CnH2n+2O)
苯酚与芳香醇、芳香醚
醛与酮(CnH2nO)
羧酸与酯、羟基醛(CnH2nO2)
氨基酸与硝基化合物(CnH2n+1NO2)
5、能发生银镜反应的有机物:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等。
4、实验中用到浓硫酸的反应及其作用:
实验室制乙烯——催化剂、脱水剂
硝化反应——催化剂、吸水剂
磺化反应——反应物、吸水剂
酯化反应——催化剂、吸水剂
6、能与新制Cu(OH)2反应的有机物:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖、羧酸
7、能与NaOH反应的有机物:
卤代烃、酯、羧酸、酚
三、有机反应类型
取代反应
加成反应
消去反应
聚合反应
氧化反应
还原反应
其它反应
1、烷烃与卤素的取代反应
1)取代反应
条件:纯卤素、光照
2、苯的卤代反应
条件:液溴、
催化剂
FeBr3
(一氯甲烷)
(1)
一Br
Br2
HBr
+
+
FeBr3
4、醇与氢卤酸
的反应
CH3CH2—OH
+H—Br
CH3CH2Br
+
H2O
△
3、苯酚与浓溴水的反应
(白色)
+
3HBr
+
3Br2
Br
Br—
Br
—
OH
OH
浓溴水
条件:浓硫酸、浓硝酸、55℃~60℃水浴
1、先加入顺序是先加浓硝酸,再加浓硫酸,冷却后再加苯。
2、浓硫酸起到催化剂和吸水剂的作用。
3、硝基苯无色有毒有苦杏仁味的油状液体,密度比水大。
4、温度计的位置,必须放在悬挂在水浴中。
5、硝化
苯的硝化
苯酚的硝化
甲苯的硝化
6、水解
条件:NaOH水溶液
C2H5-Br+NaOH
C2H5-OH+NaBr
水
△
卤代烃水解
CH3COOC2H5+H2O
CH3COOH+HOC2H5
稀硫酸
△
酯水解
条件:酸性水解或
碱性水解
C12H22O11
+
H2O
C6H12O6
+
C6H12O6
稀硫酸或酶
(蔗糖)
(葡萄糖)
(果糖)
水
浴
蛋白质水解
条件:酶或稀酸或碱
糖类水解
(C6H10O5)n
+n
H2O
nC6H12O6
稀硫酸或酶
淀粉
葡萄糖
加热
(C6H10O5)n
+n
H2O
nC6H12O6
浓硫酸
纤维素
葡萄糖
加热
在酸、碱、酶作用下最终水解为氨基酸
醇分子间脱水成醚
CH3CH2-OH+H-O-CH2CH3
CH3CH2-O-CH2CH3+H2O
浓H2SO4
140
℃
酯化反应
CH3C-OH+H—OC2H5
CH3C—OC2H5+H2O
18
O
O
浓硫酸
△
18
7、分子间脱水
氨基酸分子间反应
2.加成反应
有机物分子中双键(或三键)碳原子与其它原子或原子团直接结合生成新的化合物的反应叫做加成反应。
(1)C=C与H2、X2、HX、H2O:
(2)C≡C与H2、X2、HX、H2O:
(3)苯与H2
(4)醛、酮与氢气加成:
(5)油脂氢化:
羧基、酯基不能与H2加成
CH2=CH2
+
H2O
C2H5OH
催化剂、
加热、加压
O
CH3—C—H
+
H2
催化剂
△
CH3CH2OH
催化剂
△
+
3H2
3.消去反应
有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而生成不饱和(含双键或三键)化合物的反应,叫做消去反应。
(1)卤代烃消去HX
(2)醇消去H2O
CH2-CH2
CH2=
CH2↑+H2O
浓H2SO4
H
170℃
OH
4.聚合反应
加聚反应
不饱和单体间通过加成反应相互结合生成高分子化合物的反应
①单烯烃(包括它们的物生衍)式
如:制聚乙烯、聚氯乙烯、聚丙烯腈、
有机玻璃(
聚甲基丙烯酸甲酯
)等
②
共轭二烯烃(包括它们的物生衍)
单体的二个双键同时打开,形成含有一个新的双健的链节
③两种不同单体(包括它们的物生衍)
各自打开自已的双键,连结起来形成链节。
④单烯烃和共轭二烯烃
单烯烃打开双键,共轭二烯烃二个双键同时打开,形成一个新的双键后,再连接起耒形成链节。
加聚反应特点:
高分子化合物链节与单体的化学组成相同;
链节主链上的碳原子为不饱和碳原子,
n
CH2=CH2
-CH2-CH2-n
催化剂
C
C
R1
R2
R3
R4
C
C
R1
R2
R3
R4
[
]
n
n
催化剂
n
CH2=CH-CH=CH2
催化剂
、P
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2
—
[
]n
5.氧化反应
有机物加氧或去氢的反应
(1)醇的氧化:
(2)-CHO(醛、甲酸、甲酸酯、葡萄糖、麦芽糖)的氧化
2CH3-CH-O
+
O2
2CH3-C-H+2H2O
Cu/Ag
H
H
O
O
2CH3—C—H
+
O2
2
催化剂
△
O
CH3—C—OH
+2[Ag(NH3)2]OH
+
3NH3
+
2Ag↓+
H2O
水浴
O
CH3—C—H
O
CH3—C—ONH4
+
Cu2O
+
2H2O
CH3
C
O
OH
+2Cu(OH)2
CH3
C
O
H
(3)乙烯的催化氧化
(4)使酸性高锰酸钾溶液褪色:
乙烯、乙炔
、苯的同系物、乙醇、
苯酚、乙醛等
(5)有机物的燃烧
2CH2=CH2
+
O2
2CH3CHO
催化剂
6.还原反应
有机物加氢或去氧的反应
不饱和烃及不饱和化合物的加氢,
(1)C=C、C≡C加氢
(2)苯环加氢
(3)醛、酮的催化加氢
(4)油脂的氢化
7.其它反应
1.裂化(解)反应
①
甲烷的高温分解
②
石油的裂化
石油的裂解
2.显色反应
(1)苯酚与铁盐溶液络合呈紫色
(2)蛋白质与浓硝酸作用呈黄色
(3)单质碘遇淀粉变蓝
基础原料
中间体
2、有机合成的任务:
对目标化合物分子骨架的构建和官能团的转化。
目标化合物
中间体
辅助原料1
辅助原料2
辅助原料3
副产物
副产物
3、有机合成的设计思路
关键:
设计合成路线,即碳骨架的构建、官能团的引入和转化
。
二、有机合成遵循的原则
1、起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
2、尽量选择步骤最少的合成路线——以保证较高的产率。
3、满足“绿色化学”的要求。
4、操作简单、条件温和、能耗低、易实现
5、尊重客观事实,按一定顺序反应。
Ⅰ、官能团引入的方法:
1)、引入碳碳双键的三种方法:
;
;
。
卤代烃的消去
醇的消去
炔烃的不完全加成
2)、引入卤原子的三种方法:
;
;
。
醇(酚)的取代反应
烯(炔)烃的加成
烷烃(芳香烃)的取代
3)、引入羟基的四种方法:
;
;
;
。
烯烃与水的加成
卤代烃的水解
酯的水解
醛的还原
三、有机合成的方法
思考与交流:P65
(4)引入的-CHO的方法有:
醇的氧化和C=C的氧化
(5)引入-COOH的方法有:
醛的氧化、酯的水解、苯的同系物的氧化
6)引入─COOR:
酯化
7)引入高分子:
加聚
8)苯环上引入官能团:
实例:官能团的引入
①引入C=C双键
1)某些醇的消去引入C=C
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
2)卤代烃的消去引入C=C
3)炔烃加成引入C=C
CH≡CH
+
HBr
CH2=CHBr
催化剂
△
②引入卤原子(—X)
1)烃与X2取代
CH4
+Cl2
CH3Cl+
HCl
光照
2)不饱和烃与HX或X2加成
CH2==CH2+Br2
CH2BrCH2Br
3)醇与HX取代
C2H5OH
+
HBr
C2H5Br
+
H2O
△
催化剂
③引入羟基(—OH)
1)烯烃与水的加成
CH2==CH2
+H2O
CH3CH2OH
催化剂
加热加压
2)醛(酮)与氢气加成
CH3CHO
+H2
CH3CH2OH
催化剂
Δ
3)卤代烃的水解(碱性)
C2H5Br
+NaOH
C2H5OH
+
NaBr
水
△
4)酯的水解
稀H2SO4
CH3COOH+C2H5OH
CH3COOC2H5
+
H2O
△
(1)官能团种类变化:
CH3CH2-Br
水解
CH3CH2-OH
氧化
CH3-CHO
2、官能团的转化:
包括官能团种类变化、数目变化、位置变化等。
氧化
CH3-COOH
酯化
CH3-COOCH3
(2)官能团数目变化:
CH3CH2-Br
消去
CH2=CH2
加Br2
CH2Br-CH2Br
(3)官能团位置变化:
CH3CH2CH2-Br
消去
CH3CH=CH2
加HBr
CH3CH-CH3
Br
3、官能团的消除
(1)通过加成消除:C=C、C≡C、C=O
(2)通过消去或氧化或酯化或取代等消除:—OH
CH2=CH2
+H2
CH3CH3
催化剂
加热加压
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
(3)通过加成或氧化消除:—CHO
(4)通过消去反应或水解反应可消除:
—X
+
H2
CH3
CHO
CH3
CH2
OH
△
催化剂
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
三、有机合成常用解题方法
1.正向合成分析法
2.逆向合成分析法
1、正向合成分析法
此法采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间产物,逐步推向目标合成有机物。
基础原料
中间体
中间体
目标化合物
正向合成分析法示意图
2、逆向合成分析法
原料
中间体
中间体
产品
逆向合成分析法示意图
所确定的合成路线的各步反应,其反应条件必须比较温和,并具有较高的产率,所使用物基础原料和辅助原料应该是低毒性、低污染、易得和廉价的。
其思维程序可概括为:原料→中间产物→产品。
2
C2H5OH
C—OC2H5
C—OC2H5
O
O
C—OH
C—OH
O
O
+
以乙烯为原料合成草酸二乙酯的合成
H2C—OH
H2C—OH
H2C—Cl
H2C—Cl
CH2
CH2
C—H
C—H
O
O
在日常生活中,饮料、糖果中常常
添加一些有水果香味的酯类香料,例如具有苹果香味
的戊酸戊酯,你能利用1-戊烯为原料合成戊酸戊酯这
种香料吗?
戊酸戊酯
CH3(CH2)3C-O-CH2(CH2)3CH3
O
1-戊烯
CH2=CH-CH2CH2CH3
CH3(CH2)3C-O-CH2(CH2)3CH3
O
逆合成分析法
CH3CH2CH2CH2COOH
HO-CH2CH2CH2CH2CH3
+
CH3CH2CH2CH2CH2OH
CH3CH2CH2CH=CH2
CH3CH2CH2CH2CHO
目标化合物
中间体
中间体
基础原料
HO-H
练习:用2-丁烯、乙烯为原料设计的合成路线
NaOH
C2H5OH
1、逆合成分析:
+
NaOH
水
2、合成路线:
Br2
O2
Cu
O2
浓H2SO4
Br2
Br2
NaOH水
练习.已知乙烯在催化剂的作用下,可被氧化生成乙醛,试以乙烯,氧气,水为主要原料合成
思路:用正推法。
CH2=CH2
Br2
CH3—C—O—CH2—CH2—O—C—CH3
‖
‖
O
O
?
CH2Br—CH2Br
NaOH(H2O)
HOCH2CH2OH
CH2=CH2
O2
催化剂
CH3CHO
O2
CH3COOH
催化剂
}
浓H2SO4
CH3COOCH2
∣
CH3COOCH2
用石灰石、食盐、水、焦炭为原料,写出合成聚氯乙烯的化学方程式。
食盐水
H2、Cl2
HCl
石灰石
CaO
CaC2
C2H2
CH2=CHCl
-CH2-CH-n
Cl
(1)NaOH水溶液——发生卤代烃、酯类的水解反应、羧酸、苯酚的中和。
六、有机推断题的突破口
1.
应用反应中的特殊条件进行推断
(2)NaOH醇溶液,加热——发生卤代烃的
消去反应。
(5)O2/Cu(或Ag)——
醇的氧化反应。
(3)浓H2SO4,加热——发生醇消去、酯化、醇分之间脱水成醚、苯环的硝化反应、纤维素水解等。
(4)溴水——发生烯、炔的加成反应,酚的取代反应,醛的氧化反应。?
溴的CCl4溶液——发生烯、炔的加成反应。
(6)新制Cu(OH)
2悬浊液——醛类、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等醛基氧化成羧基、羧酸中和、多元醇与Cu(OH)2形成绛蓝色溶液?
(7)与银氨溶液发生银镜反应——
醛类、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等
(8)稀H2SO4——发生酯的水解,二糖、淀粉的水解。
(9)H2、催化剂——发生烯烃(或炔烃)的加成,芳香烃的加成,醛还原成醇的反应。
(1)使溴水褪色,则表示物质中可能含有“
”
或“
—
C≡C
—
”、醛基、苯酚。
(2)使KMnO4酸性溶液褪色,则该物质中可能含有
“
”、“—
C≡C—”、“—CHO”、含-OH的苯酚、醇;苯的
同系物。
(3)遇FeCl3溶液显紫色或加入溴水产生白色沉
淀,表示物质中含有酚羟基。
(4)加入新制Cu(OH)
2悬浊液并加热,有砖红色沉淀生成,或加入银氨溶液有银镜出现,说明该物质中
含有—
CHO。
2.
应用特征现象进行推断
(5)加入金属钠,有H2产生,表示物质可能有
—OH或
—
COOH。
(6)加入NaHCO3溶液有气体放出或能使紫色石蕊
试液变红,表示物质中含有—
COOH。
3.
应用特征产物推断碳架结构和官能团的位置
(1)若醇能被氧化成醛或羧酸,则醇分子中含
“—CH2OH”。若醇能被氧化成酮,则醇分子中含
“
CHOH”。
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由加氢后的碳架结构可确定“
”
或“—C≡
C—”的位置。
(4)由单一有机物发生酯化反应能生成环酯或高
聚酯,可确定该有机物是含羟基的羧酸,并根据酯
的结构,确定—
OH与—
COOH的相对位置。
4.
应用一些特殊的转化关系推断有机物的类型
(1)A
B
C,
此转化关系说明A为醇,B
为醛,C为羧酸。
(2)
A(CnH2nO2)
符合此转化关系的有机物A为酯,当酸作催化剂
时,产物是醇和羧酸,当碱作催化剂时,产物是醇和羧酸盐。
O2
O2
无机酸或碱
B
→
C
→
例:
1,4二氧六环
可以
通过下列方法制得:
烃A
B
C
1,4—二氧六环,则该烃A
为(
)
CH2
CH2
O
O
CH2
CH2
NaOH溶液
浓H2SO4
H2O
A.
乙炔
B.
1-丁烯
C.
1,3-丁二烯
D.
乙烯
Br2
D
3.要将
转化为
,
应选用的试剂是
(
)
A.
HCl
B.
H2SO4
COONa
OH
COONa
ONa
C.
CO2
,
H2O
D.
NaOH
C
[小结]
1、
有机物合成题解的关键是:
(1)选择出最佳合成方案,即最佳合成线路。
(2)熟练掌握各类有机物的结构(尤以所含的官能团)、性质、衍变关系,以及重要官能团的引入和消去等知识点。
2.合成的方法:逆推、顺推、层层剥离、推理等方法,可根据不同题意及已知条件选择不同方法。
3.思路:审题(分析)→找明、暗条件→找突破口(结构、性质特征)→综合分析、推导→结论
有机合成
化学选修五
第三章
烃的含氧衍生物
教学目标
1.
熟悉各类有机物的性质和相互转化关系;
2.
初步认识逆向合成法的思维方法。
学习重点:逆向合成法
神七宇航员翟志刚的太空漫步
宇航员的服装能使太空的人处于加压状态,供给宇航员生命所需的氧气,控制温度和湿度,防止辐射,还要经得起微流星的冲击。
宇航服中已经应用了一百三十多种新型材料。其中多数是有机合成材料。
密闭头盔由透明聚碳酸酯组成,密闭服由耐高温的防火聚酰胺纤维织物等特殊材料组成。宇航服面罩是由碳材料制成的金刚石膜。
有机合成
我们世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
有机合成
化学是一门创造性的学科,利用一百多种化学元素,以空气、水、煤、石油、矿物和生物等原料通过化学过程制取社会需要的各种物质。现在,化合物的种类几乎每几年翻上一番,目前已达3700多万种。
有机合成
一、有机合成的过程
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
1、有机合成的概念
2、有机合成的任务
有机合成的任务包括目标化合物分子骨架的构建和官能团的转化。
有机合成过程示意图
基础原料
辅助原料
副产物
副产物
中间体
中间体
辅助原料
辅助原料
目标化合物
3、有机合成的过程
一、各类主要有机物的特征反应
卤代烃
水解反应、消去反应
烷烃
取代反应、热裂解
烯烃、炔烃
加成反应、氧化反应、加聚反应
苯和苯的同系物
取代反应、加成反应、苯的同系物的氧化反应
醇
脱水反应、消去反应、取代反应、酯化反应、氧化反应、置换反应
酚
取代反应、氧化反应、缩聚反应、显色反应、弱酸的酸通性
醛
氧化反应、还原反应、加成反应、缩聚反应
羧酸
酯化反应、弱酸的酸通性
酯
水解反应
卤代烃:
1、水解反应
2、消去反应
通式:
R-X
代表物:
C2H5-Br
主要化学性质
CnH2n+1-X
官能团:
-X
NaOH水溶液、加热
NaOH醇溶液、加热
邻碳有氢
醇
1、与钠反应
6、与HX取代反应
代表物:
C2H5-OH
主要化学性质
CnH2n+1-OH
官能团:
-OH
饱和一元醇通式:
CnH2n+2O
3、消去反应
2、分子间脱水
5、氧化反应
4、酯化反应
浓硫酸、加热
浓硫酸、加热
邻碳有氢
浓硫酸、加热
催化氧化、酸性高锰酸钾褪色
加热
酚
1、有弱酸性
通式:
代表物:
C6H5-OH
主要化学性质
CnH2n-6-O
官能团:
-OH
2、取代反应
3、显色反应
4、氧化反应
5、加成反应
羟基邻位和对位
羧酸
1、酸的通性
2、酯化反应
代表物:
CH3COOH
主要化学性质
CnH2nO2
官能团:
-COOH
饱和一元羧酸通式:
浓硫酸、加热
醛
1、加成反应
2、氧化反应
通式:
R-CHO
代表物:
CH3CHO
主要化学性质
CnH2nO
官能团:
-CHO
饱和一元醛通式:
又叫还原反应
酯
水解反应
通式:
R-COOR,
代表物:
CH3COOCH2CH3
主要化学性质
CnH2nO2
官能团:
-COO-C
饱和一元酯通式:
水解生成相应的酸和醇
二、有机物的几点特性:
1、能使酸性KMnO4褪色的有机物:
2、因化学反应能使溴水褪色的有机物:
3、互为类别异构的物质:
烯烃、炔烃、苯的同系物、
苯酚、
醇、醛、裂化汽油。
烯烃、炔烃、苯酚、醛
裂化汽油。
单烯烃与环烷烃(CnH2n)
二烯烃与炔烃、环烯烃(CnH2n-2)
醇与醚(CnH2n+2O)
苯酚与芳香醇、芳香醚
醛与酮(CnH2nO)
羧酸与酯、羟基醛(CnH2nO2)
氨基酸与硝基化合物(CnH2n+1NO2)
5、能发生银镜反应的有机物:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等。
4、实验中用到浓硫酸的反应及其作用:
实验室制乙烯——催化剂、脱水剂
硝化反应——催化剂、吸水剂
磺化反应——反应物、吸水剂
酯化反应——催化剂、吸水剂
6、能与新制Cu(OH)2反应的有机物:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖、羧酸
7、能与NaOH反应的有机物:
卤代烃、酯、羧酸、酚
三、有机反应类型
取代反应
加成反应
消去反应
聚合反应
氧化反应
还原反应
其它反应
1、烷烃与卤素的取代反应
1)取代反应
条件:纯卤素、光照
2、苯的卤代反应
条件:液溴、
催化剂
FeBr3
(一氯甲烷)
(1)
一Br
Br2
HBr
+
+
FeBr3
4、醇与氢卤酸
的反应
CH3CH2—OH
+H—Br
CH3CH2Br
+
H2O
△
3、苯酚与浓溴水的反应
(白色)
+
3HBr
+
3Br2
Br
Br—
Br
—
OH
OH
浓溴水
条件:浓硫酸、浓硝酸、55℃~60℃水浴
1、先加入顺序是先加浓硝酸,再加浓硫酸,冷却后再加苯。
2、浓硫酸起到催化剂和吸水剂的作用。
3、硝基苯无色有毒有苦杏仁味的油状液体,密度比水大。
4、温度计的位置,必须放在悬挂在水浴中。
5、硝化
苯的硝化
苯酚的硝化
甲苯的硝化
6、水解
条件:NaOH水溶液
C2H5-Br+NaOH
C2H5-OH+NaBr
水
△
卤代烃水解
CH3COOC2H5+H2O
CH3COOH+HOC2H5
稀硫酸
△
酯水解
条件:酸性水解或
碱性水解
C12H22O11
+
H2O
C6H12O6
+
C6H12O6
稀硫酸或酶
(蔗糖)
(葡萄糖)
(果糖)
水
浴
蛋白质水解
条件:酶或稀酸或碱
糖类水解
(C6H10O5)n
+n
H2O
nC6H12O6
稀硫酸或酶
淀粉
葡萄糖
加热
(C6H10O5)n
+n
H2O
nC6H12O6
浓硫酸
纤维素
葡萄糖
加热
在酸、碱、酶作用下最终水解为氨基酸
醇分子间脱水成醚
CH3CH2-OH+H-O-CH2CH3
CH3CH2-O-CH2CH3+H2O
浓H2SO4
140
℃
酯化反应
CH3C-OH+H—OC2H5
CH3C—OC2H5+H2O
18
O
O
浓硫酸
△
18
7、分子间脱水
氨基酸分子间反应
2.加成反应
有机物分子中双键(或三键)碳原子与其它原子或原子团直接结合生成新的化合物的反应叫做加成反应。
(1)C=C与H2、X2、HX、H2O:
(2)C≡C与H2、X2、HX、H2O:
(3)苯与H2
(4)醛、酮与氢气加成:
(5)油脂氢化:
羧基、酯基不能与H2加成
CH2=CH2
+
H2O
C2H5OH
催化剂、
加热、加压
O
CH3—C—H
+
H2
催化剂
△
CH3CH2OH
催化剂
△
+
3H2
3.消去反应
有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而生成不饱和(含双键或三键)化合物的反应,叫做消去反应。
(1)卤代烃消去HX
(2)醇消去H2O
CH2-CH2
CH2=
CH2↑+H2O
浓H2SO4
H
170℃
OH
4.聚合反应
加聚反应
不饱和单体间通过加成反应相互结合生成高分子化合物的反应
①单烯烃(包括它们的物生衍)式
如:制聚乙烯、聚氯乙烯、聚丙烯腈、
有机玻璃(
聚甲基丙烯酸甲酯
)等
②
共轭二烯烃(包括它们的物生衍)
单体的二个双键同时打开,形成含有一个新的双健的链节
③两种不同单体(包括它们的物生衍)
各自打开自已的双键,连结起来形成链节。
④单烯烃和共轭二烯烃
单烯烃打开双键,共轭二烯烃二个双键同时打开,形成一个新的双键后,再连接起耒形成链节。
加聚反应特点:
高分子化合物链节与单体的化学组成相同;
链节主链上的碳原子为不饱和碳原子,
n
CH2=CH2
-CH2-CH2-n
催化剂
C
C
R1
R2
R3
R4
C
C
R1
R2
R3
R4
[
]
n
n
催化剂
n
CH2=CH-CH=CH2
催化剂
、P
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2
—
[
]n
5.氧化反应
有机物加氧或去氢的反应
(1)醇的氧化:
(2)-CHO(醛、甲酸、甲酸酯、葡萄糖、麦芽糖)的氧化
2CH3-CH-O
+
O2
2CH3-C-H+2H2O
Cu/Ag
H
H
O
O
2CH3—C—H
+
O2
2
催化剂
△
O
CH3—C—OH
+2[Ag(NH3)2]OH
+
3NH3
+
2Ag↓+
H2O
水浴
O
CH3—C—H
O
CH3—C—ONH4
+
Cu2O
+
2H2O
CH3
C
O
OH
+2Cu(OH)2
CH3
C
O
H
(3)乙烯的催化氧化
(4)使酸性高锰酸钾溶液褪色:
乙烯、乙炔
、苯的同系物、乙醇、
苯酚、乙醛等
(5)有机物的燃烧
2CH2=CH2
+
O2
2CH3CHO
催化剂
6.还原反应
有机物加氢或去氧的反应
不饱和烃及不饱和化合物的加氢,
(1)C=C、C≡C加氢
(2)苯环加氢
(3)醛、酮的催化加氢
(4)油脂的氢化
7.其它反应
1.裂化(解)反应
①
甲烷的高温分解
②
石油的裂化
石油的裂解
2.显色反应
(1)苯酚与铁盐溶液络合呈紫色
(2)蛋白质与浓硝酸作用呈黄色
(3)单质碘遇淀粉变蓝
基础原料
中间体
2、有机合成的任务:
对目标化合物分子骨架的构建和官能团的转化。
目标化合物
中间体
辅助原料1
辅助原料2
辅助原料3
副产物
副产物
3、有机合成的设计思路
关键:
设计合成路线,即碳骨架的构建、官能团的引入和转化
。
二、有机合成遵循的原则
1、起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
2、尽量选择步骤最少的合成路线——以保证较高的产率。
3、满足“绿色化学”的要求。
4、操作简单、条件温和、能耗低、易实现
5、尊重客观事实,按一定顺序反应。
Ⅰ、官能团引入的方法:
1)、引入碳碳双键的三种方法:
;
;
。
卤代烃的消去
醇的消去
炔烃的不完全加成
2)、引入卤原子的三种方法:
;
;
。
醇(酚)的取代反应
烯(炔)烃的加成
烷烃(芳香烃)的取代
3)、引入羟基的四种方法:
;
;
;
。
烯烃与水的加成
卤代烃的水解
酯的水解
醛的还原
三、有机合成的方法
思考与交流:P65
(4)引入的-CHO的方法有:
醇的氧化和C=C的氧化
(5)引入-COOH的方法有:
醛的氧化、酯的水解、苯的同系物的氧化
6)引入─COOR:
酯化
7)引入高分子:
加聚
8)苯环上引入官能团:
实例:官能团的引入
①引入C=C双键
1)某些醇的消去引入C=C
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
2)卤代烃的消去引入C=C
3)炔烃加成引入C=C
CH≡CH
+
HBr
CH2=CHBr
催化剂
△
②引入卤原子(—X)
1)烃与X2取代
CH4
+Cl2
CH3Cl+
HCl
光照
2)不饱和烃与HX或X2加成
CH2==CH2+Br2
CH2BrCH2Br
3)醇与HX取代
C2H5OH
+
HBr
C2H5Br
+
H2O
△
催化剂
③引入羟基(—OH)
1)烯烃与水的加成
CH2==CH2
+H2O
CH3CH2OH
催化剂
加热加压
2)醛(酮)与氢气加成
CH3CHO
+H2
CH3CH2OH
催化剂
Δ
3)卤代烃的水解(碱性)
C2H5Br
+NaOH
C2H5OH
+
NaBr
水
△
4)酯的水解
稀H2SO4
CH3COOH+C2H5OH
CH3COOC2H5
+
H2O
△
(1)官能团种类变化:
CH3CH2-Br
水解
CH3CH2-OH
氧化
CH3-CHO
2、官能团的转化:
包括官能团种类变化、数目变化、位置变化等。
氧化
CH3-COOH
酯化
CH3-COOCH3
(2)官能团数目变化:
CH3CH2-Br
消去
CH2=CH2
加Br2
CH2Br-CH2Br
(3)官能团位置变化:
CH3CH2CH2-Br
消去
CH3CH=CH2
加HBr
CH3CH-CH3
Br
3、官能团的消除
(1)通过加成消除:C=C、C≡C、C=O
(2)通过消去或氧化或酯化或取代等消除:—OH
CH2=CH2
+H2
CH3CH3
催化剂
加热加压
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
(3)通过加成或氧化消除:—CHO
(4)通过消去反应或水解反应可消除:
—X
+
H2
CH3
CHO
CH3
CH2
OH
△
催化剂
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
三、有机合成常用解题方法
1.正向合成分析法
2.逆向合成分析法
1、正向合成分析法
此法采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间产物,逐步推向目标合成有机物。
基础原料
中间体
中间体
目标化合物
正向合成分析法示意图
2、逆向合成分析法
原料
中间体
中间体
产品
逆向合成分析法示意图
所确定的合成路线的各步反应,其反应条件必须比较温和,并具有较高的产率,所使用物基础原料和辅助原料应该是低毒性、低污染、易得和廉价的。
其思维程序可概括为:原料→中间产物→产品。
2
C2H5OH
C—OC2H5
C—OC2H5
O
O
C—OH
C—OH
O
O
+
以乙烯为原料合成草酸二乙酯的合成
H2C—OH
H2C—OH
H2C—Cl
H2C—Cl
CH2
CH2
C—H
C—H
O
O
在日常生活中,饮料、糖果中常常
添加一些有水果香味的酯类香料,例如具有苹果香味
的戊酸戊酯,你能利用1-戊烯为原料合成戊酸戊酯这
种香料吗?
戊酸戊酯
CH3(CH2)3C-O-CH2(CH2)3CH3
O
1-戊烯
CH2=CH-CH2CH2CH3
CH3(CH2)3C-O-CH2(CH2)3CH3
O
逆合成分析法
CH3CH2CH2CH2COOH
HO-CH2CH2CH2CH2CH3
+
CH3CH2CH2CH2CH2OH
CH3CH2CH2CH=CH2
CH3CH2CH2CH2CHO
目标化合物
中间体
中间体
基础原料
HO-H
练习:用2-丁烯、乙烯为原料设计的合成路线
NaOH
C2H5OH
1、逆合成分析:
+
NaOH
水
2、合成路线:
Br2
O2
Cu
O2
浓H2SO4
Br2
Br2
NaOH水
练习.已知乙烯在催化剂的作用下,可被氧化生成乙醛,试以乙烯,氧气,水为主要原料合成
思路:用正推法。
CH2=CH2
Br2
CH3—C—O—CH2—CH2—O—C—CH3
‖
‖
O
O
?
CH2Br—CH2Br
NaOH(H2O)
HOCH2CH2OH
CH2=CH2
O2
催化剂
CH3CHO
O2
CH3COOH
催化剂
}
浓H2SO4
CH3COOCH2
∣
CH3COOCH2
用石灰石、食盐、水、焦炭为原料,写出合成聚氯乙烯的化学方程式。
食盐水
H2、Cl2
HCl
石灰石
CaO
CaC2
C2H2
CH2=CHCl
-CH2-CH-n
Cl
(1)NaOH水溶液——发生卤代烃、酯类的水解反应、羧酸、苯酚的中和。
六、有机推断题的突破口
1.
应用反应中的特殊条件进行推断
(2)NaOH醇溶液,加热——发生卤代烃的
消去反应。
(5)O2/Cu(或Ag)——
醇的氧化反应。
(3)浓H2SO4,加热——发生醇消去、酯化、醇分之间脱水成醚、苯环的硝化反应、纤维素水解等。
(4)溴水——发生烯、炔的加成反应,酚的取代反应,醛的氧化反应。?
溴的CCl4溶液——发生烯、炔的加成反应。
(6)新制Cu(OH)
2悬浊液——醛类、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等醛基氧化成羧基、羧酸中和、多元醇与Cu(OH)2形成绛蓝色溶液?
(7)与银氨溶液发生银镜反应——
醛类、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等
(8)稀H2SO4——发生酯的水解,二糖、淀粉的水解。
(9)H2、催化剂——发生烯烃(或炔烃)的加成,芳香烃的加成,醛还原成醇的反应。
(1)使溴水褪色,则表示物质中可能含有“
”
或“
—
C≡C
—
”、醛基、苯酚。
(2)使KMnO4酸性溶液褪色,则该物质中可能含有
“
”、“—
C≡C—”、“—CHO”、含-OH的苯酚、醇;苯的
同系物。
(3)遇FeCl3溶液显紫色或加入溴水产生白色沉
淀,表示物质中含有酚羟基。
(4)加入新制Cu(OH)
2悬浊液并加热,有砖红色沉淀生成,或加入银氨溶液有银镜出现,说明该物质中
含有—
CHO。
2.
应用特征现象进行推断
(5)加入金属钠,有H2产生,表示物质可能有
—OH或
—
COOH。
(6)加入NaHCO3溶液有气体放出或能使紫色石蕊
试液变红,表示物质中含有—
COOH。
3.
应用特征产物推断碳架结构和官能团的位置
(1)若醇能被氧化成醛或羧酸,则醇分子中含
“—CH2OH”。若醇能被氧化成酮,则醇分子中含
“
CHOH”。
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由加氢后的碳架结构可确定“
”
或“—C≡
C—”的位置。
(4)由单一有机物发生酯化反应能生成环酯或高
聚酯,可确定该有机物是含羟基的羧酸,并根据酯
的结构,确定—
OH与—
COOH的相对位置。
4.
应用一些特殊的转化关系推断有机物的类型
(1)A
B
C,
此转化关系说明A为醇,B
为醛,C为羧酸。
(2)
A(CnH2nO2)
符合此转化关系的有机物A为酯,当酸作催化剂
时,产物是醇和羧酸,当碱作催化剂时,产物是醇和羧酸盐。
O2
O2
无机酸或碱
B
→
C
→
例:
1,4二氧六环
可以
通过下列方法制得:
烃A
B
C
1,4—二氧六环,则该烃A
为(
)
CH2
CH2
O
O
CH2
CH2
NaOH溶液
浓H2SO4
H2O
A.
乙炔
B.
1-丁烯
C.
1,3-丁二烯
D.
乙烯
Br2
D
3.要将
转化为
,
应选用的试剂是
(
)
A.
HCl
B.
H2SO4
COONa
OH
COONa
ONa
C.
CO2
,
H2O
D.
NaOH
C
[小结]
1、
有机物合成题解的关键是:
(1)选择出最佳合成方案,即最佳合成线路。
(2)熟练掌握各类有机物的结构(尤以所含的官能团)、性质、衍变关系,以及重要官能团的引入和消去等知识点。
2.合成的方法:逆推、顺推、层层剥离、推理等方法,可根据不同题意及已知条件选择不同方法。
3.思路:审题(分析)→找明、暗条件→找突破口(结构、性质特征)→综合分析、推导→结论
