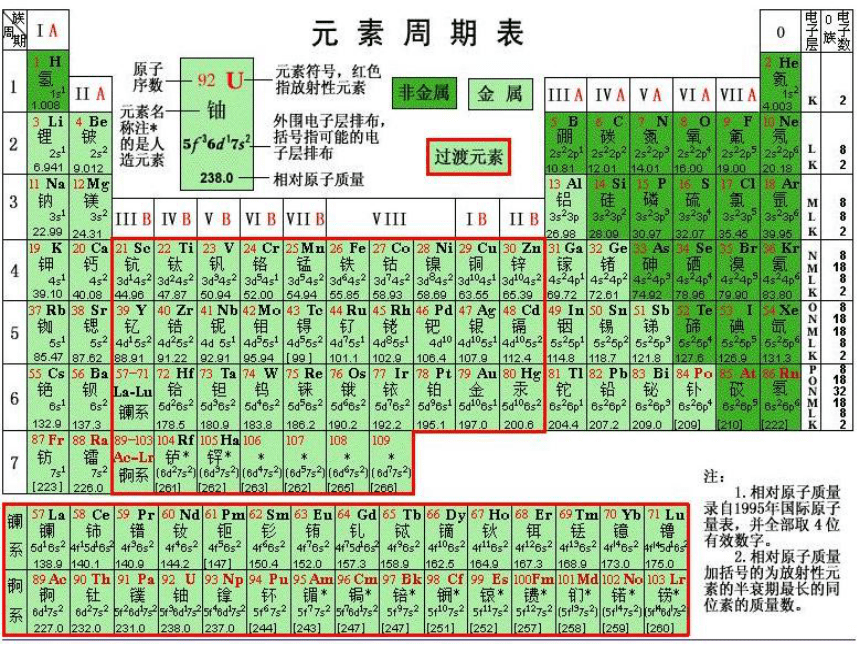
鲁科版高中必修1化学2.1《元素与物质的分类》课件(52张PPT)
文档属性
| 名称 | 鲁科版高中必修1化学2.1《元素与物质的分类》课件(52张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-23 00:00:00 | ||
图片预览








文档简介
(共52张PPT)
第
2
章
元素与物质世界
第
1
节
元素与物质的分类
盛世佳和购物广场
元素与物质的关系
问题探究
一
(1)110多种元素是如何构成几千万种物
质的?
(2)为了更好地研究物质的性质和用途,
应怎样对物质进行分类?
用什么样
的标准分类?
(3)各类物质之间具有怎样的关系?
问题1:找出组成元素;这些元素还能重新组合成哪些物质?
(1)若只由一种元素组成,请写出其化学式。这一类物质属于单质还是属于化合物?
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
镁、铜、钠、氧、氯、氢、硫、碳
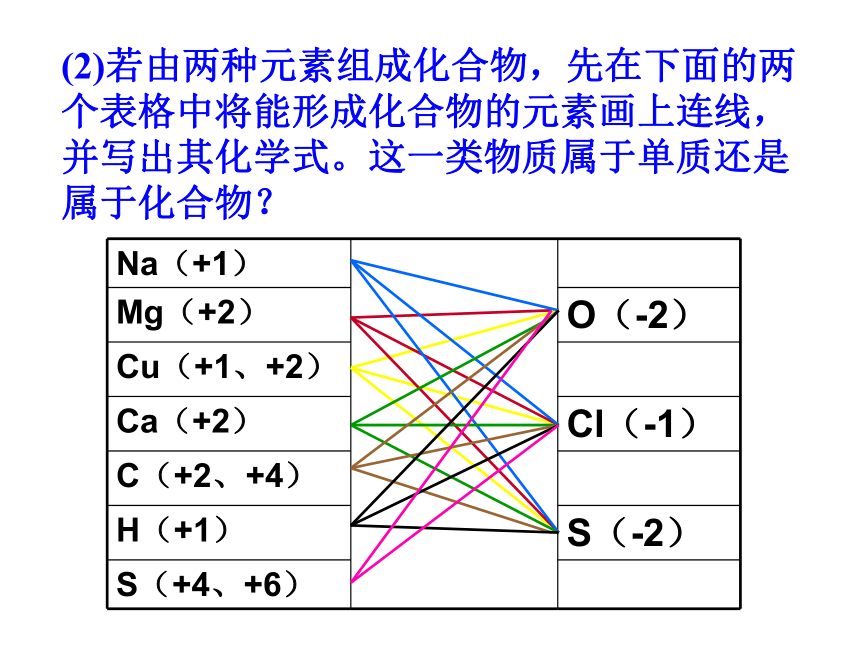
(2)若由两种元素组成化合物,先在下面的两个表格中将能形成化合物的元素画上连线,并写出其化学式。这一类物质属于单质还是属于化合物?
Na(+1)
Mg(+2)
O(-2)
Cu(+1、+2)
Ca(+2)
Cl(-1)
C(+2、+4)
H(+1)
S(-2)
S(+4、+6)
(3)若由三种元素组成化合物,请写出其化学式。
NaClO
Na2SO4
Na2SO3
Na2CO3
NaOH
MgSO4
MgSO3
MgCO
3
Mg(OH)2
CuSO4
CuCO
3
Cu(OH)
2
Ca(ClO)
2
CaSO4
CaCO
3
Ca(OH)
2
化合物:
由两种或两种以上的元素组成的
纯净物。
化合态:元素以化合物的形式存在的状态。
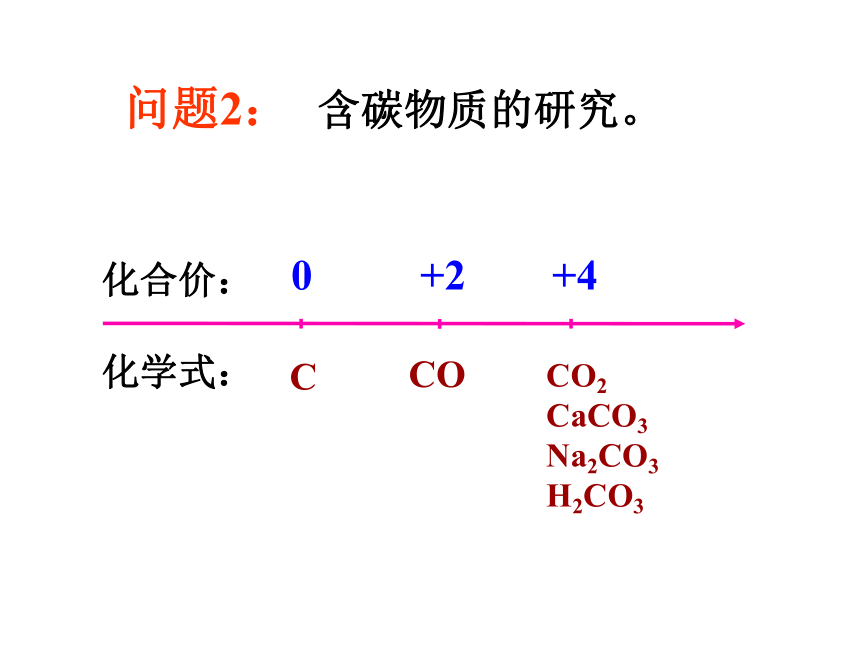
问题2:
含碳物质的研究。
CO2
CaCO3
Na2CO3
H2CO3
C
CO
0
+2
+4
化合价:
化学式:
以上讨论对你认识元素与物质的关系有什么启发?
⑴元素是物质的基本组成成分,物质都是由元素组成的;
⑵每一种元素可以自身组成物质—单质;
⑶一种元素不仅可以与其它种类元素组成化合物,而且相同的元素也可组成不同的化合物;
⑷由于元素可以按照一定的规律以不同的种类和不同的方式进行组合,
因而110多种元素能够构成庞大繁杂的物质世界。
⑴元素按存在形态分为_______和________;有的元素只有一种单质,有的有两种或两种以上的单质,单质、化合物还可以按不同的标准分类。
⑵同一种化合物按组成的元素、存在形态、离解情况等可从不同角度分类。
游离态
化合态
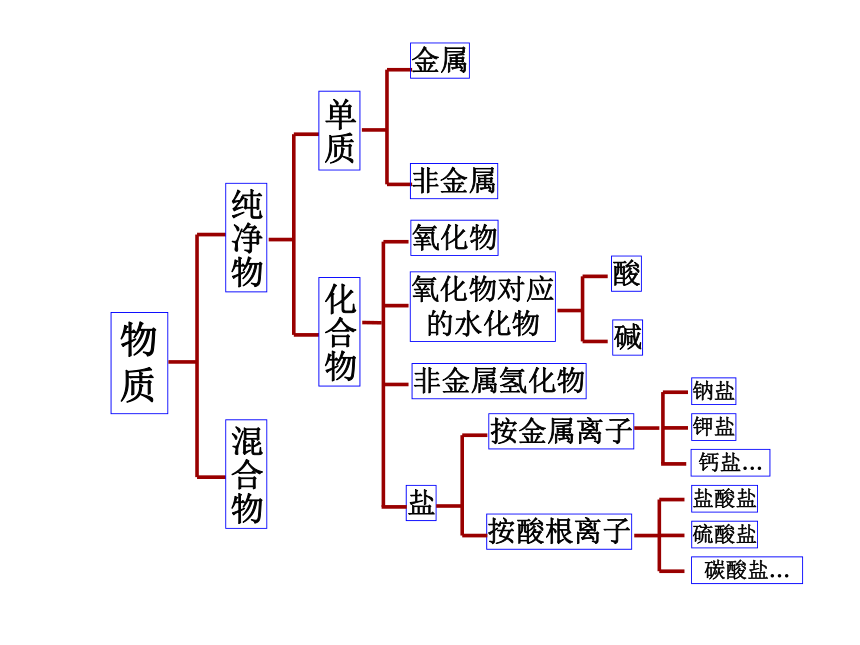
物
质
纯净物
混合物
单质
化合物
金属
非金属
氧化物
氧化物对应
的水化物
非金属氢化物
盐
按金属离子
按酸根离子
酸
碱
钠盐
钾盐
钙盐…
盐酸盐
硫酸盐
碳酸盐…
硫
元
素
硫单质
(游离态)
化合物
(化合态)
S2、S4、S6、S8
…
盐
氧化物
…
SO2、SO3
氧化物对应
的水化物
…
H2SO3、H2SO4
硫酸盐
…
Na2SO4
硫化物
…
Na2S
亚硫酸盐
…
Na2SO3
硫家族
氢化物
H2S
…
物质的分类
问题探究
二
五
彩
缤
纷
的
铜
世
界
绿色
蓝色
Cu(OH)2
Cu2(OH)2CO3
CuSO4
CuO
化
合
物
氧化物
盐
碱
蓝色
白色
黑色
CuSO4·5H2O
Cu2O
红色
紫红色
Cu
单质
根据化合物的性质
在水溶液中或熔化状态下是否导电
〖问题1〗物质分类的方法
物质是否由同一种分子组成
物质
纯净物
混合物
单质
化合物
酸、碱、盐
、氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
?
?
?
?
?
氧
化
物
酸性氧化物
碱性氧化物
(其它氧化物)
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
CO、H2O、Na2O2
从组成元素分
非金属氧化物
金属氧化物
从性质
物质的分类(氧化物)
单质:
Fe、
木炭、氧气
氧化物:
CaO、
CuO
酸(稀):
HCl、
H2SO4
碱溶液:NaOH、Ca(OH)2
盐溶液:NaCl、
Na2SO4
、AgNO3、
CuSO4
、
CaCO3
指示剂:
石蕊试液
根据提供的试剂,
探究单质、氧化物、酸、碱和盐之间发生的反应:
〖问题2〗
单质、氧化物、酸、碱、盐之间的关系
【预测1】
金属
酸
盐
非金属单质
碱性
氧化物
【预测2】
酸
酸性
氧化物
水
酸性
氧化物
【预测3】
碱
碱性
氧化物
水
【预测4】
酸
碱
盐
金属
碱性
氧化物
指示剂
碱
酸
盐
非金属
酸性
氧化物
指示剂
【预测5】
盐
酸
盐
金属
碱
【预测6】
反应关系
实验现象
结论
酸能使石蕊试液变色
Fe+2HCl=FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl
=
NaCl
+
H2O
AgNO3+HCl=AgCl↓
+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊
试液变红
无色气体
黑色氧化铜解
溶液变蓝色
白色沉淀
试管发热
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别:酸
石蕊试液
金属铁
氧化铜
NaOH
AgNO3
稀盐酸
反应关系
实验现象
结论
碱能使石蕊试液变色
Cl2+2NaOH=NaCl+NaClO+H2O
碱能跟某些金属单质反应
CO2+
2NaOH
=Na2CO3+H2O
2NaOH+H2SO4
=
Na2SO4
+
H2O
2NaOH
+
CuSO4
=Cu(OH)
2
↓
+Na2SO4
碱能跟酸性氧化物反应
碱能跟酸发生反应
碱能跟某些盐发生反应
无色酚酞
试液变红
黄绿色
消失
无明显现象
蓝色沉淀
试管发热
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
金属
碱性氧化物
碱
非金属
酸性氧化物
酸
盐
用简图表示单质、氧化物、酸、碱、盐之间的转化关系
给物质分类有何意义?
☆认识一类物质
☆制备物质
☆鉴别物质
☆提纯物质
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl
KCl
NaClO
MgCl2
B.HClO3
KClO3
Cl2
NaClO3
C.H3PO4
H4SiO4
HCl
H2SO4
D.铜
金
铂
钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价
其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
2.今有下列三种物质,每组中都有一种物质跟其他三
种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。
三组物质分别为:
(1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、P2O5。
组
别
被选出的物质
分类依据
第(1)组
第(2)组
第(3)组
3、判断下列反应能否发生
(1)Zn+HCl
(2)Ag+HCl
(3)Fe+H2SO4
(4)Zn+H2SO4
(5)Cu+ZnSO4
(6)Mg+H2SO4
(7)BaCl2+H2SO4
(8)Na2CO3+HCl
(9)FeCl3+NaOH
(10)NaCl+Cu(OH)2
(11)K2SO4+Ba(NO3)2
(12)CaCO3+NaCl
问题探究
三
胶
体
?
1.分散质
2.分散剂
3.分散系
被分散成微粒的物质。
分散质分散到另一种物质
中,
这种物质(另一种物质)叫分散剂。
由分散质和分散剂构成的混合物
统称为分散系。
4、几种常见的分散系
分类
依据:
根据分散系中分散质
粒度大小进行分类。
浊液
胶体
溶液
100nm
1nm
分散质
粒度大小
分散系
类别
5、胶体的性质
胶体中分散质微粒对可见光散射。
⑴丁达尔现象
当可见光束通过胶体时,能在胶体中形成一条明亮的“光路”。
原因:
应用:
区别溶液和胶体。
定义:
CuSO4溶液
Fe(OH)3胶体
丁达尔现象
利用丁达尔现象是区分胶体与溶液的一种常用的物理方法。
树林中的丁达尔现象
使分散质聚集成较大的微粒,在重力作用
下形成沉淀析出。(适用于液溶胶)
能使胶体聚沉的方法:
(2)聚沉:
方法
a、加入盐
b、加热胶体
(3)电泳:胶体中的分散质微粒在直流
电的作用下产生定向移动的现象叫电泳。
电泳现象说明胶体中的分散质微粒带有同种电荷。
应用:利用高压电对气体尘埃(气溶胶)作用,以减少对空气的污染。
(1)盐卤点豆腐;
(2)肥皂的制取和分离;
(3)明矾净水;
(4)FeCl3溶液用于伤口止血。
(5)水泥硬化;
(6)冶金厂大量烟尘用高压电除去。
(7)土壤胶体中离子的吸附和交换过程,保肥作用。
6、胶体的用途:
7、胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂状态分
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
常见的胶体:
Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、淀粉胶体、蛋白质、血液、豆浆、墨水、涂料。
有色玻璃
胶体电池
烟水晶
有色玻璃
晨雾
气溶胶
烟
白云
1nm~100nm
>100nm
>100nm
<1nm
均一、透明较稳定
不均一、不稳定
不均一、不稳定
均一、透明、稳定
不能
不能
不能
能
能
不能
不能
能
分子集合体
大量分子集合体
大量分子集合体
分子、离子
分散质微粒直径
外观特征稳定性
能否透过半透膜
能否透过滤纸
分散质微粒组成
胶体
乳浊液
悬浊液
溶液
分散系
不同分散系的比较
1、下列分散系属于胶体的是(
)
A.
淀粉溶液
B.
食盐水
C.
牛奶
D.
碘酒
A
B
2、下列关于胶体的说法正确的是(
)
A.胶体外观不均匀
B.胶体做不停的、无秩序的运动
C.胶体不能通过滤纸
D.胶体不稳定,静置后容易产生沉淀
3、下列与胶体无关的是(
)
A、丁达尔效应
B、分散质粒子直径1~100nm
C、CuSO4溶液显蓝色
D、Al(OH)3的净水作用
C
4、向Fe(OH)3胶体中加入下列哪种物质,先出现浑浊,后又澄清(
)
A、Na3PO4
B、MgSO4
C、盐酸
D、NaCl
C
根据化合物的性质
在水溶液中或熔化状态下是否导电
物质是否由同一种分子组成
物质
纯净物
混合物
单质
化合物
酸、碱、盐
氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
概括·整合
第
2
章
元素与物质世界
第
1
节
元素与物质的分类
盛世佳和购物广场
元素与物质的关系
问题探究
一
(1)110多种元素是如何构成几千万种物
质的?
(2)为了更好地研究物质的性质和用途,
应怎样对物质进行分类?
用什么样
的标准分类?
(3)各类物质之间具有怎样的关系?
问题1:找出组成元素;这些元素还能重新组合成哪些物质?
(1)若只由一种元素组成,请写出其化学式。这一类物质属于单质还是属于化合物?
单质:由同种元素组成的纯净物。
游离态:元素以单质的形式存在的状态。
镁、铜、钠、氧、氯、氢、硫、碳
(2)若由两种元素组成化合物,先在下面的两个表格中将能形成化合物的元素画上连线,并写出其化学式。这一类物质属于单质还是属于化合物?
Na(+1)
Mg(+2)
O(-2)
Cu(+1、+2)
Ca(+2)
Cl(-1)
C(+2、+4)
H(+1)
S(-2)
S(+4、+6)
(3)若由三种元素组成化合物,请写出其化学式。
NaClO
Na2SO4
Na2SO3
Na2CO3
NaOH
MgSO4
MgSO3
MgCO
3
Mg(OH)2
CuSO4
CuCO
3
Cu(OH)
2
Ca(ClO)
2
CaSO4
CaCO
3
Ca(OH)
2
化合物:
由两种或两种以上的元素组成的
纯净物。
化合态:元素以化合物的形式存在的状态。
问题2:
含碳物质的研究。
CO2
CaCO3
Na2CO3
H2CO3
C
CO
0
+2
+4
化合价:
化学式:
以上讨论对你认识元素与物质的关系有什么启发?
⑴元素是物质的基本组成成分,物质都是由元素组成的;
⑵每一种元素可以自身组成物质—单质;
⑶一种元素不仅可以与其它种类元素组成化合物,而且相同的元素也可组成不同的化合物;
⑷由于元素可以按照一定的规律以不同的种类和不同的方式进行组合,
因而110多种元素能够构成庞大繁杂的物质世界。
⑴元素按存在形态分为_______和________;有的元素只有一种单质,有的有两种或两种以上的单质,单质、化合物还可以按不同的标准分类。
⑵同一种化合物按组成的元素、存在形态、离解情况等可从不同角度分类。
游离态
化合态
物
质
纯净物
混合物
单质
化合物
金属
非金属
氧化物
氧化物对应
的水化物
非金属氢化物
盐
按金属离子
按酸根离子
酸
碱
钠盐
钾盐
钙盐…
盐酸盐
硫酸盐
碳酸盐…
硫
元
素
硫单质
(游离态)
化合物
(化合态)
S2、S4、S6、S8
…
盐
氧化物
…
SO2、SO3
氧化物对应
的水化物
…
H2SO3、H2SO4
硫酸盐
…
Na2SO4
硫化物
…
Na2S
亚硫酸盐
…
Na2SO3
硫家族
氢化物
H2S
…
物质的分类
问题探究
二
五
彩
缤
纷
的
铜
世
界
绿色
蓝色
Cu(OH)2
Cu2(OH)2CO3
CuSO4
CuO
化
合
物
氧化物
盐
碱
蓝色
白色
黑色
CuSO4·5H2O
Cu2O
红色
紫红色
Cu
单质
根据化合物的性质
在水溶液中或熔化状态下是否导电
〖问题1〗物质分类的方法
物质是否由同一种分子组成
物质
纯净物
混合物
单质
化合物
酸、碱、盐
、氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
?
?
?
?
?
氧
化
物
酸性氧化物
碱性氧化物
(其它氧化物)
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
CO、H2O、Na2O2
从组成元素分
非金属氧化物
金属氧化物
从性质
物质的分类(氧化物)
单质:
Fe、
木炭、氧气
氧化物:
CaO、
CuO
酸(稀):
HCl、
H2SO4
碱溶液:NaOH、Ca(OH)2
盐溶液:NaCl、
Na2SO4
、AgNO3、
CuSO4
、
CaCO3
指示剂:
石蕊试液
根据提供的试剂,
探究单质、氧化物、酸、碱和盐之间发生的反应:
〖问题2〗
单质、氧化物、酸、碱、盐之间的关系
【预测1】
金属
酸
盐
非金属单质
碱性
氧化物
【预测2】
酸
酸性
氧化物
水
酸性
氧化物
【预测3】
碱
碱性
氧化物
水
【预测4】
酸
碱
盐
金属
碱性
氧化物
指示剂
碱
酸
盐
非金属
酸性
氧化物
指示剂
【预测5】
盐
酸
盐
金属
碱
【预测6】
反应关系
实验现象
结论
酸能使石蕊试液变色
Fe+2HCl=FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl
=
NaCl
+
H2O
AgNO3+HCl=AgCl↓
+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊
试液变红
无色气体
黑色氧化铜解
溶液变蓝色
白色沉淀
试管发热
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别:酸
石蕊试液
金属铁
氧化铜
NaOH
AgNO3
稀盐酸
反应关系
实验现象
结论
碱能使石蕊试液变色
Cl2+2NaOH=NaCl+NaClO+H2O
碱能跟某些金属单质反应
CO2+
2NaOH
=Na2CO3+H2O
2NaOH+H2SO4
=
Na2SO4
+
H2O
2NaOH
+
CuSO4
=Cu(OH)
2
↓
+Na2SO4
碱能跟酸性氧化物反应
碱能跟酸发生反应
碱能跟某些盐发生反应
无色酚酞
试液变红
黄绿色
消失
无明显现象
蓝色沉淀
试管发热
类别:指示剂
类别:非金属单质
类别:酸性氧化物
类别:酸
类别:盐
类别:碱
酚酞试液
Cl2
CO2
H2SO4
CuSO4
氢氧化钠
金属
碱性氧化物
碱
非金属
酸性氧化物
酸
盐
用简图表示单质、氧化物、酸、碱、盐之间的转化关系
给物质分类有何意义?
☆认识一类物质
☆制备物质
☆鉴别物质
☆提纯物质
1、每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来。
A.NaCl
KCl
NaClO
MgCl2
B.HClO3
KClO3
Cl2
NaClO3
C.H3PO4
H4SiO4
HCl
H2SO4
D.铜
金
铂
钙
只有NaClO不是盐酸盐
只有Cl2中化合价为0价
其余为+5价
只有HCl不是含氧酸
只有Ca是活泼金属
2.今有下列三种物质,每组中都有一种物质跟其他三
种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。
三组物质分别为:
(1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、P2O5。
组
别
被选出的物质
分类依据
第(1)组
第(2)组
第(3)组
3、判断下列反应能否发生
(1)Zn+HCl
(2)Ag+HCl
(3)Fe+H2SO4
(4)Zn+H2SO4
(5)Cu+ZnSO4
(6)Mg+H2SO4
(7)BaCl2+H2SO4
(8)Na2CO3+HCl
(9)FeCl3+NaOH
(10)NaCl+Cu(OH)2
(11)K2SO4+Ba(NO3)2
(12)CaCO3+NaCl
问题探究
三
胶
体
?
1.分散质
2.分散剂
3.分散系
被分散成微粒的物质。
分散质分散到另一种物质
中,
这种物质(另一种物质)叫分散剂。
由分散质和分散剂构成的混合物
统称为分散系。
4、几种常见的分散系
分类
依据:
根据分散系中分散质
粒度大小进行分类。
浊液
胶体
溶液
100nm
1nm
分散质
粒度大小
分散系
类别
5、胶体的性质
胶体中分散质微粒对可见光散射。
⑴丁达尔现象
当可见光束通过胶体时,能在胶体中形成一条明亮的“光路”。
原因:
应用:
区别溶液和胶体。
定义:
CuSO4溶液
Fe(OH)3胶体
丁达尔现象
利用丁达尔现象是区分胶体与溶液的一种常用的物理方法。
树林中的丁达尔现象
使分散质聚集成较大的微粒,在重力作用
下形成沉淀析出。(适用于液溶胶)
能使胶体聚沉的方法:
(2)聚沉:
方法
a、加入盐
b、加热胶体
(3)电泳:胶体中的分散质微粒在直流
电的作用下产生定向移动的现象叫电泳。
电泳现象说明胶体中的分散质微粒带有同种电荷。
应用:利用高压电对气体尘埃(气溶胶)作用,以减少对空气的污染。
(1)盐卤点豆腐;
(2)肥皂的制取和分离;
(3)明矾净水;
(4)FeCl3溶液用于伤口止血。
(5)水泥硬化;
(6)冶金厂大量烟尘用高压电除去。
(7)土壤胶体中离子的吸附和交换过程,保肥作用。
6、胶体的用途:
7、胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂状态分
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
常见的胶体:
Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、淀粉胶体、蛋白质、血液、豆浆、墨水、涂料。
有色玻璃
胶体电池
烟水晶
有色玻璃
晨雾
气溶胶
烟
白云
1nm~100nm
>100nm
>100nm
<1nm
均一、透明较稳定
不均一、不稳定
不均一、不稳定
均一、透明、稳定
不能
不能
不能
能
能
不能
不能
能
分子集合体
大量分子集合体
大量分子集合体
分子、离子
分散质微粒直径
外观特征稳定性
能否透过半透膜
能否透过滤纸
分散质微粒组成
胶体
乳浊液
悬浊液
溶液
分散系
不同分散系的比较
1、下列分散系属于胶体的是(
)
A.
淀粉溶液
B.
食盐水
C.
牛奶
D.
碘酒
A
B
2、下列关于胶体的说法正确的是(
)
A.胶体外观不均匀
B.胶体做不停的、无秩序的运动
C.胶体不能通过滤纸
D.胶体不稳定,静置后容易产生沉淀
3、下列与胶体无关的是(
)
A、丁达尔效应
B、分散质粒子直径1~100nm
C、CuSO4溶液显蓝色
D、Al(OH)3的净水作用
C
4、向Fe(OH)3胶体中加入下列哪种物质,先出现浑浊,后又澄清(
)
A、Na3PO4
B、MgSO4
C、盐酸
D、NaCl
C
根据化合物的性质
在水溶液中或熔化状态下是否导电
物质是否由同一种分子组成
物质
纯净物
混合物
单质
化合物
酸、碱、盐
氧化物
电解质
非电解质
溶液
浊液
胶体
元素
是否由同种元素组成
被分散物质颗粒的大小
概括·整合
