人教版九年级化学上册5.1-质量守恒定律的应用(共24张PPT)
文档属性
| 名称 | 人教版九年级化学上册5.1-质量守恒定律的应用(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 517.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-24 14:38:23 | ||
图片预览






文档简介
(共24张PPT)
质量守恒定律的应用
质量守恒定律
质量守恒定律
内容
内容
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
原因
原因
原子数目没有增减
原子种类没有改变
原子质量没有变化
知识梳理
1、“参加”意味着反应物中过量的剩余部分的质量不应算在内
2、“总和”意味着把各种状态的反应物和
生成物都算在内。如肉眼看不见的气体也应考虑。
质量守恒定律的验证实验
如选择有气体参与或有气体生成的反应,要在密闭容器中进行。
例1.成语“点石成金”,本意为古代术士的一
种法术,即能使石头变成黄金;现比喻能化
腐朽为神奇。有人说他能把石灰石(主要成分CaCO3)变成黄金,请你用化学知识说明石灰石不能变成黄金的道理。
运用化学知识
在化学反应中元素的种类不变。
石灰石的主要成分是碳酸钙,它是由钙元素、碳元素、氧元素组成的。黄金是由金元素组成的。
因此石灰石不可能变成黄金。
题意解释
概括总结
1
.汽油、煤油、柴油等燃料都是有机物(含有C、H、等元素),它们都是从石油中提炼出来的。一些骗子称,他们发明了一种试剂,只要在水中加入这种试剂,就可以使普通的水变成燃料油,从而解决世界性的难题。请驳斥这种谎言的荒谬之处。
答:水中是由氢、氧元素组成的,燃料油是由碳、氢等元素组成,化学反应中元素种类不变。因此“水变燃油”是谎言。
2、高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小?
高锰酸钾受热分解后,生成锰酸钾二氧化锰和氧气,根据质量守恒定律,反应物高锰酸钾的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,所以剩余固体的质量必然比原高锰酸钾的质量小。
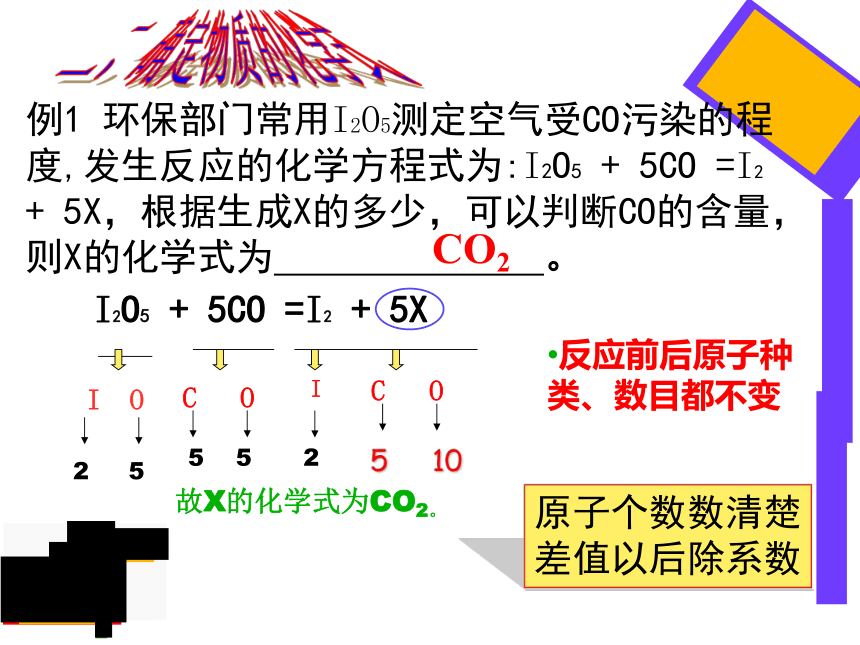
I2O5
+
5CO
=I2
+
5X
故X的化学式为CO2。
5
5
I
O
2
2
5
C
O
例1
环保部门常用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:I2O5
+
5CO
=I2
+
5X,根据生成X的多少,可以判断CO的含量,则X的化学式为
。
C
O
5
10
CO2
I
原子个数数清楚
差值以后除系数
反应前后原子种类、数目都不变
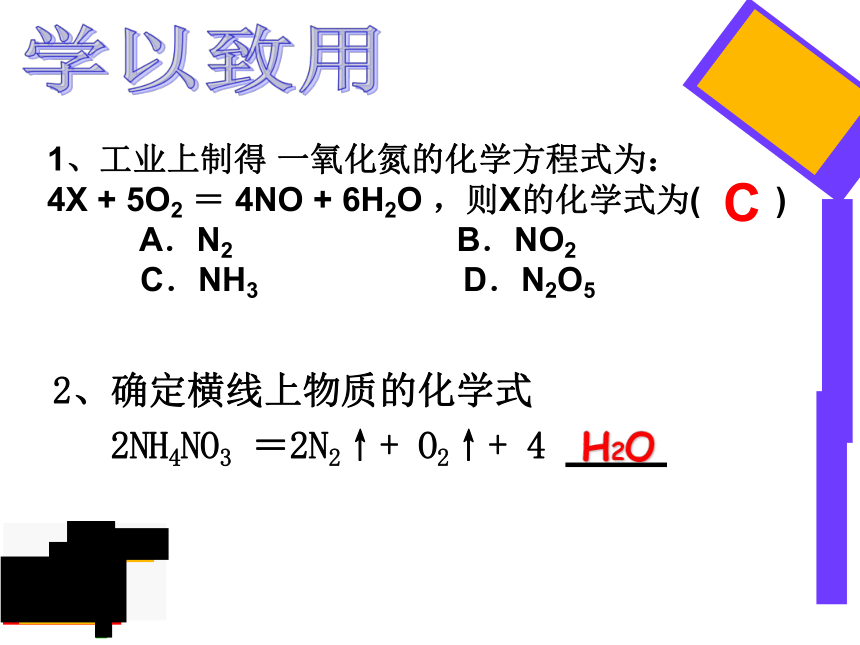
1、工业上制得
一氧化氮的化学方程式为:
4X
+
5O2
=
4NO
+
6H2O
,则X的化学式为(
)
A.N2
B.NO2
C.NH3
D.N2O5
C
H2O
2、确定横线上物质的化学式
2NH4NO3
=2N2↑+
O2↑+
4
分析:水
+
二氧化碳
淀粉
+
氧气
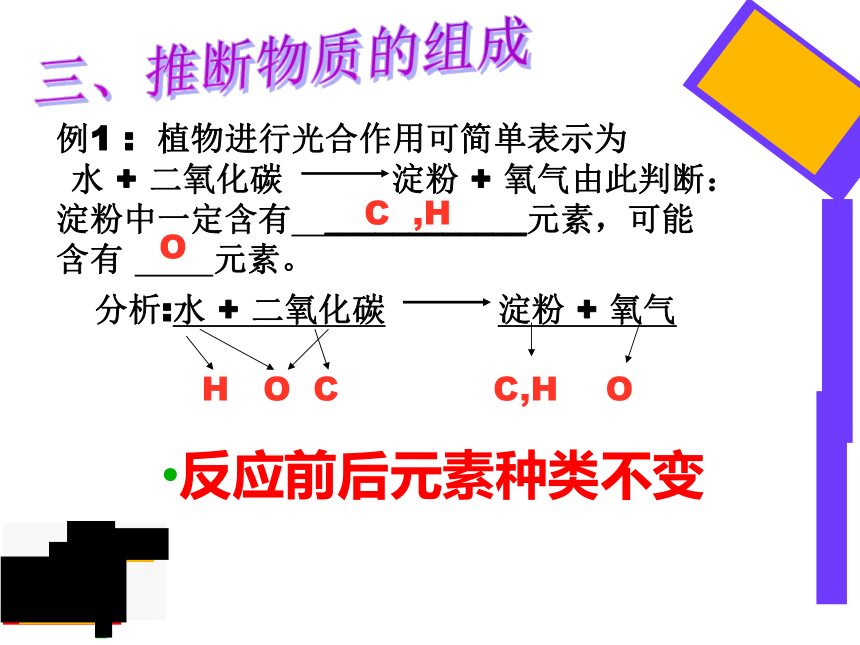
例1
:
植物进行光合作用可简单表示为
水
+
二氧化碳
淀粉
+
氧气由此判断:淀粉中一定含有
____________元素,可能含有
元素。
H
O
C
O
C,H
反应前后元素种类不变
C
,H
O
例2:某有机物1.
6g在足量的氧气中充分燃烧,生成4.4g二氧化碳和3.6g水,则此有机物的组成元素为
(填符号)
【解析】化学反应前后元素的种类不变,生产物CO2和H2O中含有C、H、O三种元素,所以可确定有机物中一定有C和H。根据质量守恒定律,参加反应的氧气的质量为:
4.4
g
+3.6g-
1.6g
=6.4
g。化学反应前后元素的质量不变,所以生成物中与反应物中的氧元素质量是相等的,生成CO2中的氧元素质量为4.4g×
=3.2g,生成水中氧元素质量为3.6g×
=3.2g
所以生成物中氧元素的总质量为6.4g,与参加反应的氧气的质量相等,故可确定有机物中不含氧元素。
C
、
H
1、
生物的呼吸作用表示为:
有机物
+
氧气
→二氧化碳
+
水
,以下关于有机物
组成元素推断正确的是(
)
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含有氧元素
D
2.1.3克某物质在氧气中充分燃烧生成3.3克二氧化碳和2.7克水,则该物质中
(
)
A.一定含有碳元素可能含氢、氧两种元素
B.一定含有碳、氢两种元素,可能含有氧元素
C.碳元素与氧元素的质量比是9:1
D.只含有碳、氢两种元素
C
质量守恒定律及化学方程式的综合应用
质量守恒定律
化学方程式的含义
①表示反应物、生成物及反应条件
②表示反应中各物质间的微粒个数比
知识梳理
③表示反应中各物质反应的质量比
2H2O2
2H2O
+
O2
MnO2
↑
过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气
每2个过氧化氢分子反应生成2个水分子和1个氧分子(即该反应中各物质的微粒个数比为2:2:1)
配平系数比
(化学计量系数比)
每68份质量的过氧化氢反应生成36份质量的水和32份质量的氧气(即该反应中各物质反应的质量比为68:36:32)
反应质量比=相对分子质量×系数
后的比值
例1:在反应A+B==C+D中,4.4
g
B完全反应,生成10
g
C和1.8
g
D,若要生成20
g
C,则需要A的质量为(
)
A.
8
g
B.
10
g
C.
14
g
D.
14.8
g
【解析】4.4
g
B完全反应,生成10
g
C和1.8
g
D
,根据质量守恒定律,参加反应的A的质量为:10g
+1.8
g-4.4
g=7.4
g,即A与C的质量比为74∶100,故要生成20
g
C,设需要A的质量为x,
,x=14.8
g。故选D
D
例2:在反应2A
+
B
=
3C
+
D中,A和B的相对分子质量之比为5﹕1,已知20克A与一定质量的B恰好反应,生成5克D,则在此反应中B和C的质量比为(
)
A、4﹕19
B、3﹕5
C、1﹕3
D、2﹕17
【解析】依据反应方程式及A和B的相对分子质量比,可知A和B在反应中的质量比为5×2:1即10:1。所以20克A与2g
B恰好反应生成5g
D。根据质量守恒定律生成C的质量为20g+2g-5g=17g所以反应中B和C的质量比为2:17,故选D
D
1、在化学反应A+B=C+D中,8
gA和16
gB恰好完全反应生成10
gC,若12
gA参加反应,生成D的质量是
(?
?)
A.20
g B.24
g C.15
g
D.21
g
2、在反应A+3B=2C+3D中,C与D的相对分子质量比为22:9,若2.3g
A与足量B充分反应,生成2.7g
D,则在此反应中,参加反应的B与生成C的质量比为( )
A、3:2
B、12:11
C、8:11
D、35:33
D
B
例1:化学方程式
2A+B====C+2D中,A、B、C的相对分子质量依次分别为103、71、160,则D的相对分子质量为(
)
A.58.5
B.117
C.114
D.14
【解析】依据反应方程式及A、B、C的相对分子质量,可知A、B、C三种物质在反应中的质量比为2×103:1×71:1×160,即206:71:160
。假设D的相对分子质量为X,根据质量守恒定律可得
206+71=160+2X
,
得X=58.5,故选
A
例2:在化学反应
X+3Y====2Z中,现有8
g
X与足量Y反应后,生成16
g
Z,则
Y、Z的相对分子质量之比是(
)
A.1∶2
B.1∶3
C.3∶2
D.1∶2
【解析】8gX与Y反应生成16g的Z,根据质量守恒定律可知参加反应的Y的质量为8g。所以该反应中Y、Z反应的质量比为8:16即1:2,设Y、Z三种物相对分子质量分别为m、n,根据方程式可知
3m:2n=1:2,解得m:n=1:3
,故选B
B
1、在A+B=C+2D的反应中,已知2.9
g
A跟4.9
g
B完全反应生成6
g
C,且D的相对分子质量为18,则A的相对分子质量为
(?
?
)
A.29???
B.49??
?C.58??
?D.85
2、在反应A+3B=2C+3D中,C与D的相对分子质量比为22:9,若2.3g
A与足量B充分反应,生成2.7g
D,则B与C的相对分子质量比为( )
A、3:2
B、12:11
C、8:11
D、35:33
C
C
例:在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,充分发生反应,测得反应前后各物质的质量如下:已知甲的相对分子质量为丁的2倍,则该反应的化学方程式中甲与丁的化学计量数之比为
(
)
甲
乙
丙
丁
反应前质量/g
64
10
1
25
反应后质量/g
待测
54
37
9
A.
1∶2
B.
1∶1
C.
2∶1
D.
2∶3
党风廉政建设工作报告
××县人民政府
(20XX年××月××日)
今年以来,按照市委、市政府和市纪委的安排部署,××县政府切实把党风廉政建设和经济工作摆到同等重要的位置来抓,积极探索新形势下做好党风廉政建设工作的新路子,全力推进党风廉政建设和反腐败斗争深入开展,有力促进了县域经济的快速健康发展。现将有关工作情况汇报如下:
一、强化责任,认真落实党风廉政建设责任制
我们始终把落实党风廉政建设责任制作为党风廉政建设的重之重,狠抓责任分解、责任督查、责任考核、责任追究四个关键环节,确保了党风廉政建设责任制得到较好落实。一是抓责任分解。年初,根据县政府班子成员分工,按照“一岗双责”的要求,制定了《××人民政府班子成员20XX
年党风廉政建设责任分解》,明确了每位班子成员的党风廉政建设职责。政府班子成员及时召开了分管部门和分包乡镇会议,将承担的重点工作任务逐项分解到相关部门和乡镇,
明确工作目标、完成时限和保障措施,从而在政府系统形成了县长抓面、副县长抓块、部门抓落实的良好工作机制。二是抓责任督查。继续实行了党风廉政建设第一责任人报告制度、月报制度、督察制度及季报抽查制度,实施经常性监督。积极拓
【解析】由题目表格数据分析可知,生成乙44
g,生成丙36
g,消耗丁16
g,根据质量守恒定律,可以推算出甲为反应物,参加反应的质量为64
g。由已知可知甲和丁的相对分子质量比为2:1,则甲和丁的化学计量系数比为
甲
乙
丙
丁
反应前质量/g
64
10
1
25
反应后质量/g
待测
54
37
9
1、将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后各物的质量如下:
物质(纯净物)
乙醇
氧气
二氧化碳
水
X
反应前质量/g
2.3
4
0
0
0
反应后质量/g
0
0
2.2
2.7
待测
则生成的二氧化碳和X的质量比是__________;该反应方程式中C2H5OH(乙醇)与O2化学计量数之比_______
。
11∶7
2∶5
例1:一定条件下,下列物质在密闭容器内反应一段时间,测得反应产前后各物质的质量如下:
物质
X
Y
Z
W
反应前质量/g
10
2.2
16.2
0.9
反应后质量/g
a
4.4
8.1
1.8
根据上表信息判断,下列说法中错误的是(
)
A.X、Z是反应物,Y、W是生成物
B.a=15
C.反应中Y、W两种物质的质量比为22︰9
D.该反应是分解反应
A
例2:如图所示是某反应前后的微观示意图,
“
”和“
”表示两种不同的原子。
则该反应(
)
A.是化合反应
B.有单质生成
C.反应前后分子种类不变
D.参加反应的两种分子个数比为4:1
A
宏观
微观
物质的总质量
元素质量
元素种类
原子数目
原子质量
原子种类
物质的种类
分子的种类
改变
六不变
质量守恒定律的应用
质量守恒定律
质量守恒定律
内容
内容
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
原因
原因
原子数目没有增减
原子种类没有改变
原子质量没有变化
知识梳理
1、“参加”意味着反应物中过量的剩余部分的质量不应算在内
2、“总和”意味着把各种状态的反应物和
生成物都算在内。如肉眼看不见的气体也应考虑。
质量守恒定律的验证实验
如选择有气体参与或有气体生成的反应,要在密闭容器中进行。
例1.成语“点石成金”,本意为古代术士的一
种法术,即能使石头变成黄金;现比喻能化
腐朽为神奇。有人说他能把石灰石(主要成分CaCO3)变成黄金,请你用化学知识说明石灰石不能变成黄金的道理。
运用化学知识
在化学反应中元素的种类不变。
石灰石的主要成分是碳酸钙,它是由钙元素、碳元素、氧元素组成的。黄金是由金元素组成的。
因此石灰石不可能变成黄金。
题意解释
概括总结
1
.汽油、煤油、柴油等燃料都是有机物(含有C、H、等元素),它们都是从石油中提炼出来的。一些骗子称,他们发明了一种试剂,只要在水中加入这种试剂,就可以使普通的水变成燃料油,从而解决世界性的难题。请驳斥这种谎言的荒谬之处。
答:水中是由氢、氧元素组成的,燃料油是由碳、氢等元素组成,化学反应中元素种类不变。因此“水变燃油”是谎言。
2、高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小?
高锰酸钾受热分解后,生成锰酸钾二氧化锰和氧气,根据质量守恒定律,反应物高锰酸钾的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,所以剩余固体的质量必然比原高锰酸钾的质量小。
I2O5
+
5CO
=I2
+
5X
故X的化学式为CO2。
5
5
I
O
2
2
5
C
O
例1
环保部门常用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:I2O5
+
5CO
=I2
+
5X,根据生成X的多少,可以判断CO的含量,则X的化学式为
。
C
O
5
10
CO2
I
原子个数数清楚
差值以后除系数
反应前后原子种类、数目都不变
1、工业上制得
一氧化氮的化学方程式为:
4X
+
5O2
=
4NO
+
6H2O
,则X的化学式为(
)
A.N2
B.NO2
C.NH3
D.N2O5
C
H2O
2、确定横线上物质的化学式
2NH4NO3
=2N2↑+
O2↑+
4
分析:水
+
二氧化碳
淀粉
+
氧气
例1
:
植物进行光合作用可简单表示为
水
+
二氧化碳
淀粉
+
氧气由此判断:淀粉中一定含有
____________元素,可能含有
元素。
H
O
C
O
C,H
反应前后元素种类不变
C
,H
O
例2:某有机物1.
6g在足量的氧气中充分燃烧,生成4.4g二氧化碳和3.6g水,则此有机物的组成元素为
(填符号)
【解析】化学反应前后元素的种类不变,生产物CO2和H2O中含有C、H、O三种元素,所以可确定有机物中一定有C和H。根据质量守恒定律,参加反应的氧气的质量为:
4.4
g
+3.6g-
1.6g
=6.4
g。化学反应前后元素的质量不变,所以生成物中与反应物中的氧元素质量是相等的,生成CO2中的氧元素质量为4.4g×
=3.2g,生成水中氧元素质量为3.6g×
=3.2g
所以生成物中氧元素的总质量为6.4g,与参加反应的氧气的质量相等,故可确定有机物中不含氧元素。
C
、
H
1、
生物的呼吸作用表示为:
有机物
+
氧气
→二氧化碳
+
水
,以下关于有机物
组成元素推断正确的是(
)
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含有氧元素
D
2.1.3克某物质在氧气中充分燃烧生成3.3克二氧化碳和2.7克水,则该物质中
(
)
A.一定含有碳元素可能含氢、氧两种元素
B.一定含有碳、氢两种元素,可能含有氧元素
C.碳元素与氧元素的质量比是9:1
D.只含有碳、氢两种元素
C
质量守恒定律及化学方程式的综合应用
质量守恒定律
化学方程式的含义
①表示反应物、生成物及反应条件
②表示反应中各物质间的微粒个数比
知识梳理
③表示反应中各物质反应的质量比
2H2O2
2H2O
+
O2
MnO2
↑
过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气
每2个过氧化氢分子反应生成2个水分子和1个氧分子(即该反应中各物质的微粒个数比为2:2:1)
配平系数比
(化学计量系数比)
每68份质量的过氧化氢反应生成36份质量的水和32份质量的氧气(即该反应中各物质反应的质量比为68:36:32)
反应质量比=相对分子质量×系数
后的比值
例1:在反应A+B==C+D中,4.4
g
B完全反应,生成10
g
C和1.8
g
D,若要生成20
g
C,则需要A的质量为(
)
A.
8
g
B.
10
g
C.
14
g
D.
14.8
g
【解析】4.4
g
B完全反应,生成10
g
C和1.8
g
D
,根据质量守恒定律,参加反应的A的质量为:10g
+1.8
g-4.4
g=7.4
g,即A与C的质量比为74∶100,故要生成20
g
C,设需要A的质量为x,
,x=14.8
g。故选D
D
例2:在反应2A
+
B
=
3C
+
D中,A和B的相对分子质量之比为5﹕1,已知20克A与一定质量的B恰好反应,生成5克D,则在此反应中B和C的质量比为(
)
A、4﹕19
B、3﹕5
C、1﹕3
D、2﹕17
【解析】依据反应方程式及A和B的相对分子质量比,可知A和B在反应中的质量比为5×2:1即10:1。所以20克A与2g
B恰好反应生成5g
D。根据质量守恒定律生成C的质量为20g+2g-5g=17g所以反应中B和C的质量比为2:17,故选D
D
1、在化学反应A+B=C+D中,8
gA和16
gB恰好完全反应生成10
gC,若12
gA参加反应,生成D的质量是
(?
?)
A.20
g B.24
g C.15
g
D.21
g
2、在反应A+3B=2C+3D中,C与D的相对分子质量比为22:9,若2.3g
A与足量B充分反应,生成2.7g
D,则在此反应中,参加反应的B与生成C的质量比为( )
A、3:2
B、12:11
C、8:11
D、35:33
D
B
例1:化学方程式
2A+B====C+2D中,A、B、C的相对分子质量依次分别为103、71、160,则D的相对分子质量为(
)
A.58.5
B.117
C.114
D.14
【解析】依据反应方程式及A、B、C的相对分子质量,可知A、B、C三种物质在反应中的质量比为2×103:1×71:1×160,即206:71:160
。假设D的相对分子质量为X,根据质量守恒定律可得
206+71=160+2X
,
得X=58.5,故选
A
例2:在化学反应
X+3Y====2Z中,现有8
g
X与足量Y反应后,生成16
g
Z,则
Y、Z的相对分子质量之比是(
)
A.1∶2
B.1∶3
C.3∶2
D.1∶2
【解析】8gX与Y反应生成16g的Z,根据质量守恒定律可知参加反应的Y的质量为8g。所以该反应中Y、Z反应的质量比为8:16即1:2,设Y、Z三种物相对分子质量分别为m、n,根据方程式可知
3m:2n=1:2,解得m:n=1:3
,故选B
B
1、在A+B=C+2D的反应中,已知2.9
g
A跟4.9
g
B完全反应生成6
g
C,且D的相对分子质量为18,则A的相对分子质量为
(?
?
)
A.29???
B.49??
?C.58??
?D.85
2、在反应A+3B=2C+3D中,C与D的相对分子质量比为22:9,若2.3g
A与足量B充分反应,生成2.7g
D,则B与C的相对分子质量比为( )
A、3:2
B、12:11
C、8:11
D、35:33
C
C
例:在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,充分发生反应,测得反应前后各物质的质量如下:已知甲的相对分子质量为丁的2倍,则该反应的化学方程式中甲与丁的化学计量数之比为
(
)
甲
乙
丙
丁
反应前质量/g
64
10
1
25
反应后质量/g
待测
54
37
9
A.
1∶2
B.
1∶1
C.
2∶1
D.
2∶3
党风廉政建设工作报告
××县人民政府
(20XX年××月××日)
今年以来,按照市委、市政府和市纪委的安排部署,××县政府切实把党风廉政建设和经济工作摆到同等重要的位置来抓,积极探索新形势下做好党风廉政建设工作的新路子,全力推进党风廉政建设和反腐败斗争深入开展,有力促进了县域经济的快速健康发展。现将有关工作情况汇报如下:
一、强化责任,认真落实党风廉政建设责任制
我们始终把落实党风廉政建设责任制作为党风廉政建设的重之重,狠抓责任分解、责任督查、责任考核、责任追究四个关键环节,确保了党风廉政建设责任制得到较好落实。一是抓责任分解。年初,根据县政府班子成员分工,按照“一岗双责”的要求,制定了《××人民政府班子成员20XX
年党风廉政建设责任分解》,明确了每位班子成员的党风廉政建设职责。政府班子成员及时召开了分管部门和分包乡镇会议,将承担的重点工作任务逐项分解到相关部门和乡镇,
明确工作目标、完成时限和保障措施,从而在政府系统形成了县长抓面、副县长抓块、部门抓落实的良好工作机制。二是抓责任督查。继续实行了党风廉政建设第一责任人报告制度、月报制度、督察制度及季报抽查制度,实施经常性监督。积极拓
【解析】由题目表格数据分析可知,生成乙44
g,生成丙36
g,消耗丁16
g,根据质量守恒定律,可以推算出甲为反应物,参加反应的质量为64
g。由已知可知甲和丁的相对分子质量比为2:1,则甲和丁的化学计量系数比为
甲
乙
丙
丁
反应前质量/g
64
10
1
25
反应后质量/g
待测
54
37
9
1、将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后各物的质量如下:
物质(纯净物)
乙醇
氧气
二氧化碳
水
X
反应前质量/g
2.3
4
0
0
0
反应后质量/g
0
0
2.2
2.7
待测
则生成的二氧化碳和X的质量比是__________;该反应方程式中C2H5OH(乙醇)与O2化学计量数之比_______
。
11∶7
2∶5
例1:一定条件下,下列物质在密闭容器内反应一段时间,测得反应产前后各物质的质量如下:
物质
X
Y
Z
W
反应前质量/g
10
2.2
16.2
0.9
反应后质量/g
a
4.4
8.1
1.8
根据上表信息判断,下列说法中错误的是(
)
A.X、Z是反应物,Y、W是生成物
B.a=15
C.反应中Y、W两种物质的质量比为22︰9
D.该反应是分解反应
A
例2:如图所示是某反应前后的微观示意图,
“
”和“
”表示两种不同的原子。
则该反应(
)
A.是化合反应
B.有单质生成
C.反应前后分子种类不变
D.参加反应的两种分子个数比为4:1
A
宏观
微观
物质的总质量
元素质量
元素种类
原子数目
原子质量
原子种类
物质的种类
分子的种类
改变
六不变
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
