2020-2021学年必修第一册同步备课系列专题1.2.1 电解质的电离(人教版2019) (共18张PPT)
文档属性
| 名称 | 2020-2021学年必修第一册同步备课系列专题1.2.1 电解质的电离(人教版2019) (共18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 536.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-25 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第一章
物质及其变化
第二节
离子反应
第1课时
电解质的电离
【学习任务一】身边的化学,发现问题
生活常识告诉我们,给电气设备通电时,湿手操作易发生
触电事故。这是为什么呢?
1.水导电吗?
2.什么化学物质是导电的,什么化学物质又是不导电的呢?
【初高中知识衔接】
初中电解水的实验中,水中是加入了硫酸钠或氢氧化钠来增强导电性的,实际纯水在一般条件下是很难测出导电性的。
生活常识:铜、石墨是导电的。
初中物质导电性实验:
盐酸、硫酸、
NaOH溶液、
氢氧化钙溶液等溶液是导电的。
【思考】NaC1溶液、KNO3溶液导电吗?NaCl固体、KNO3固体呢?
【学习任务二】宏观辨识,分析、解决问题
[实验1-2](视频)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
【知识拓展】如果将NaCl、KNO3、NaOH等固体分别加热至熔化,它们也都能导电。
电流是由带电荷的粒子按一定方向移动而形成的。因此,能导电的物质必须具有能自由移动的、带电荷的粒子。
石墨、Cu导电是由于有自由移动的电子。
盐酸、
NaOH溶液、
NaCl溶液、熔融NaCl导电是由于有自由移动的离子。
【归纳总结】物质导电的原因
【新概念】
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液里或熔融状态下都不能导电的化合物
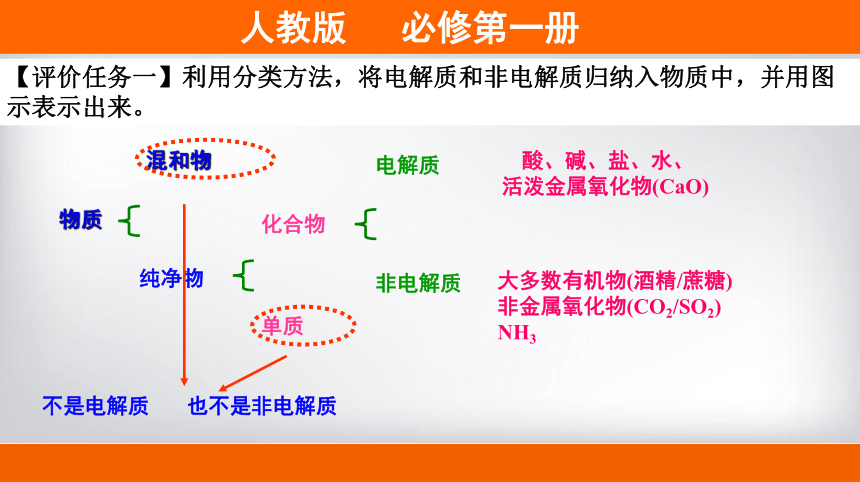
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物(CaO)
大多数有机物(酒精/蔗糖)
非金属氧化物(CO2/SO2)
NH3
【评价任务一】利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
1.下列物质中哪些是电解质?哪些是非电解质?
①铜
②固态NaCl
③CO2
④H2SO4
⑤硫酸钡
⑥酒精
⑦KOH水溶液
⑧熔融状态的KNO3
⑨蔗糖溶液
【评价任务二】
【答案】电解质:②固态NaCl
④H2SO4
⑤硫酸钡
⑧熔融状态的KNO3
非电解质:
③CO2
⑥酒精
⑨蔗糖溶液
【注意】
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
2、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
【解决问题】生活常识告诉我们,给电气设备通电时,湿手操作易发生
触电事故。这是为什么呢?
【思考】为什么NaCl固体不导电,而NaCl溶液、熔融NaCl可导电?
【学习任务三】微观辨析,探究问题根源
【新概念】电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
【思考】观察下图,NaCl溶液、熔融NaCl导电的过程能否用一个式子表示?
NaCl
=
Na+
+
Cl
-
【新概念】电离方程式:电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
【评价任务三】
写出HCl、H2SO4、HNO3
、NaOH、KOH、Ba(OH)2、NaCl、K2SO4和NH4NO3的电离方程式:
HCl
=
H+
+Cl-
H2SO4
=
2H++SO42-
HNO3
=
H+
+NO3-
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
NaOH
=
OH-
+Na+
KOH
=
OH-
+K+
Ba(OH)2
=
2OH-+Ba
2+
【思考与讨论】请参考酸的本质,尝试从电离的角度概括出碱的本质。
NaCl
=
Na+
+
Cl
-
K2SO4
=
2K+
+
SO4
2-
NH4NO3
=
NH4+
+
NO3-
电离时能生成金属阳离子(或者NH4+)和酸根阴离子
的化合物叫做盐。
【评价任务四】
已知,水溶液中,强酸的酸式根能完全解离,
而弱酸的酸式根不能完全解离。书写以下物质的电离方程式,并归纳电离方程式书写的注意事项。
NaHCO3
NaHSO4
NaHSO4
=
Na+
+H+
+
SO42-
NaHCO3
=
Na+
+HCO3-
1、阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
2、原子个数守恒,电荷守恒
3、水溶液中,强酸的酸式根(HSO4—)要拆开写,
而弱酸的酸式根(HCO3—)不能拆。
书写电离方程式时的注意事项:
2.次磷酸(H3PO2)是一种精细磷化工产品,
?H3PO2是一元中强酸,NaH2PO2?为______(填“正盐”或“酸式盐”)
正盐
1、已知HClO4是一种酸,则其溶于水完全电离生成的离子是
_____和
。
H+
ClO4-
【评价任务五】
【解析】
H3PO2是一元中强酸,只能离解出一个氢离子,剩下的氢元素不能离解出来,也就是H2PO2-并非酸式根离子,所以NaH2PO2?为正盐。
【课堂小结】
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,原子个数应该守恒。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
第一章
物质及其变化
第二节
离子反应
第1课时
电解质的电离
【学习任务一】身边的化学,发现问题
生活常识告诉我们,给电气设备通电时,湿手操作易发生
触电事故。这是为什么呢?
1.水导电吗?
2.什么化学物质是导电的,什么化学物质又是不导电的呢?
【初高中知识衔接】
初中电解水的实验中,水中是加入了硫酸钠或氢氧化钠来增强导电性的,实际纯水在一般条件下是很难测出导电性的。
生活常识:铜、石墨是导电的。
初中物质导电性实验:
盐酸、硫酸、
NaOH溶液、
氢氧化钙溶液等溶液是导电的。
【思考】NaC1溶液、KNO3溶液导电吗?NaCl固体、KNO3固体呢?
【学习任务二】宏观辨识,分析、解决问题
[实验1-2](视频)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
【知识拓展】如果将NaCl、KNO3、NaOH等固体分别加热至熔化,它们也都能导电。
电流是由带电荷的粒子按一定方向移动而形成的。因此,能导电的物质必须具有能自由移动的、带电荷的粒子。
石墨、Cu导电是由于有自由移动的电子。
盐酸、
NaOH溶液、
NaCl溶液、熔融NaCl导电是由于有自由移动的离子。
【归纳总结】物质导电的原因
【新概念】
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液里或熔融状态下都不能导电的化合物
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物(CaO)
大多数有机物(酒精/蔗糖)
非金属氧化物(CO2/SO2)
NH3
【评价任务一】利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
1.下列物质中哪些是电解质?哪些是非电解质?
①铜
②固态NaCl
③CO2
④H2SO4
⑤硫酸钡
⑥酒精
⑦KOH水溶液
⑧熔融状态的KNO3
⑨蔗糖溶液
【评价任务二】
【答案】电解质:②固态NaCl
④H2SO4
⑤硫酸钡
⑧熔融状态的KNO3
非电解质:
③CO2
⑥酒精
⑨蔗糖溶液
【注意】
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
2、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
【解决问题】生活常识告诉我们,给电气设备通电时,湿手操作易发生
触电事故。这是为什么呢?
【思考】为什么NaCl固体不导电,而NaCl溶液、熔融NaCl可导电?
【学习任务三】微观辨析,探究问题根源
【新概念】电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
【思考】观察下图,NaCl溶液、熔融NaCl导电的过程能否用一个式子表示?
NaCl
=
Na+
+
Cl
-
【新概念】电离方程式:电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
【评价任务三】
写出HCl、H2SO4、HNO3
、NaOH、KOH、Ba(OH)2、NaCl、K2SO4和NH4NO3的电离方程式:
HCl
=
H+
+Cl-
H2SO4
=
2H++SO42-
HNO3
=
H+
+NO3-
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
NaOH
=
OH-
+Na+
KOH
=
OH-
+K+
Ba(OH)2
=
2OH-+Ba
2+
【思考与讨论】请参考酸的本质,尝试从电离的角度概括出碱的本质。
NaCl
=
Na+
+
Cl
-
K2SO4
=
2K+
+
SO4
2-
NH4NO3
=
NH4+
+
NO3-
电离时能生成金属阳离子(或者NH4+)和酸根阴离子
的化合物叫做盐。
【评价任务四】
已知,水溶液中,强酸的酸式根能完全解离,
而弱酸的酸式根不能完全解离。书写以下物质的电离方程式,并归纳电离方程式书写的注意事项。
NaHCO3
NaHSO4
NaHSO4
=
Na+
+H+
+
SO42-
NaHCO3
=
Na+
+HCO3-
1、阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
2、原子个数守恒,电荷守恒
3、水溶液中,强酸的酸式根(HSO4—)要拆开写,
而弱酸的酸式根(HCO3—)不能拆。
书写电离方程式时的注意事项:
2.次磷酸(H3PO2)是一种精细磷化工产品,
?H3PO2是一元中强酸,NaH2PO2?为______(填“正盐”或“酸式盐”)
正盐
1、已知HClO4是一种酸,则其溶于水完全电离生成的离子是
_____和
。
H+
ClO4-
【评价任务五】
【解析】
H3PO2是一元中强酸,只能离解出一个氢离子,剩下的氢元素不能离解出来,也就是H2PO2-并非酸式根离子,所以NaH2PO2?为正盐。
【课堂小结】
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,原子个数应该守恒。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
