人教版高中化学选修5第二章第一节脂肪烃(44张PPT)
文档属性
| 名称 | 人教版高中化学选修5第二章第一节脂肪烃(44张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-26 21:07:16 | ||
图片预览








文档简介
(共44张PPT)
脂
肪
烃
人教版
选修5《有机化学基础》第二章第一节
烷烃
CnH2n+2
(1)通式:
(2)同系物:
1、分子结构相似,
2、
在分子组成上相差一个或若干个CH2原子团的物质------互称为同系物。
一、烷烃和烯烃
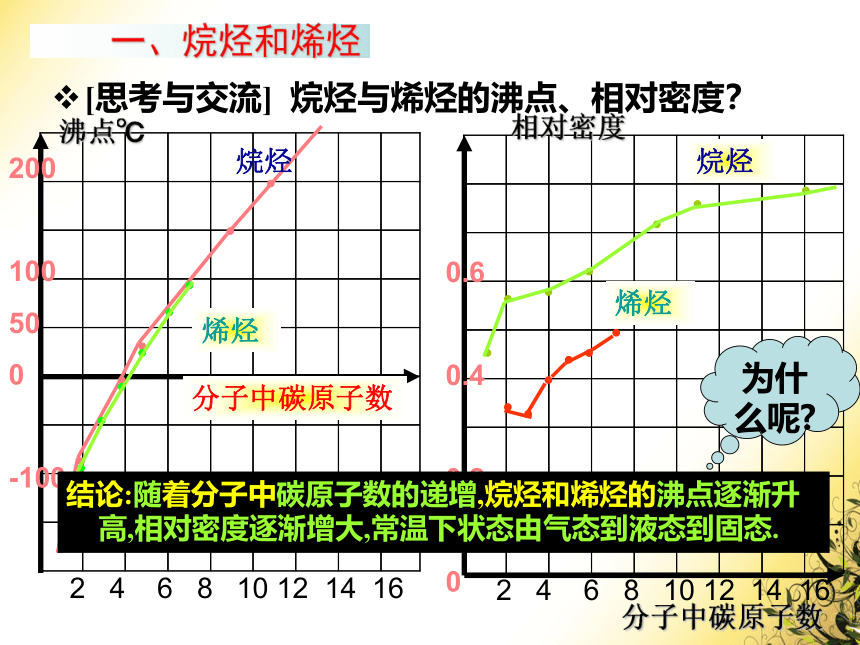
[思考与交流]
烷烃与烯烃的沸点、相对密度?
沸点℃
分子中碳原子数
2
4
6
8
10
12
14
16
200
100
50
0
-100
分子中碳原子数
相对密度
2
4
6
8
10
12
14
16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
结论:随着分子中碳原子数的递增,烷烃和烯烃的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态.
为什么呢?
2.烷烃
烯烃的性质:
物理性质:
随着分子中碳原子数的递增,烷烃和烯烃的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态。
原因:
对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变…
化学性质:
分别与甲烷、乙烯相似
(分子结构相似的物质在化学性质也相似.)
5)各类烃含碳(或氢)的质量分数变化
各类烃C%、H%(均为质量分数)随C原子数n的变化图示
2.烷烃
烯烃的化学性质:
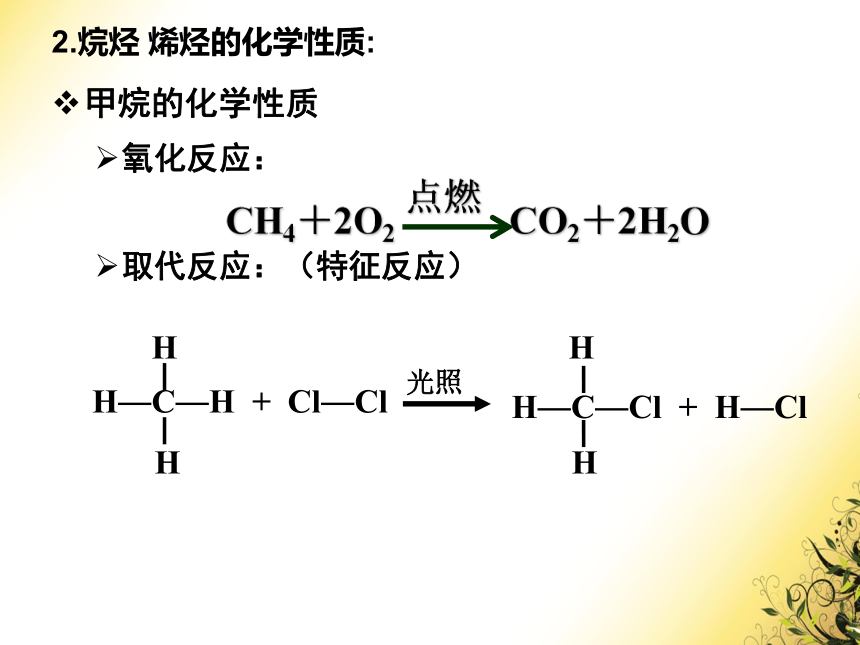
甲烷的化学性质
氧化反应:
取代反应:(特征反应)
CH4+2O2 CO2+2H2O
点燃
H
H—C—H
+
Cl—Cl
H
光照
H—C—Cl
+
H—Cl
H
H
B
、氧化反应
燃烧:
CH4
+
2O2
?
CO2
+
2H2O
点燃
A、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
C
、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
CnH2n+2
+(3n+1)/2
O2
nCO2
+(n+1)H2O
点燃
写出对应的化学方程式。
烷烃特征反应
烷烃的化学性质
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以其它烷烃取代比甲烷复杂。
请写出乙烷、丙烷与氯气光照条件下的反应。
D
、热分解
C4H10
C2H4+C2H6
△
C4H10
CH4+C3H6
△
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
CH4
C+2H2
高温
烷烃的裂化、裂解
取代反应
烯烃的化学性质
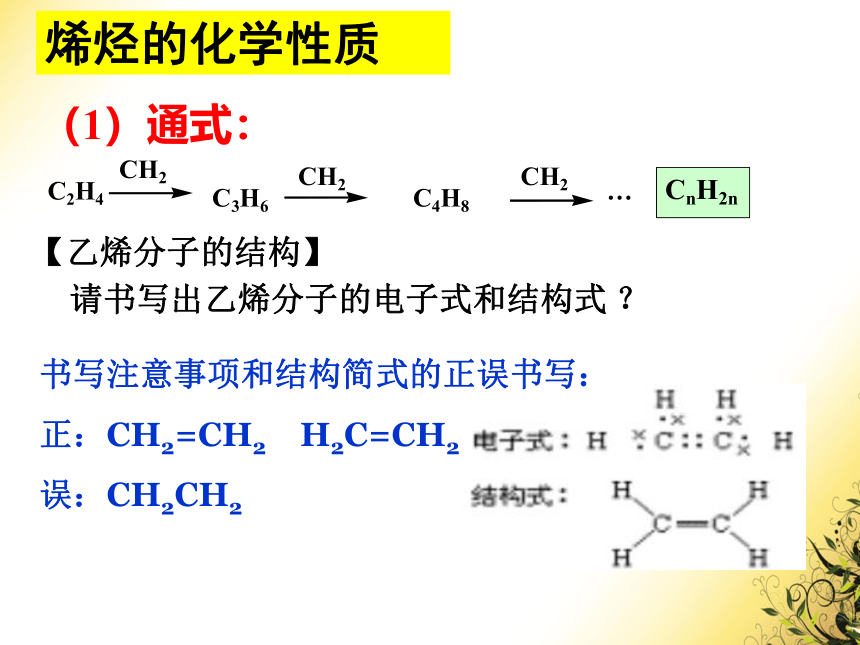
(1)通式:
CnH2n
C2H4
CH2
C3H6
CH2
CH2
C4H8
…
【乙烯分子的结构】
请书写出乙烯分子的电子式和结构式
?
书写注意事项和结构简式的正误书写:
正:CH2=CH2
H2C=CH2
误:CH2CH2
乙烯的化学性质
氧化反应:
加成反应:
C2H4+3O2 2CO2+2H2O
点燃
H-C=C-H+Br-Br
→
H-C-C-H
H H
H H
Br
Br
能使酸性KMnO4溶液褪色
能使溴的四氯化碳溶液褪色
加成反应
加聚反应
具有不饱和键的有机化合物可以通过加成反应得到高分子化合物,这类反应称为加聚反应。
nCH2=CH2
-CH2-CH2-
催化剂
[
]n
聚合度
链节
乙烯
单体
能用来合成高分子化合物的小分子化合物叫单体
化学组成和结构均可以重复的最小单位称为重复结构单元,又称链节;
链节的数目n称为聚合度或链节数。n越大,相对分子质量越大。
聚乙烯
由加聚反应获得的高聚物
聚氯乙烯(PVC)
聚甲基丙烯酸甲酯
(有机玻璃)
聚四氟乙烯(PTFE)
烯烃的化学性质:
(A)加成反应
(
与H2、Br2、HX、H2O等)
CH3-CH=CH2
+
H2
CH3CH2CH3
催化剂
CH2==CH2+Br2
CH2BrCH2Br
使溴水褪色
△
大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。
主产物
拓展视野:马氏规则
丙烯与溴化氢发生加成反应时有可能得到两种不同的加成产物。
通常情况下主要得到2-溴丙烷。
研究发现,当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧”,即遵循马尔可夫尼可夫(V.Vmarkovnikov)规则(简称马氏规则)。
CH2=CH-CH3+HBr→CH3-CH-CH3
Br
(B)氧化反应
①燃烧:
②催化氧化:
火焰明亮,冒黑烟。烯烃燃烧通式?
③与酸性KMnO4的作用:
2CH2==CH2
+O2
2CH3CHO
催化剂
加热加压
使KMnO4溶液褪色
5CH2=CH2
+
12KMnO4
+18H2SO4
10CO2
↑
+
12MnSO4
+
6K2SO4
+
28H2O
其它烯烃氧化反应
R—CH=CH2
R—COOH
+
CO2
使酸性KMnO4
溶液褪色
取代反应、加成反应
取代反应:
有机化合物分子中的某些原子或原子团被其他原子或原子团所替代的反应。如卤代、酯化反应。
加成反应:
构成有机化合物不饱和键两个原子与其他原子或原子团直接结合的反应。
烯烃还可以与水、氢气、卤化氢等在一定条件下发生加成反应。
两个双键在碳链中的不同位置:
C—C=C=C—C
①累积二烯烃(不稳定)
C=C—C=C—C
②共轭二烯烃
C=C—C—C=C
③孤立二烯烃
3、二烯烃类别:
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
【思考】当1molCH2=CH-CH=CH2与1molBr2或Cl2加成时,其加成产物是什么?
1,2加成与1,4加成
1,3-丁二烯的加成反应(与Br2)
CH2-CH-CH=CH2
|
|
Br
Br
低温
CH2=CH-CH=CH2+Br2→
高温
CH2=CH-CH=CH2+Br2→
CH2-CH=CH-CH2
|
|
Br
Br
1,2加成
1,4加成
Cl
Cl
+
Cl2
1,2—加成
+
Cl2
1,4—加成
Cl
Cl
加成反应——键线表示
练习
1、怎样除去CH4中的C2H4?
2、制取氯乙烷的最好方法是(
)
A.乙烷和氯气反应
B.乙烯和氯气反应
C.乙烯和氯化氢反应
D.乙炔和氯化氢反应
溴水
为什么不能用KMnO4?
溴水或溴的CCl4溶液常用于检验或除去烯与炔。
C
3、下列烷烃沸点最高的是(
)
A.
CH3CH2CH3
B.
CH3CH2CH2CH3
C.
CH3(CH2)3CH3
D.
(CH3)2CHCH2CH3
4、下列混合物可以用分液的方法分离的是(
)
A.
苯和溴苯
B.
汽油和辛烷
C.
己烷和水
D.
戊烷和庚烷
C
C
除醇、羧酸外大部分有机物不溶与水,
但可溶于有机物
【
练习1】分别写出下列烯烃的名称及发生加聚反应的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
二、烯烃的顺反异构
顺反异构:
有碳碳双键
(双键不能旋转)
每个碳原子必须连接两个不同的原子或原子团.
反式结构
顺式结构
C
=
C
C
=
C
H
H
CH3
CH3
CH3
CH3
H
H
化学性质基本相同,物理性质有一定的差异。
相同原子或原子团在同一侧
相同原子或原子团在两侧
(1)异构现象的产生:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
(2)产生顺反异构体的条件:
双键两端的同一个碳原子上不能连有相同基团。只有这样才会产生顺反异构体。即a’
?
b’,a
?
b
,且
a
=
a’、b
=
b’
至少有一个存在。
练习
1、下列物质中没有顺反异构的是(
)
A.1,2-二氯乙烯
B.1,2-二氯丙烯
C.2-甲基-2-丁烯
D.2-氯-2-丁烯
2、2-丁炔有顺反异构吗?
C
C
=
C
H
CH3
CH3
CH3
没有
三、炔烃
炔烃:
分子里含有碳碳三键的一类脂肪烃称为炔烃
通式:CnH2n-2
(n≥2)
碳碳单键、双键、三键比较
说明:
三键中有2个键不稳定,容易断裂,
有一个键较稳定。
键长/10-10m
键能/(kJ/mol)
C-C
C
=
C
C
≡
C
1.54
1.33
1.20
348
615
812
乙炔
分子式:
电子式:
结构式:
结构简式:
空间构型:
H—C≡C—H
CH≡CH
或
HC≡CH
直线型,键角180°
C
●
×
H
C
●
×
H
C2H2
无色、无味的气体,微溶于水,易溶于有机溶剂。
乙炔的实验室制取
反应原理:CaC2
+
2H2O
→
Ca(OH)2
+
C2H2↑
操作:在圆底烧瓶里放入几小块电石。旋开分液漏斗的活塞,逐滴加入饱和食盐水,产生乙炔。
现象:
通入乙炔,高锰酸钾酸性溶液褪色;
通入乙炔,溴的四氯化碳溶液褪色;
点燃乙炔,有明亮火焰,伴有浓烈黑烟。
注意事项:
为避免反应过快,用饱和食盐水代替水!!
检查气密性?
怎样除去杂质气体?
气体收集方法
电石:
外观:灰白色固体。
制法:
生石灰与碳混合后在电炉中加热至约2000
°C反应制得。
CaO
+
3C
→
CaC2
+
CO
电石中含有
CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;
(2)如何去除乙炔的臭味呢?
(1)乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?
(3)H2S对本实验有影响吗?为什么?
H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
NaOH和CuSO4溶液
为什么不能用启普发生器制取乙炔?
反应剧烈,启普发生器不易控制反应;
反应放出大量热,启普发生器是厚玻璃壁仪器,容易因胀缩不均,引起破碎
;
生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗的下口;
关闭导气阀后,水蒸气仍与电石作用,不能达到“关之即停”的目的.
乙炔的化学性质
氧化反应:
燃烧:
与酸性高锰酸钾溶液反应
加成反应:
使溴水褪色;
催化加氢;
与
HX
等反应。
CH≡CH+HCl
CH2=CHCl
(制氯乙烯)
催化剂
练习:
乙炔是一种重要的有机原料。
写出乙炔制取聚氯乙烯的反应方程式。
CH2=CHCl
CH≡CH
+
HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
Cl
—CH2?CH—
n
四、脂肪烃的来源及其应用
脂肪烃的来源
石油:1~50个碳原子的烷烃及环烷烃。
常压分馏,得石油气、汽油、煤油、柴油等;
减压分馏,得润滑油、石蜡等。
催化裂化、裂解,得较多的轻质油和气态烯烃。
催化重整,是获得芳香烃的主要途径。
天然气:甲烷(体积分数:80~90%)为主的烃类。
煤:复杂的有机物、无机物混合物。
干馏得焦炭、煤焦油、焦炉气;
煤焦油分馏可获得各种芳香烃;
液化得燃料油及多种化工原料。
练习
1.下列烷烃中,常温下呈气态的是(
)
A.戊烷
B.丁烷
C.庚烷
D.十二烷
2.下列性质不属于烷烃的性质的是(
)
A.燃烧时生成CO2和H2O
B.能跟卤素发生取代反应
C.都溶于水
D.通常情况下,跟酸、碱和氧化剂都不反应
B
C
3.
等物质的量的下列各烃,完全燃烧,生成CO2和H2O,耗氧最多的是(
)
A.CH4
B.C2H4
C.C6H6
D.C4H10
4、某物质在空气中完全燃烧时,生成水和二氧化碳的分子数比为2:1,则该物质可能是(
)。
①CH4
②C2H4
③C2H5OH
④CH3OH
A、②③
B、①④
C、①③
D、②④
C
B
5、用乙炔为原料制取CH2BrCHBrCl,可行的反应途径是(
)
A、先加Cl2,再加Br2
B、先加Cl2,再加HBr
C、先加HCl,再加HBr
D、先加HCl,再加Br2
6、可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是(
)
A、通入酸性高锰酸钾溶液中
B、通入足量溴水中
C、一定条件下通入H2
D、点燃
D
B
再见
脂
肪
烃
人教版
选修5《有机化学基础》第二章第一节
烷烃
CnH2n+2
(1)通式:
(2)同系物:
1、分子结构相似,
2、
在分子组成上相差一个或若干个CH2原子团的物质------互称为同系物。
一、烷烃和烯烃
[思考与交流]
烷烃与烯烃的沸点、相对密度?
沸点℃
分子中碳原子数
2
4
6
8
10
12
14
16
200
100
50
0
-100
分子中碳原子数
相对密度
2
4
6
8
10
12
14
16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
结论:随着分子中碳原子数的递增,烷烃和烯烃的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态.
为什么呢?
2.烷烃
烯烃的性质:
物理性质:
随着分子中碳原子数的递增,烷烃和烯烃的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态。
原因:
对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变…
化学性质:
分别与甲烷、乙烯相似
(分子结构相似的物质在化学性质也相似.)
5)各类烃含碳(或氢)的质量分数变化
各类烃C%、H%(均为质量分数)随C原子数n的变化图示
2.烷烃
烯烃的化学性质:
甲烷的化学性质
氧化反应:
取代反应:(特征反应)
CH4+2O2 CO2+2H2O
点燃
H
H—C—H
+
Cl—Cl
H
光照
H—C—Cl
+
H—Cl
H
H
B
、氧化反应
燃烧:
CH4
+
2O2
?
CO2
+
2H2O
点燃
A、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
C
、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
CnH2n+2
+(3n+1)/2
O2
nCO2
+(n+1)H2O
点燃
写出对应的化学方程式。
烷烃特征反应
烷烃的化学性质
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以其它烷烃取代比甲烷复杂。
请写出乙烷、丙烷与氯气光照条件下的反应。
D
、热分解
C4H10
C2H4+C2H6
△
C4H10
CH4+C3H6
△
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
CH4
C+2H2
高温
烷烃的裂化、裂解
取代反应
烯烃的化学性质
(1)通式:
CnH2n
C2H4
CH2
C3H6
CH2
CH2
C4H8
…
【乙烯分子的结构】
请书写出乙烯分子的电子式和结构式
?
书写注意事项和结构简式的正误书写:
正:CH2=CH2
H2C=CH2
误:CH2CH2
乙烯的化学性质
氧化反应:
加成反应:
C2H4+3O2 2CO2+2H2O
点燃
H-C=C-H+Br-Br
→
H-C-C-H
H H
H H
Br
Br
能使酸性KMnO4溶液褪色
能使溴的四氯化碳溶液褪色
加成反应
加聚反应
具有不饱和键的有机化合物可以通过加成反应得到高分子化合物,这类反应称为加聚反应。
nCH2=CH2
-CH2-CH2-
催化剂
[
]n
聚合度
链节
乙烯
单体
能用来合成高分子化合物的小分子化合物叫单体
化学组成和结构均可以重复的最小单位称为重复结构单元,又称链节;
链节的数目n称为聚合度或链节数。n越大,相对分子质量越大。
聚乙烯
由加聚反应获得的高聚物
聚氯乙烯(PVC)
聚甲基丙烯酸甲酯
(有机玻璃)
聚四氟乙烯(PTFE)
烯烃的化学性质:
(A)加成反应
(
与H2、Br2、HX、H2O等)
CH3-CH=CH2
+
H2
CH3CH2CH3
催化剂
CH2==CH2+Br2
CH2BrCH2Br
使溴水褪色
△
大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。
主产物
拓展视野:马氏规则
丙烯与溴化氢发生加成反应时有可能得到两种不同的加成产物。
通常情况下主要得到2-溴丙烷。
研究发现,当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧”,即遵循马尔可夫尼可夫(V.Vmarkovnikov)规则(简称马氏规则)。
CH2=CH-CH3+HBr→CH3-CH-CH3
Br
(B)氧化反应
①燃烧:
②催化氧化:
火焰明亮,冒黑烟。烯烃燃烧通式?
③与酸性KMnO4的作用:
2CH2==CH2
+O2
2CH3CHO
催化剂
加热加压
使KMnO4溶液褪色
5CH2=CH2
+
12KMnO4
+18H2SO4
10CO2
↑
+
12MnSO4
+
6K2SO4
+
28H2O
其它烯烃氧化反应
R—CH=CH2
R—COOH
+
CO2
使酸性KMnO4
溶液褪色
取代反应、加成反应
取代反应:
有机化合物分子中的某些原子或原子团被其他原子或原子团所替代的反应。如卤代、酯化反应。
加成反应:
构成有机化合物不饱和键两个原子与其他原子或原子团直接结合的反应。
烯烃还可以与水、氢气、卤化氢等在一定条件下发生加成反应。
两个双键在碳链中的不同位置:
C—C=C=C—C
①累积二烯烃(不稳定)
C=C—C=C—C
②共轭二烯烃
C=C—C—C=C
③孤立二烯烃
3、二烯烃类别:
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
【思考】当1molCH2=CH-CH=CH2与1molBr2或Cl2加成时,其加成产物是什么?
1,2加成与1,4加成
1,3-丁二烯的加成反应(与Br2)
CH2-CH-CH=CH2
|
|
Br
Br
低温
CH2=CH-CH=CH2+Br2→
高温
CH2=CH-CH=CH2+Br2→
CH2-CH=CH-CH2
|
|
Br
Br
1,2加成
1,4加成
Cl
Cl
+
Cl2
1,2—加成
+
Cl2
1,4—加成
Cl
Cl
加成反应——键线表示
练习
1、怎样除去CH4中的C2H4?
2、制取氯乙烷的最好方法是(
)
A.乙烷和氯气反应
B.乙烯和氯气反应
C.乙烯和氯化氢反应
D.乙炔和氯化氢反应
溴水
为什么不能用KMnO4?
溴水或溴的CCl4溶液常用于检验或除去烯与炔。
C
3、下列烷烃沸点最高的是(
)
A.
CH3CH2CH3
B.
CH3CH2CH2CH3
C.
CH3(CH2)3CH3
D.
(CH3)2CHCH2CH3
4、下列混合物可以用分液的方法分离的是(
)
A.
苯和溴苯
B.
汽油和辛烷
C.
己烷和水
D.
戊烷和庚烷
C
C
除醇、羧酸外大部分有机物不溶与水,
但可溶于有机物
【
练习1】分别写出下列烯烃的名称及发生加聚反应的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
二、烯烃的顺反异构
顺反异构:
有碳碳双键
(双键不能旋转)
每个碳原子必须连接两个不同的原子或原子团.
反式结构
顺式结构
C
=
C
C
=
C
H
H
CH3
CH3
CH3
CH3
H
H
化学性质基本相同,物理性质有一定的差异。
相同原子或原子团在同一侧
相同原子或原子团在两侧
(1)异构现象的产生:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
(2)产生顺反异构体的条件:
双键两端的同一个碳原子上不能连有相同基团。只有这样才会产生顺反异构体。即a’
?
b’,a
?
b
,且
a
=
a’、b
=
b’
至少有一个存在。
练习
1、下列物质中没有顺反异构的是(
)
A.1,2-二氯乙烯
B.1,2-二氯丙烯
C.2-甲基-2-丁烯
D.2-氯-2-丁烯
2、2-丁炔有顺反异构吗?
C
C
=
C
H
CH3
CH3
CH3
没有
三、炔烃
炔烃:
分子里含有碳碳三键的一类脂肪烃称为炔烃
通式:CnH2n-2
(n≥2)
碳碳单键、双键、三键比较
说明:
三键中有2个键不稳定,容易断裂,
有一个键较稳定。
键长/10-10m
键能/(kJ/mol)
C-C
C
=
C
C
≡
C
1.54
1.33
1.20
348
615
812
乙炔
分子式:
电子式:
结构式:
结构简式:
空间构型:
H—C≡C—H
CH≡CH
或
HC≡CH
直线型,键角180°
C
●
×
H
C
●
×
H
C2H2
无色、无味的气体,微溶于水,易溶于有机溶剂。
乙炔的实验室制取
反应原理:CaC2
+
2H2O
→
Ca(OH)2
+
C2H2↑
操作:在圆底烧瓶里放入几小块电石。旋开分液漏斗的活塞,逐滴加入饱和食盐水,产生乙炔。
现象:
通入乙炔,高锰酸钾酸性溶液褪色;
通入乙炔,溴的四氯化碳溶液褪色;
点燃乙炔,有明亮火焰,伴有浓烈黑烟。
注意事项:
为避免反应过快,用饱和食盐水代替水!!
检查气密性?
怎样除去杂质气体?
气体收集方法
电石:
外观:灰白色固体。
制法:
生石灰与碳混合后在电炉中加热至约2000
°C反应制得。
CaO
+
3C
→
CaC2
+
CO
电石中含有
CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;
(2)如何去除乙炔的臭味呢?
(1)乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?
(3)H2S对本实验有影响吗?为什么?
H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
NaOH和CuSO4溶液
为什么不能用启普发生器制取乙炔?
反应剧烈,启普发生器不易控制反应;
反应放出大量热,启普发生器是厚玻璃壁仪器,容易因胀缩不均,引起破碎
;
生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗的下口;
关闭导气阀后,水蒸气仍与电石作用,不能达到“关之即停”的目的.
乙炔的化学性质
氧化反应:
燃烧:
与酸性高锰酸钾溶液反应
加成反应:
使溴水褪色;
催化加氢;
与
HX
等反应。
CH≡CH+HCl
CH2=CHCl
(制氯乙烯)
催化剂
练习:
乙炔是一种重要的有机原料。
写出乙炔制取聚氯乙烯的反应方程式。
CH2=CHCl
CH≡CH
+
HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
Cl
—CH2?CH—
n
四、脂肪烃的来源及其应用
脂肪烃的来源
石油:1~50个碳原子的烷烃及环烷烃。
常压分馏,得石油气、汽油、煤油、柴油等;
减压分馏,得润滑油、石蜡等。
催化裂化、裂解,得较多的轻质油和气态烯烃。
催化重整,是获得芳香烃的主要途径。
天然气:甲烷(体积分数:80~90%)为主的烃类。
煤:复杂的有机物、无机物混合物。
干馏得焦炭、煤焦油、焦炉气;
煤焦油分馏可获得各种芳香烃;
液化得燃料油及多种化工原料。
练习
1.下列烷烃中,常温下呈气态的是(
)
A.戊烷
B.丁烷
C.庚烷
D.十二烷
2.下列性质不属于烷烃的性质的是(
)
A.燃烧时生成CO2和H2O
B.能跟卤素发生取代反应
C.都溶于水
D.通常情况下,跟酸、碱和氧化剂都不反应
B
C
3.
等物质的量的下列各烃,完全燃烧,生成CO2和H2O,耗氧最多的是(
)
A.CH4
B.C2H4
C.C6H6
D.C4H10
4、某物质在空气中完全燃烧时,生成水和二氧化碳的分子数比为2:1,则该物质可能是(
)。
①CH4
②C2H4
③C2H5OH
④CH3OH
A、②③
B、①④
C、①③
D、②④
C
B
5、用乙炔为原料制取CH2BrCHBrCl,可行的反应途径是(
)
A、先加Cl2,再加Br2
B、先加Cl2,再加HBr
C、先加HCl,再加HBr
D、先加HCl,再加Br2
6、可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是(
)
A、通入酸性高锰酸钾溶液中
B、通入足量溴水中
C、一定条件下通入H2
D、点燃
D
B
再见
