人教版高中化学选修五第四节 研究有机化合物的一般步骤和方法(44张PPT)
文档属性
| 名称 | 人教版高中化学选修五第四节 研究有机化合物的一般步骤和方法(44张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 923.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-26 00:00:00 | ||
图片预览











文档简介
(共52张PPT)
第4节
研究有机化合物的一般
步骤和方法
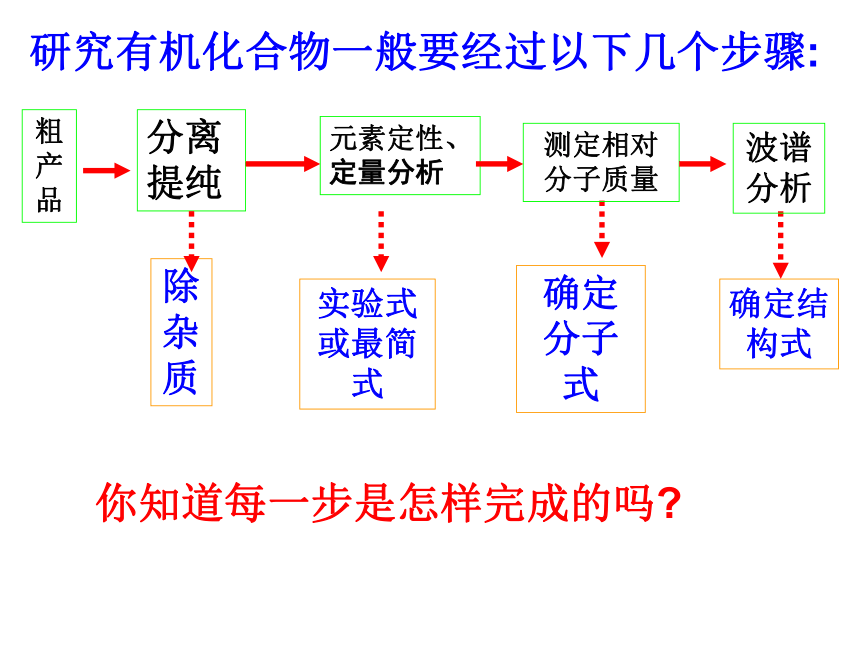
研究有机化合物一般要经过以下几个步骤:
粗产品
分离提纯
元素定性、定量分析
除杂质
确定分子式
确定结构式
你知道每一步是怎样完成的吗?
实验式或最简式
波谱分析
测定相对分子质量
分离、提纯
思考:物质的分离与提纯有什么区别?
比如:有氯化钠、氯化钙的混合物,
如何提纯氯化钠?如何分离二者?
常用的分离、提纯物质的方法有哪些?
分离、提纯
2、物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的常用物理方法
蒸馏
重结晶
萃取
分液
1、化学方法:一般是加入或通过某种试剂进行化学反应。
有机物的分离、提纯方法:
提纯液体有机物:蒸馏、萃取、色谱法
提纯固体有机物:重结晶
一、蒸馏
思考与交流
1、蒸馏法适用于分离、提纯何类有机物?对该类有机物与杂质的沸点区别有何要求?
2、实验室进行蒸馏实验时,用到的仪器主要有哪些?
3、思考P17---实验1-1的实验步骤,有哪些需要注意的事项?
2、蒸馏提纯的条件
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
1、蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
实验:含有杂质的工业乙醇的蒸馏
蒸馏的注意事项
注意仪器组装的顺序:“先下后上,由左至右”。
不得直接加热蒸馏烧瓶,需垫石棉网(受热均匀)。
蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;需使用沸石。
冷凝水水流方向应与蒸汽流方向相反(逆流:下进上出)。
温度计水银球位置应与蒸馏烧瓶支管口齐平,以测量馏出蒸气的温度。
练习1
欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出苯
√
思考与交流
1、已知KNO3在水中的溶解度很容易随温度变化而变化,而NaCl的溶解度却变化不大,据此可用何方法分离出两者混合物中的KNO3并加以提纯?
2、重结晶对溶剂有何要求?被提纯的有机物的溶解度需符合什么特点?
二、重结晶
原理:利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。让杂质全部或大部分留在溶液中,从而达到提纯的目的。
1、重结晶苯甲酸需用到哪些实验仪器?
2、实验过程?
3、能否用简洁的语言归纳重结晶苯甲酸的实验步骤?
加热溶解、趁热过滤、冷却结晶
实验1—2
苯甲酸的重结晶
不纯固体物质
残渣
(不溶性杂质)
滤液
母液(可溶性杂质和部分被提纯物)
晶体(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
重结晶实验流程图
如何洗涤结晶?如何检验结晶洗净与否?
洗涤沉淀或晶体的一般方法:用胶头滴管
往晶体上加蒸馏水直至晶体被浸没,
待水完全流出后,重复两至三次,直
至晶体被洗净。
检验洗涤效果:取最后一次的洗出液,
再选择适当的试剂进行检验。
包括:液—液萃取、固—液萃取
回顾:
1、如何提取溴水中的溴?实验原理是什么?
2、进行提取溴的实验要用到哪些仪器?
3、如何选取萃取剂?
4、实验的操作步骤?
三、萃取
1、原理(液—液萃取)
利用混合物中一种溶质在互不相溶的溶剂里
溶解度相差较大,用一种溶剂把溶质从它与
另一种溶剂所组成的溶液中提取出来的方法
(操作)
3、选择萃取剂的要求
1)两种溶剂互不相溶
2)溶质在两种溶剂中的溶解度相差较大
2、所需仪器:铁架台、铁圈、分液漏斗、烧杯
常见的有机萃取剂:
酒精、苯、乙醚、石油醚、二氯甲烷、四氯化碳……
4、操作过程:
振荡
静置
分液
※四、色谱法:阅读P.19
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
例如:用粉笔分离色素……
练习:
下列每组中各有三对物质,它们都能用分液漏斗分离的是
A
乙酸乙酯和水,酒精和水,植物油和水
B
四氯化碳和水,溴苯和水,硝基苯和水
C
甘油和水,乙酸和水,乙酸和乙醇
D
汽油和水,苯和水,己烷和水
√
√
相似相溶:溶于水的有机物;易溶于有机溶剂的X2
学习小技巧:适当记忆一些有机物质相对与水的密度大小及溶解性,对于解决萃取分液的实验题是很有帮助的
【二】元素分析与相对分子质量的测定
1、元素分析:
经元素分析处理即可确定有机物的实验式(最简式)
定性分析——有机物的组成元素分析;
定量分析——分子内各元素原子的质量分数
如:课本---P20---例题---求实验式(最简式)
2、确定有机物的分子式
根据最简式与相对分子质量确定分子式。
确定有机物的分子式的途径:
1.确定实验式
2.确定相对分子质量
该烃的实验式是C2H5
烃的分子式为
C4H10
例1
某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。
例2:
燃烧某有机物A
1.50g,生成1.12L(标准状况)CO2和0.05mol
H2O。该有机物的蒸气对空气(相对分子质量为29)的相对密度是1.04,求该有机物的分子式。
CH2O
例3:吗啡分子含C:
71.58%
H:
6.67%
N
:4.91%
,
其余为氧,其相对分子质量小于300。试确定其分子式。
解:由已知条件可知含氧为16.84%,观察可知含N量最少,据原子量可知,含N原子的个数最少,可设含n个N原子,则吗啡的分子量为14n/4.91%
=
285n<300,即吗啡含有1个N,分子量为285。则吗啡分子中:
N(C)=17
N
(H)=19
N
(O)=3
吗啡的分子式为C17H19NO3
例4
某0.16g饱和一元醇与足量的金属钠充分反应,产生56mL氢气(标准)状况。则该饱和一元醇的分子式为________。
CH4O
CH4O
当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常需要采取一些物理方法。与鉴定有机物结构有关的物理方法有质谱、红外光谱、核磁共振谱等。
测定相对分子质量的方法很多,
质谱法是最精确、最快捷的方法。
3、相对分子质量的确定——质谱法
质谱仪的图片:它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。
这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
M
=
46
【思考与交流】
1、质荷比是什么?
2、如何确定有机物的相对分子质量?
(结论:分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量)
【三】用物理方法确定有机化合物的结构
可用以下方法对分子结构进行鉴定
1、红外光谱:阅读P22
2、核磁共振氢谱:阅读P22
3、X-射线晶体衍射技术:
P23科学视野
1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
根据红外谱图中的化学键和官能团确定有机物的结构。
P22图:吸收越强,透过率越低,则说明含有该种原子团(官能团)
练习:
有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C
对称CH3
对称CH2
CH3—CH2—O—CH2—CH3
[提升练习]
下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3—COO—CH2—CH3
CH3—C—CH2—O—CH3
O
HCOO—CH2—CH2—CH3
CH3—CH2—COO—CH3
HC—CH2—CH2—O—CH3
O
2、核磁共振氢谱—确定氢的类别和数目
不同化学环境的氢原子(等效氢原子)因产生共振时吸收的频率不同,被核磁共振仪记录下来的吸收峰的面积不同。
所以,可以从核磁共振谱图上推知氢原子的类型及数目,从而推断有机物的结构。
由P23的图谱可知
:
未知物A的结构应为CH3CH2OH
例:CH3CH2OH、CH3—O—CH3两种物质来说,
除了碳原子、氧原子的位置、连接方式不同外,氢原子的连接方式也不同、所处的环境不同,即等效氢的种数不同。
小组讨论:未知物的分子式为C2H6O,有哪些方法推断其结构?------分析思路?
⑴、化学性质:
⑵、物理性质:
由组成通式(CnH2n+2O)写出可能的结构
酯化反应、加入Na、消去反应、、、
红外光谱、核磁共振氢谱
[练习下列有机物分子在核磁共振氢谱中只给出一种信号(例如:课本P23---图1-20
)的是
A
HCHO
B
CH3OH
C
HCOOH
D
CH3COOCH3
[练习2]
分子式为C3H6O2的有机物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断有机物的组成可能是(写结构简式)
。
CH3COOCH3
HCOOCH2CH3
2种H;3H:3H
3种H;3H:2H:1H
HOOCCH2CH3
练习3:下列物质有几种不同环境的H?
C
C
⑴C-C-C-C
⑵
C-C-C-C-C
C-C
C
⑶
C
⑹
CH3COOCH3
C-C-C=C
O
C=C
⑺
CH3
C
CH3
⑷
-
CH3
⑸
-C
(CH3)
3
3
4
3
1
1
1
2
⑻
-
CHOH-CH3
⑼
H3CO
OCH3
⑽
分类统计:对称轴上的H
对称区域上的H
3+3
2+2
0+3
⑻
⑼
⑽
提升练习:
核磁共振氢谱上观察到氢原子给出的峰只有一种情况:
⑴分子式为C3H6
、C4H8
,则该烃结构简式分别为?
⑵分子式为C8H8,则该烃结构简式为?
三维空间感受能力
平面感受能力
习惯命名为:立方烷
课后阅读:
晶体洗涤的研究
化学高考试题中,经常涉及对所得晶体或固体残渣进行洗涤,洗涤大有讲究,要考虑几个方面,如:为什么要洗涤?用什么洗涤?怎样洗涤?怎样证明已经洗涤干净?等等。
一、关于洗涤的目的
关于晶体或残渣为什么要洗涤,即洗涤的目的,常见有:
①除去杂质:除去晶体表面的可溶性杂质。
②提高产率:洗涤过滤所得到的残渣,把有用的物质,如目标产物尽可能洗出来。
③防止污染环境:如果滤渣表面有一些对环境有害的物质,如重金属离子或CN-,为了防止污染环境,往往对残渣进行洗涤。
晶体洗涤的研究
一、关于洗涤的目的
二、关于洗涤的试剂
对于用什么洗涤,我们经常可以用以下几种:
①蒸馏水;
②冷水;
③有机溶剂,如酒精、丙酮等;
④该物质的饱和溶液。
一般经常用的洗涤剂是蒸馏水,如果用其他的洗涤剂,必有其“独特”之处。用冷水可适当降低晶体因为溶解而造成损失。用酒精等有机溶剂洗涤的好处常见有:可以降低晶体因溶解而造成损失,可以除去表面的可溶性杂质和水分;酒精易挥发,晶体易干燥。注意:有特殊的物质其溶解度随温度升高而下降的,可以采用热蒸馏水洗涤。用该物质的饱和溶液可以使因为溶解造成的损失降到最低。
晶体洗涤的研究
一、关于洗涤的目的
二、关于洗涤的试剂
三、关于洗涤的方法
洗涤的正确方法是:让过滤后的晶体继续留在过滤器中,加洗涤剂浸没过晶体,让洗涤剂自然流下,重复2-3次即可。注意点:在洗涤过程中不能搅拌,因为滤纸已经很润湿,如果搅拌就很容易搅破滤纸,这样晶体会淋失,从而造成晶体损失。
分离、提纯
思考:物质的分离与提纯有什么区别?
下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)NaCl(泥沙)
(2)酒精(水)
(3)甲烷(乙烯)
(4)乙酸乙酯(乙酸)
(5)溴水(水)
(6)
KNO3
(NaCl)
比如:有氯化钠、氯化钙的混合物,
如何提纯氯化钠?如何分离二者?
常用的分离、提纯物质的方法有哪些?
第4节
研究有机化合物的一般
步骤和方法
研究有机化合物一般要经过以下几个步骤:
粗产品
分离提纯
元素定性、定量分析
除杂质
确定分子式
确定结构式
你知道每一步是怎样完成的吗?
实验式或最简式
波谱分析
测定相对分子质量
分离、提纯
思考:物质的分离与提纯有什么区别?
比如:有氯化钠、氯化钙的混合物,
如何提纯氯化钠?如何分离二者?
常用的分离、提纯物质的方法有哪些?
分离、提纯
2、物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的常用物理方法
蒸馏
重结晶
萃取
分液
1、化学方法:一般是加入或通过某种试剂进行化学反应。
有机物的分离、提纯方法:
提纯液体有机物:蒸馏、萃取、色谱法
提纯固体有机物:重结晶
一、蒸馏
思考与交流
1、蒸馏法适用于分离、提纯何类有机物?对该类有机物与杂质的沸点区别有何要求?
2、实验室进行蒸馏实验时,用到的仪器主要有哪些?
3、思考P17---实验1-1的实验步骤,有哪些需要注意的事项?
2、蒸馏提纯的条件
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
1、蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
实验:含有杂质的工业乙醇的蒸馏
蒸馏的注意事项
注意仪器组装的顺序:“先下后上,由左至右”。
不得直接加热蒸馏烧瓶,需垫石棉网(受热均匀)。
蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;需使用沸石。
冷凝水水流方向应与蒸汽流方向相反(逆流:下进上出)。
温度计水银球位置应与蒸馏烧瓶支管口齐平,以测量馏出蒸气的温度。
练习1
欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出苯
√
思考与交流
1、已知KNO3在水中的溶解度很容易随温度变化而变化,而NaCl的溶解度却变化不大,据此可用何方法分离出两者混合物中的KNO3并加以提纯?
2、重结晶对溶剂有何要求?被提纯的有机物的溶解度需符合什么特点?
二、重结晶
原理:利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。让杂质全部或大部分留在溶液中,从而达到提纯的目的。
1、重结晶苯甲酸需用到哪些实验仪器?
2、实验过程?
3、能否用简洁的语言归纳重结晶苯甲酸的实验步骤?
加热溶解、趁热过滤、冷却结晶
实验1—2
苯甲酸的重结晶
不纯固体物质
残渣
(不溶性杂质)
滤液
母液(可溶性杂质和部分被提纯物)
晶体(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
重结晶实验流程图
如何洗涤结晶?如何检验结晶洗净与否?
洗涤沉淀或晶体的一般方法:用胶头滴管
往晶体上加蒸馏水直至晶体被浸没,
待水完全流出后,重复两至三次,直
至晶体被洗净。
检验洗涤效果:取最后一次的洗出液,
再选择适当的试剂进行检验。
包括:液—液萃取、固—液萃取
回顾:
1、如何提取溴水中的溴?实验原理是什么?
2、进行提取溴的实验要用到哪些仪器?
3、如何选取萃取剂?
4、实验的操作步骤?
三、萃取
1、原理(液—液萃取)
利用混合物中一种溶质在互不相溶的溶剂里
溶解度相差较大,用一种溶剂把溶质从它与
另一种溶剂所组成的溶液中提取出来的方法
(操作)
3、选择萃取剂的要求
1)两种溶剂互不相溶
2)溶质在两种溶剂中的溶解度相差较大
2、所需仪器:铁架台、铁圈、分液漏斗、烧杯
常见的有机萃取剂:
酒精、苯、乙醚、石油醚、二氯甲烷、四氯化碳……
4、操作过程:
振荡
静置
分液
※四、色谱法:阅读P.19
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
例如:用粉笔分离色素……
练习:
下列每组中各有三对物质,它们都能用分液漏斗分离的是
A
乙酸乙酯和水,酒精和水,植物油和水
B
四氯化碳和水,溴苯和水,硝基苯和水
C
甘油和水,乙酸和水,乙酸和乙醇
D
汽油和水,苯和水,己烷和水
√
√
相似相溶:溶于水的有机物;易溶于有机溶剂的X2
学习小技巧:适当记忆一些有机物质相对与水的密度大小及溶解性,对于解决萃取分液的实验题是很有帮助的
【二】元素分析与相对分子质量的测定
1、元素分析:
经元素分析处理即可确定有机物的实验式(最简式)
定性分析——有机物的组成元素分析;
定量分析——分子内各元素原子的质量分数
如:课本---P20---例题---求实验式(最简式)
2、确定有机物的分子式
根据最简式与相对分子质量确定分子式。
确定有机物的分子式的途径:
1.确定实验式
2.确定相对分子质量
该烃的实验式是C2H5
烃的分子式为
C4H10
例1
某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。
例2:
燃烧某有机物A
1.50g,生成1.12L(标准状况)CO2和0.05mol
H2O。该有机物的蒸气对空气(相对分子质量为29)的相对密度是1.04,求该有机物的分子式。
CH2O
例3:吗啡分子含C:
71.58%
H:
6.67%
N
:4.91%
,
其余为氧,其相对分子质量小于300。试确定其分子式。
解:由已知条件可知含氧为16.84%,观察可知含N量最少,据原子量可知,含N原子的个数最少,可设含n个N原子,则吗啡的分子量为14n/4.91%
=
285n<300,即吗啡含有1个N,分子量为285。则吗啡分子中:
N(C)=17
N
(H)=19
N
(O)=3
吗啡的分子式为C17H19NO3
例4
某0.16g饱和一元醇与足量的金属钠充分反应,产生56mL氢气(标准)状况。则该饱和一元醇的分子式为________。
CH4O
CH4O
当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常需要采取一些物理方法。与鉴定有机物结构有关的物理方法有质谱、红外光谱、核磁共振谱等。
测定相对分子质量的方法很多,
质谱法是最精确、最快捷的方法。
3、相对分子质量的确定——质谱法
质谱仪的图片:它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。
这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
M
=
46
【思考与交流】
1、质荷比是什么?
2、如何确定有机物的相对分子质量?
(结论:分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量)
【三】用物理方法确定有机化合物的结构
可用以下方法对分子结构进行鉴定
1、红外光谱:阅读P22
2、核磁共振氢谱:阅读P22
3、X-射线晶体衍射技术:
P23科学视野
1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
根据红外谱图中的化学键和官能团确定有机物的结构。
P22图:吸收越强,透过率越低,则说明含有该种原子团(官能团)
练习:
有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C
对称CH3
对称CH2
CH3—CH2—O—CH2—CH3
[提升练习]
下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3—COO—CH2—CH3
CH3—C—CH2—O—CH3
O
HCOO—CH2—CH2—CH3
CH3—CH2—COO—CH3
HC—CH2—CH2—O—CH3
O
2、核磁共振氢谱—确定氢的类别和数目
不同化学环境的氢原子(等效氢原子)因产生共振时吸收的频率不同,被核磁共振仪记录下来的吸收峰的面积不同。
所以,可以从核磁共振谱图上推知氢原子的类型及数目,从而推断有机物的结构。
由P23的图谱可知
:
未知物A的结构应为CH3CH2OH
例:CH3CH2OH、CH3—O—CH3两种物质来说,
除了碳原子、氧原子的位置、连接方式不同外,氢原子的连接方式也不同、所处的环境不同,即等效氢的种数不同。
小组讨论:未知物的分子式为C2H6O,有哪些方法推断其结构?------分析思路?
⑴、化学性质:
⑵、物理性质:
由组成通式(CnH2n+2O)写出可能的结构
酯化反应、加入Na、消去反应、、、
红外光谱、核磁共振氢谱
[练习下列有机物分子在核磁共振氢谱中只给出一种信号(例如:课本P23---图1-20
)的是
A
HCHO
B
CH3OH
C
HCOOH
D
CH3COOCH3
[练习2]
分子式为C3H6O2的有机物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断有机物的组成可能是(写结构简式)
。
CH3COOCH3
HCOOCH2CH3
2种H;3H:3H
3种H;3H:2H:1H
HOOCCH2CH3
练习3:下列物质有几种不同环境的H?
C
C
⑴C-C-C-C
⑵
C-C-C-C-C
C-C
C
⑶
C
⑹
CH3COOCH3
C-C-C=C
O
C=C
⑺
CH3
C
CH3
⑷
-
CH3
⑸
-C
(CH3)
3
3
4
3
1
1
1
2
⑻
-
CHOH-CH3
⑼
H3CO
OCH3
⑽
分类统计:对称轴上的H
对称区域上的H
3+3
2+2
0+3
⑻
⑼
⑽
提升练习:
核磁共振氢谱上观察到氢原子给出的峰只有一种情况:
⑴分子式为C3H6
、C4H8
,则该烃结构简式分别为?
⑵分子式为C8H8,则该烃结构简式为?
三维空间感受能力
平面感受能力
习惯命名为:立方烷
课后阅读:
晶体洗涤的研究
化学高考试题中,经常涉及对所得晶体或固体残渣进行洗涤,洗涤大有讲究,要考虑几个方面,如:为什么要洗涤?用什么洗涤?怎样洗涤?怎样证明已经洗涤干净?等等。
一、关于洗涤的目的
关于晶体或残渣为什么要洗涤,即洗涤的目的,常见有:
①除去杂质:除去晶体表面的可溶性杂质。
②提高产率:洗涤过滤所得到的残渣,把有用的物质,如目标产物尽可能洗出来。
③防止污染环境:如果滤渣表面有一些对环境有害的物质,如重金属离子或CN-,为了防止污染环境,往往对残渣进行洗涤。
晶体洗涤的研究
一、关于洗涤的目的
二、关于洗涤的试剂
对于用什么洗涤,我们经常可以用以下几种:
①蒸馏水;
②冷水;
③有机溶剂,如酒精、丙酮等;
④该物质的饱和溶液。
一般经常用的洗涤剂是蒸馏水,如果用其他的洗涤剂,必有其“独特”之处。用冷水可适当降低晶体因为溶解而造成损失。用酒精等有机溶剂洗涤的好处常见有:可以降低晶体因溶解而造成损失,可以除去表面的可溶性杂质和水分;酒精易挥发,晶体易干燥。注意:有特殊的物质其溶解度随温度升高而下降的,可以采用热蒸馏水洗涤。用该物质的饱和溶液可以使因为溶解造成的损失降到最低。
晶体洗涤的研究
一、关于洗涤的目的
二、关于洗涤的试剂
三、关于洗涤的方法
洗涤的正确方法是:让过滤后的晶体继续留在过滤器中,加洗涤剂浸没过晶体,让洗涤剂自然流下,重复2-3次即可。注意点:在洗涤过程中不能搅拌,因为滤纸已经很润湿,如果搅拌就很容易搅破滤纸,这样晶体会淋失,从而造成晶体损失。
分离、提纯
思考:物质的分离与提纯有什么区别?
下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)NaCl(泥沙)
(2)酒精(水)
(3)甲烷(乙烯)
(4)乙酸乙酯(乙酸)
(5)溴水(水)
(6)
KNO3
(NaCl)
比如:有氯化钠、氯化钙的混合物,
如何提纯氯化钠?如何分离二者?
常用的分离、提纯物质的方法有哪些?
