云南省昆明市官渡区第一中学2020届高三上学期开学考试化学试题
文档属性
| 名称 | 云南省昆明市官渡区第一中学2020届高三上学期开学考试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 558.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-27 00:00:00 | ||
图片预览



文档简介
官渡一中高三年级19—20学年上学期开学考试
化
学
试
卷
(试卷满分100分,考试时间90分钟)
可能用到的相对原子质量:
H—1、C—12、N—14、O—16、Na—23、S—32、Cu—64
第Ⅰ卷(选择题
共42分)
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个正确答案)
1、下列生活中常见物质的用途与其还原性有关的是(??)
A.
碘酒中的碘
B.
暖宝宝中的铁粉
C.
抗酸药中的氢氧化铝
D.
尿不湿中的聚丙烯酸钠
?
?
?
?
2、NA表示阿伏伽德罗常数,下列说法错误的是(?
)
A.1mol
乙烯中含有的化学键和1mol
乙烷中含有的化学键数目不相同
B.10g质量分数为46%的乙醇水溶液中氧原子数目为0.4NA
C.电解精炼铜时,当电路中转移2NA个电子,阳极溶解64g铜
D.常温下,78g苯中含有6NA个C-H键
3、对下列过程的化学用语表述正确的是(??
)
A.用硫酸铜溶液除去乙炔中的硫化氢气体:H2S+Cu2+=CuS↓+2H+
B.向氯化铝溶液中滴入过量氨水:Al3++4OH-=AlO2-+2H2O
C.用电子式表示Na和Cl形成NaCl的过程:
D.钢铁发生电化学腐蚀的负极反应:Fe-3e-=Fe3+
4、下列实验操作不当或实验结论错误的是(??
)
A.用过氧化氢溶液制取氧气时,加少量MnO2以加快反应速率
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂
C.用铂丝蘸取某碱金属的化合物溶液灼烧,火焰呈黄色,证明该化合物是钠盐
D.给试管里的液体加热,液体体积一般不超过试管容积的三分之一
5、短周期主族元素X、Y、Z、W的原子序数依次增加,X的某种单质可用作粮仓中的粮食保护气,Y和Z原子的最外层电子数之和等于W原子的最外层电子数,Z原子核外电子数是W原子最外层电子数的2倍。下列说法正确的是(??
)
A.原子半径大小为YB.Z的简单氢化物的热稳定性比W的弱
C.Y、W的离子具有相同的电子层结构
D.Z的最高价氧化物对应水化物的酸性比W的强
6、常温下,向10mL
0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是(??
)
A.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)2c(Na+)
B.Ksp(CuS)的数量级为10-36
C.a、b、c三点溶液中,b点水的电离程度最大
D.c点溶液中:c(Cl-)=2c(Na+)
7、混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是(
?
)
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH-向甲移动
C.放电时正极反应式为:
NiOOH+H2O+e_
=
Ni(OH)2+OH_
D.电极总反应式为:MH+
NiOOH
?M+
Ni(OH)2
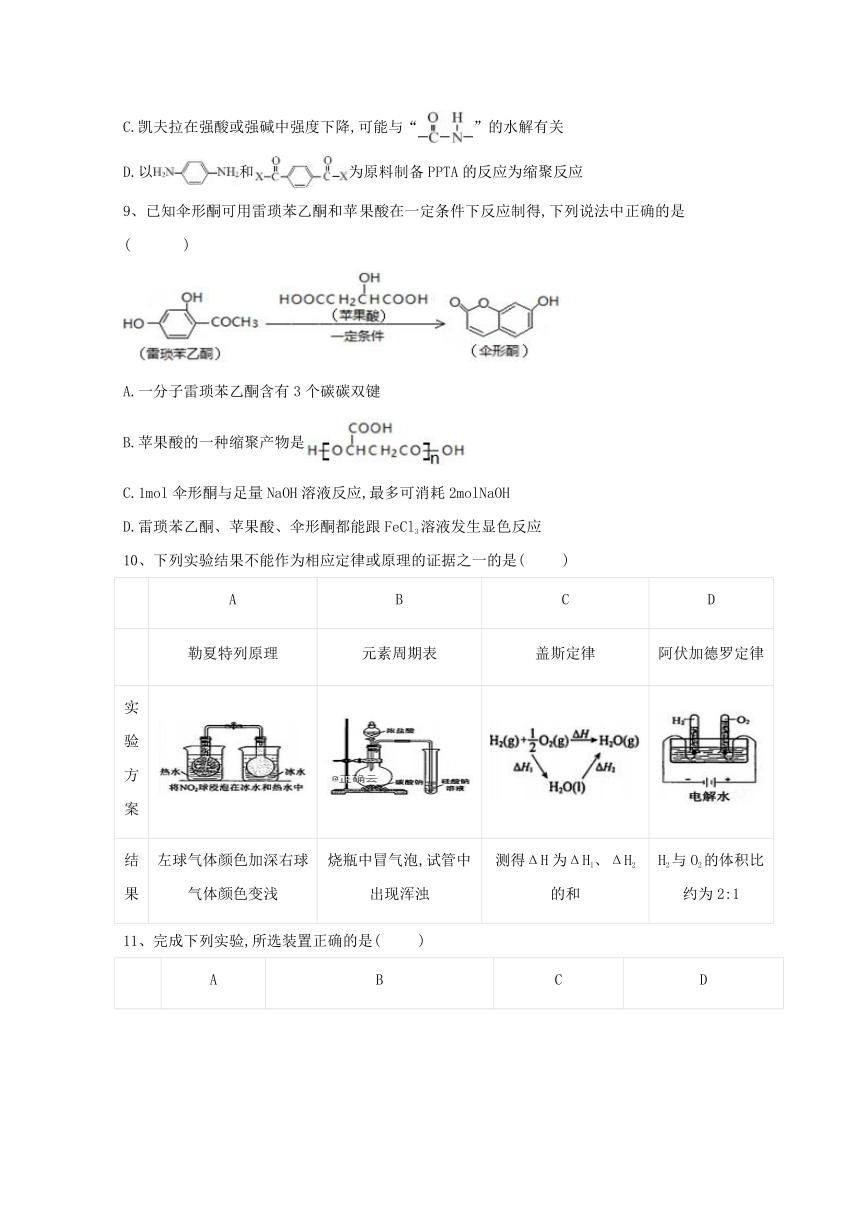
8、凯夫拉是一种高强度、耐腐蚀的芳纶纤维,军事上称为“装甲卫士”,但长期浸渍在强酸或强碱中强度有所下降。下表中是凯夫拉的两种结构,
以下说法不正确的是(??
)
名称
芳纶1313(PMTA)
芳纶1414(PPTA)
结构简式
A.PMTA和PPTA互为同分异构体
B.“芳纶1313”、“芳纶1414”中的数字表示苯环上取代基的位置
C.凯夫拉在强酸或强碱中强度下降,可能与“”的水解有关
D.以和为原料制备PPTA的反应为缩聚反应
9、已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法中正确的是(??
?)
?
A.一分子雷琐苯乙酮含有3个碳碳双键
B.苹果酸的一种缩聚产物是
C.1mol伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH
D.雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
10、下列实验结果不能作为相应定律或原理的证据之一的是(??
)
?
A
B
C
D
?
勒夏特列原理
元素周期表
盖斯定律
阿伏加德罗定律
实验方案
结果
左球气体颜色加深右球气体颜色变浅
烧瓶中冒气泡,试管中出现浑浊
测得ΔH为ΔH1、ΔH2的和
H2与O2的体积比约为2:1
11、完成下列实验,所选装置正确的是(??
)
?
A
B
C
D
实验目的
实验室制备乙烯
分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃)
分离KCl和NH4Cl固体混合物
实验室用纯碱和稀硫酸制备二氧化碳
实验装置
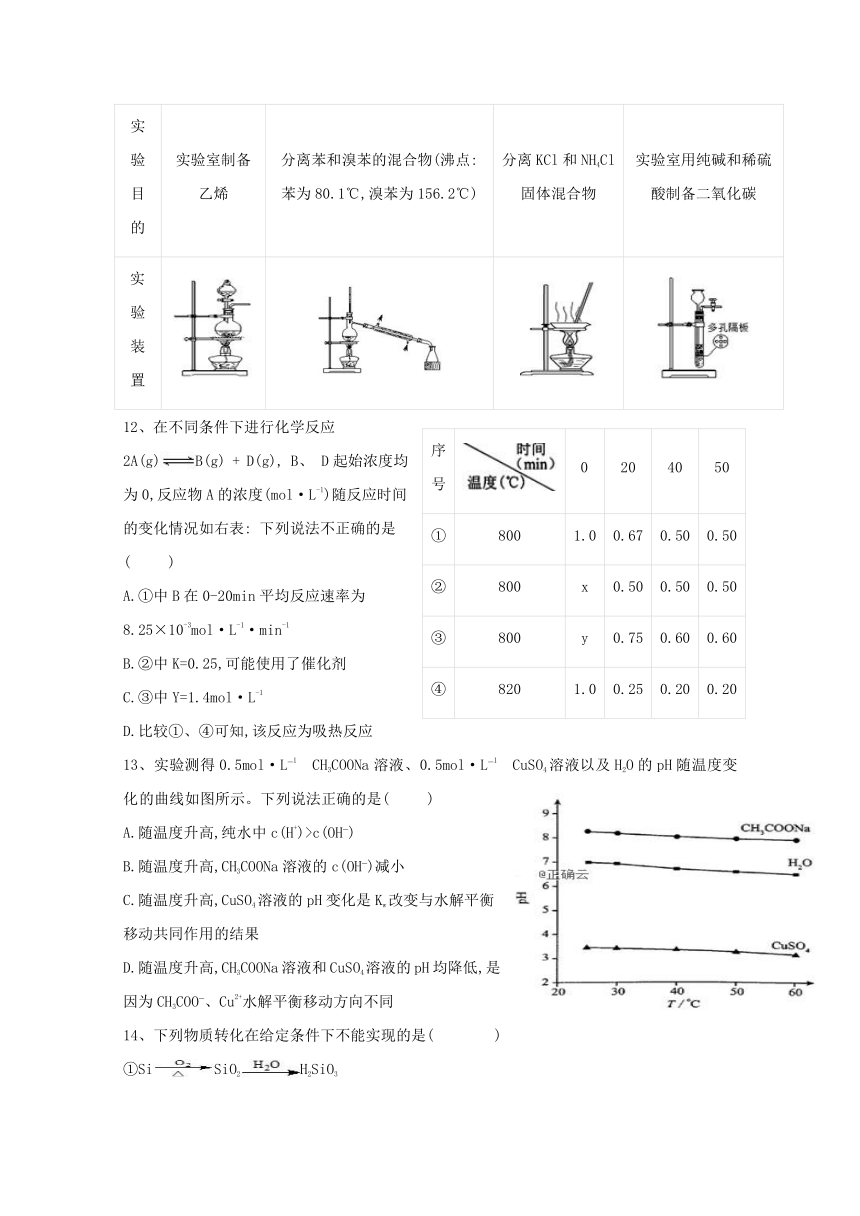
序号
0
20
40
50
①
800
1.0
0.67
0.50
0.50
②
800
x
0.50
0.50
0.50
③
800
y
0.75
0.60
0.60
④
820
1.0
0.25
0.20
0.20
12、在不同条件下进行化学反应2A(g)B(g)
+
D(g),
B、
D起始浓度均为0,反应物A的浓度(mol·L-1)随反应时间的变化情况如右表:
下列说法不正确的是(??
)
A.①中B在0-20min平均反应速率为
8.25×10-3mol·L-1·min-1
B.②中K=0.25,可能使用了催化剂
C.③中Y=1.4mol·L-1
D.比较①、④可知,该反应为吸热反应
13、实验测得0.5mol·L?1?CH3COONa溶液、0.5mol·L?1?CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是(??
)
A.随温度升高,纯水中c(H+)>c(OH?)
B.随温度升高,CH3COONa溶液的c(OH?)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO?、Cu2+水解平衡移动方向不同
14、下列物质转化在给定条件下不能实现的是(??
)
①SiSiO2H2SiO3
②SSO3H2SO4
③CCO2Na2CO3
④NaNa2O2NaOH
A.①②③
?????B.①②④
?????C.②③④
?????D.①②③④
第II卷(填空题
共58分)
15、(15分)球形纳米银粉是一种重要的无机功能材料,被广泛应用于装饰材料、电接触材料、感光材料、催化剂、医药和抗菌材料等众多领域。从含Ag+的废定影液中回收并制备球形纳米银粉工艺流程图如下:
请回答下列问题:
(1)硝酸中所含元素的原子半径由小到大的顺序
;
Na在周期表中的位置:
;N2H4的电子式:____________________
(2)为使Na2S溶液中的值减小,可加入的物质是
A.盐酸
B.适量KOH
C.适量NaOH
D.适量CH3COONa
(3)写出置换过程的离子反应方程式
(4)若氧化精制过程产生等体积的NO2和NO混合气体,写出HNO3与Ag反应的化学反应方程式
(5)右图1、图2分别是HNO3浓度、浸取时间对银回收的影响,则最佳的浓度和时间分别是
%;
min。
(6)加入N2H4·H2O还原前要将AgNO3溶液的pH调节至5~6,得到Ag的产率最高,pH>6时,银的产率降低的原因为
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L
NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=
mol/L[已知:常温下,Ksp(AgNO2)=2×10-8
,Ksp(AgCl)=1.8×10-10]
16、(14分)某课题组设计实验探究铜和浓硫酸的反应。实验装置如图所示。
实验操作和现象如下:
实验操作
现象
加热之前,打开夹子K,通入一段时间,关闭K,点燃酒精灯
A装置烧瓶中产生大量白雾;B中产生白色沉淀;C中溶液褪色
回答下列问题:
(1)点燃酒精灯之前,通入氮气的目的是_____________________________。
(2)A装置导出的气体中混有水蒸气和_______________________________。
(3)B装置中HCl的作用是___________________________________________。
(4)实验完毕后,取出烧瓶中固体,设计实验探究其成分。査阅资料知,浓硫酸与铜反应可能生成CuS和Cu2S,它们都是难溶于水,也难溶于稀盐酸、稀硫酸的黑色固体,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,残余固体呈黑色。
(ii)取少量残余黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变蓝色,产生无色气泡。取少量上层清液于试管中,滴加氯化钡溶液,产生白色沉淀。
(iii)另取m
g残余黑色固体进行如下实验。
通入足量O2,加热,使硬质玻璃管中的黑色固体充分反应,观察到F瓶中溶液由红色变无色。称得反应后硬质玻璃管中的黑色物质仍然为m
g。
①
由
实验(i)得到蓝色溶液知,烧瓶中固体含有__________________(填
化
学
式
)。
②
由实验(ii)能否得出黑色固体成分是CuS或Cu2S或二者的混合物,_________(填“能”或“否”),理
由
是________________________________________________________。
③
烧瓶中固体不可能含CuO,理由是__________________________。
④
由
实
验
(iii)得出黑色固体是____________________(填化学式)。写出E中发生反应的化学方程式:_________________________________________________。
17、(15分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:
若某反应的平衡常数表达式为,则此反应的热化学方程式为___________________。
(2)N2O5在一定条件下可发生分解反应:,某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为,第2min时体系压强为,则=______________。2-5min内用NO2表示的该反应的平均反应速率为_____________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是_________________(填字母序号)。
a.和的浓度比保持不变
b.容器中压强不再变化
c.
d.气体的密度保持不变
(3)是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:,该反应中正反应速率,逆反应速率,其中、为速率常数,则为____________________(用、表示)。
(4)如图是密闭反应器中按投料后,在200℃、400℃、600℃下,合成反应达到平衡时,混合物中的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是_________________________。
②M点对应的的转化率是___________________。
(5)工业上常用氨水吸收二氧化硫,可生成。判断常温下,溶液的酸碱性并说明判断依据:______________________________________________。(已知:的的)
18、(14分)聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
已知:
(1)A的名称(系统命名):?????
?????,H的分子式为???
???。
(2)写出反应④的反应类型是???????????。
(3)写出反应②的试剂和条件
(4)G的结构简式为??????
???????。
(5)写出反应⑥的化学方程式:_____________________________
(6)C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式:?????????。
(7)利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
高三年级19—20学年上学期开学考试答案
1-14
BCACB
BAABB
BCCD
15、(15分):(1).
(1分);第三周期第ⅠA族(1分);
(2)B(1分)
(
3).
(4)
(5)
30%(1分);6min(1分)
(6)pH过大会有生成,降低产品的纯度
(7)
16、(14分)(1)排尽装置中(1分)(2)
(1分)(3)抑制与反应
(4)①(1分);②否(1分);CuS、与稀硝酸反应的现象相同,且所得溶液中滴加溶液均产生白色沉淀;③烧瓶中剩余的稀硫酸与CuO不能共存;④;
17、(15分)(1)
(2)①7:4(或1.75:1)
0.22mol/(L·min)
②b
(3)
(4)
①200℃(1分)
②75%
(5)显碱性,因为,所以水解程度大(其他合理解释均可)
18、(14分)(1)
1,?2-二氯丙烷(1分)???
C8H12O3(1分)(2)???氧化反应(1分)(3)?NaOH的水溶液
加热(1分)(4)
(5)?
(6)或
(7)(4分)
化
学
试
卷
(试卷满分100分,考试时间90分钟)
可能用到的相对原子质量:
H—1、C—12、N—14、O—16、Na—23、S—32、Cu—64
第Ⅰ卷(选择题
共42分)
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个正确答案)
1、下列生活中常见物质的用途与其还原性有关的是(??)
A.
碘酒中的碘
B.
暖宝宝中的铁粉
C.
抗酸药中的氢氧化铝
D.
尿不湿中的聚丙烯酸钠
?
?
?
?
2、NA表示阿伏伽德罗常数,下列说法错误的是(?
)
A.1mol
乙烯中含有的化学键和1mol
乙烷中含有的化学键数目不相同
B.10g质量分数为46%的乙醇水溶液中氧原子数目为0.4NA
C.电解精炼铜时,当电路中转移2NA个电子,阳极溶解64g铜
D.常温下,78g苯中含有6NA个C-H键
3、对下列过程的化学用语表述正确的是(??
)
A.用硫酸铜溶液除去乙炔中的硫化氢气体:H2S+Cu2+=CuS↓+2H+
B.向氯化铝溶液中滴入过量氨水:Al3++4OH-=AlO2-+2H2O
C.用电子式表示Na和Cl形成NaCl的过程:
D.钢铁发生电化学腐蚀的负极反应:Fe-3e-=Fe3+
4、下列实验操作不当或实验结论错误的是(??
)
A.用过氧化氢溶液制取氧气时,加少量MnO2以加快反应速率
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂
C.用铂丝蘸取某碱金属的化合物溶液灼烧,火焰呈黄色,证明该化合物是钠盐
D.给试管里的液体加热,液体体积一般不超过试管容积的三分之一
5、短周期主族元素X、Y、Z、W的原子序数依次增加,X的某种单质可用作粮仓中的粮食保护气,Y和Z原子的最外层电子数之和等于W原子的最外层电子数,Z原子核外电子数是W原子最外层电子数的2倍。下列说法正确的是(??
)
A.原子半径大小为Y
C.Y、W的离子具有相同的电子层结构
D.Z的最高价氧化物对应水化物的酸性比W的强
6、常温下,向10mL
0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是(??
)
A.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)2c(Na+)
B.Ksp(CuS)的数量级为10-36
C.a、b、c三点溶液中,b点水的电离程度最大
D.c点溶液中:c(Cl-)=2c(Na+)
7、混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是(
?
)
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH-向甲移动
C.放电时正极反应式为:
NiOOH+H2O+e_
=
Ni(OH)2+OH_
D.电极总反应式为:MH+
NiOOH
?M+
Ni(OH)2
8、凯夫拉是一种高强度、耐腐蚀的芳纶纤维,军事上称为“装甲卫士”,但长期浸渍在强酸或强碱中强度有所下降。下表中是凯夫拉的两种结构,
以下说法不正确的是(??
)
名称
芳纶1313(PMTA)
芳纶1414(PPTA)
结构简式
A.PMTA和PPTA互为同分异构体
B.“芳纶1313”、“芳纶1414”中的数字表示苯环上取代基的位置
C.凯夫拉在强酸或强碱中强度下降,可能与“”的水解有关
D.以和为原料制备PPTA的反应为缩聚反应
9、已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法中正确的是(??
?)
?
A.一分子雷琐苯乙酮含有3个碳碳双键
B.苹果酸的一种缩聚产物是
C.1mol伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH
D.雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
10、下列实验结果不能作为相应定律或原理的证据之一的是(??
)
?
A
B
C
D
?
勒夏特列原理
元素周期表
盖斯定律
阿伏加德罗定律
实验方案
结果
左球气体颜色加深右球气体颜色变浅
烧瓶中冒气泡,试管中出现浑浊
测得ΔH为ΔH1、ΔH2的和
H2与O2的体积比约为2:1
11、完成下列实验,所选装置正确的是(??
)
?
A
B
C
D
实验目的
实验室制备乙烯
分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃)
分离KCl和NH4Cl固体混合物
实验室用纯碱和稀硫酸制备二氧化碳
实验装置
序号
0
20
40
50
①
800
1.0
0.67
0.50
0.50
②
800
x
0.50
0.50
0.50
③
800
y
0.75
0.60
0.60
④
820
1.0
0.25
0.20
0.20
12、在不同条件下进行化学反应2A(g)B(g)
+
D(g),
B、
D起始浓度均为0,反应物A的浓度(mol·L-1)随反应时间的变化情况如右表:
下列说法不正确的是(??
)
A.①中B在0-20min平均反应速率为
8.25×10-3mol·L-1·min-1
B.②中K=0.25,可能使用了催化剂
C.③中Y=1.4mol·L-1
D.比较①、④可知,该反应为吸热反应
13、实验测得0.5mol·L?1?CH3COONa溶液、0.5mol·L?1?CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是(??
)
A.随温度升高,纯水中c(H+)>c(OH?)
B.随温度升高,CH3COONa溶液的c(OH?)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO?、Cu2+水解平衡移动方向不同
14、下列物质转化在给定条件下不能实现的是(??
)
①SiSiO2H2SiO3
②SSO3H2SO4
③CCO2Na2CO3
④NaNa2O2NaOH
A.①②③
?????B.①②④
?????C.②③④
?????D.①②③④
第II卷(填空题
共58分)
15、(15分)球形纳米银粉是一种重要的无机功能材料,被广泛应用于装饰材料、电接触材料、感光材料、催化剂、医药和抗菌材料等众多领域。从含Ag+的废定影液中回收并制备球形纳米银粉工艺流程图如下:
请回答下列问题:
(1)硝酸中所含元素的原子半径由小到大的顺序
;
Na在周期表中的位置:
;N2H4的电子式:____________________
(2)为使Na2S溶液中的值减小,可加入的物质是
A.盐酸
B.适量KOH
C.适量NaOH
D.适量CH3COONa
(3)写出置换过程的离子反应方程式
(4)若氧化精制过程产生等体积的NO2和NO混合气体,写出HNO3与Ag反应的化学反应方程式
(5)右图1、图2分别是HNO3浓度、浸取时间对银回收的影响,则最佳的浓度和时间分别是
%;
min。
(6)加入N2H4·H2O还原前要将AgNO3溶液的pH调节至5~6,得到Ag的产率最高,pH>6时,银的产率降低的原因为
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L
NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=
mol/L[已知:常温下,Ksp(AgNO2)=2×10-8
,Ksp(AgCl)=1.8×10-10]
16、(14分)某课题组设计实验探究铜和浓硫酸的反应。实验装置如图所示。
实验操作和现象如下:
实验操作
现象
加热之前,打开夹子K,通入一段时间,关闭K,点燃酒精灯
A装置烧瓶中产生大量白雾;B中产生白色沉淀;C中溶液褪色
回答下列问题:
(1)点燃酒精灯之前,通入氮气的目的是_____________________________。
(2)A装置导出的气体中混有水蒸气和_______________________________。
(3)B装置中HCl的作用是___________________________________________。
(4)实验完毕后,取出烧瓶中固体,设计实验探究其成分。査阅资料知,浓硫酸与铜反应可能生成CuS和Cu2S,它们都是难溶于水,也难溶于稀盐酸、稀硫酸的黑色固体,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,残余固体呈黑色。
(ii)取少量残余黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变蓝色,产生无色气泡。取少量上层清液于试管中,滴加氯化钡溶液,产生白色沉淀。
(iii)另取m
g残余黑色固体进行如下实验。
通入足量O2,加热,使硬质玻璃管中的黑色固体充分反应,观察到F瓶中溶液由红色变无色。称得反应后硬质玻璃管中的黑色物质仍然为m
g。
①
由
实验(i)得到蓝色溶液知,烧瓶中固体含有__________________(填
化
学
式
)。
②
由实验(ii)能否得出黑色固体成分是CuS或Cu2S或二者的混合物,_________(填“能”或“否”),理
由
是________________________________________________________。
③
烧瓶中固体不可能含CuO,理由是__________________________。
④
由
实
验
(iii)得出黑色固体是____________________(填化学式)。写出E中发生反应的化学方程式:_________________________________________________。
17、(15分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:
若某反应的平衡常数表达式为,则此反应的热化学方程式为___________________。
(2)N2O5在一定条件下可发生分解反应:,某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为,第2min时体系压强为,则=______________。2-5min内用NO2表示的该反应的平均反应速率为_____________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是_________________(填字母序号)。
a.和的浓度比保持不变
b.容器中压强不再变化
c.
d.气体的密度保持不变
(3)是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:,该反应中正反应速率,逆反应速率,其中、为速率常数,则为____________________(用、表示)。
(4)如图是密闭反应器中按投料后,在200℃、400℃、600℃下,合成反应达到平衡时,混合物中的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是_________________________。
②M点对应的的转化率是___________________。
(5)工业上常用氨水吸收二氧化硫,可生成。判断常温下,溶液的酸碱性并说明判断依据:______________________________________________。(已知:的的)
18、(14分)聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
已知:
(1)A的名称(系统命名):?????
?????,H的分子式为???
???。
(2)写出反应④的反应类型是???????????。
(3)写出反应②的试剂和条件
(4)G的结构简式为??????
???????。
(5)写出反应⑥的化学方程式:_____________________________
(6)C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式:?????????。
(7)利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
高三年级19—20学年上学期开学考试答案
1-14
BCACB
BAABB
BCCD
15、(15分):(1).
(1分);第三周期第ⅠA族(1分);
(2)B(1分)
(
3).
(4)
(5)
30%(1分);6min(1分)
(6)pH过大会有生成,降低产品的纯度
(7)
16、(14分)(1)排尽装置中(1分)(2)
(1分)(3)抑制与反应
(4)①(1分);②否(1分);CuS、与稀硝酸反应的现象相同,且所得溶液中滴加溶液均产生白色沉淀;③烧瓶中剩余的稀硫酸与CuO不能共存;④;
17、(15分)(1)
(2)①7:4(或1.75:1)
0.22mol/(L·min)
②b
(3)
(4)
①200℃(1分)
②75%
(5)显碱性,因为,所以水解程度大(其他合理解释均可)
18、(14分)(1)
1,?2-二氯丙烷(1分)???
C8H12O3(1分)(2)???氧化反应(1分)(3)?NaOH的水溶液
加热(1分)(4)
(5)?
(6)或
(7)(4分)
同课章节目录
