离子反应第一课时
图片预览






文档简介
(共17张PPT)
物质
混和物
纯净物
化合物
(离子)
单质
(电子)
电解质
非电解质
乙醇、蔗糖等大部分有机物,非金属氧化物(水除外),NH3
不是电解质
也不是非电解质
一、酸、碱、盐在水溶液中的电离
酸、碱、盐、水、活泼金属氧化物
小结:
1、电解质和非电解质都是化合物
2、电解质导电要有外界条件:水溶液或熔融状态
3、电解质应是本身电离而导电的化合物
1、下列物质哪些是电解质,那些是非电解质:
①HCl气体, ②石灰乳, ③ 蔗糖,
④ Na2SO4, ⑤ Na2O, ⑥CH3COOH溶液,⑦ CaCO3,⑧CH4 , ⑨SO2
电解质: ① ④ ⑤ ⑦
非电解质: ③ ⑧ ⑨
【思考】酸、碱、盐的水溶液为什么能导电?
【分析】酸、碱、盐的水溶液能导电,是因为它们在水溶液中发生了电离,产生了自由移动的离子。
电离:物质溶于水后或受热熔化时,离解成能够自由移动的离子的过程。
一、酸、碱、盐在水溶液中的电离
条件:溶于水或熔融
结果:产生自由移动的离子
2、电离
以氯化钠溶于水为例,说明电离原理。
【分析】
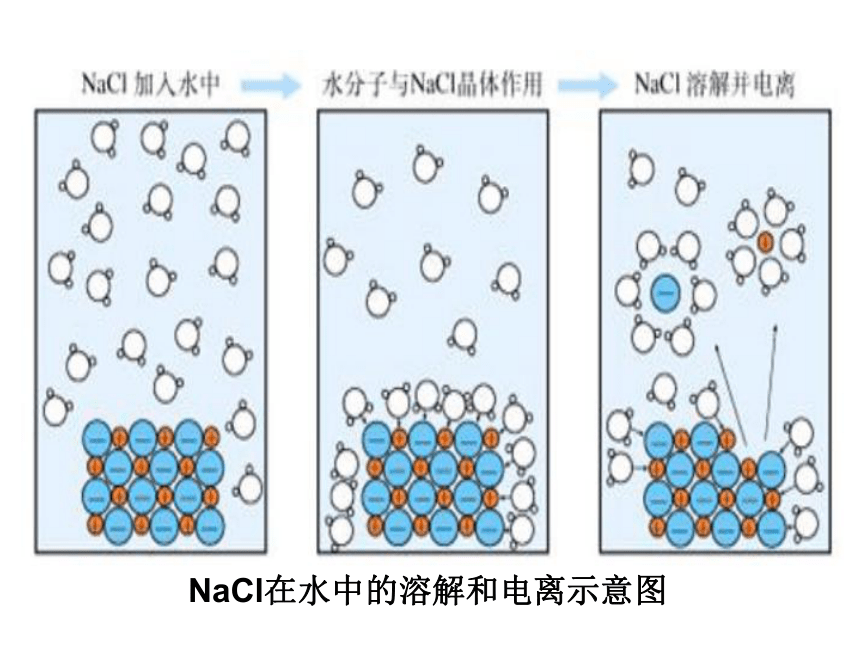
氯化钠晶体是由带正电荷的Na+离子和带负电荷的Cl-离子,通过静电作用按一定规律紧密地排列,构成晶体的离子:Na+和Cl-不能自由移动,因此,NaCl晶体不能导电。
当NaCl溶于水时,由于水分子的作用而减弱了氯化钠晶体中Na+与Cl-之间的静电作用,使Na+与Cl-逐渐脱离晶体表面并形成了自由移动的水合钠离子和水合氯离子(如下图所示)
NaCl在水中的溶解和电离示意图
【进一步分析】
将氯化钠加入到水中,在水分子的作用下,钠离子和氯离子脱离氯化钠晶体表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子,氯化钠发生了电离。
这一过程可以用电离方程式表示,为了简便起见,水合离子仍用离子符号表示。
氯化钠的电离过程可表示为NaCl=Na+ + Cl-
这样的式子我们称为电离方程式。
【探究】
1、写出下列物质的电离方程式:HCl、H2SO4、HNO3
2、根据它们的电离方程式,我们对酸的本质有什么新的认识?
答案:1、HCl=H+ + Cl-;
H2SO4 = 2H+ + SO42-
HNO3= H+ + NO3-
2、HCl、H2SO4、HNO3都能电离出H+,即酸电离出的阳离子都是H+。因此,我们可以这样来定义:电离时生成的阳离子全部是氢离子的化合物叫做酸。
【探究】
请写出NaOH、KOH、Ba(OH)2的电离方程式。我们对碱的本质有什么新的认识?
答案:NaOH=Na+ + OH-
KOH=K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH、KOH、Ba(OH)2都能电离出阴离子OH-。 因此,电离时生成的阴离子全部是 OH-的化合物叫做碱。
【练习3】
请写出Na2SO4、KNO3、NH4Cl的电离方程式。我们对盐的本质有什么新认识?
答案:Na2SO4 =2Na+ + SO42-
KNO3=K+ + NO3- NH4Cl=NH4+ + Cl-
Na2SO4、KNO3、 NH4Cl电离出来的是金属阳离子(包括NH4+)和酸根阴离子。因此,电离时能电离出金属阳离子和酸根阴离子的化合物叫做盐。
【归纳】
通过分析上述电离的特点,总结出酸、碱、盐的定义。
酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
盐:电离时能生成金属阳离子(包括NH4+)和酸根阴离子的化合物叫做盐。
书写电离方程式时的注意事项:
1、阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
2、阴、阳离子的个数由化学式决定,带电荷数由化合价决定。
3、强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根(HCO3-、HSO3-等)不能拆。
书写电离方程式要注意什么?
1、正确书写离子符号
2、遵守质量守恒定律和电荷守恒定律
H2+
H2SO4
SO42-
+
MgCl2
Mg2+
+
Cl-
FeCl3
Fe2+
+
3Cl-
【练习】
写出下列物质在水溶液中的电离方程式
(1)硫酸氢钠 (2)氯化铁
(3)硫酸铝(4)碳酸氢钡
物质
混和物
纯净物
化合物
(离子)
单质
(电子)
电解质
非电解质
乙醇、蔗糖等大部分有机物,非金属氧化物(水除外),NH3
不是电解质
也不是非电解质
一、酸、碱、盐在水溶液中的电离
酸、碱、盐、水、活泼金属氧化物
小结:
1、电解质和非电解质都是化合物
2、电解质导电要有外界条件:水溶液或熔融状态
3、电解质应是本身电离而导电的化合物
1、下列物质哪些是电解质,那些是非电解质:
①HCl气体, ②石灰乳, ③ 蔗糖,
④ Na2SO4, ⑤ Na2O, ⑥CH3COOH溶液,⑦ CaCO3,⑧CH4 , ⑨SO2
电解质: ① ④ ⑤ ⑦
非电解质: ③ ⑧ ⑨
【思考】酸、碱、盐的水溶液为什么能导电?
【分析】酸、碱、盐的水溶液能导电,是因为它们在水溶液中发生了电离,产生了自由移动的离子。
电离:物质溶于水后或受热熔化时,离解成能够自由移动的离子的过程。
一、酸、碱、盐在水溶液中的电离
条件:溶于水或熔融
结果:产生自由移动的离子
2、电离
以氯化钠溶于水为例,说明电离原理。
【分析】
氯化钠晶体是由带正电荷的Na+离子和带负电荷的Cl-离子,通过静电作用按一定规律紧密地排列,构成晶体的离子:Na+和Cl-不能自由移动,因此,NaCl晶体不能导电。
当NaCl溶于水时,由于水分子的作用而减弱了氯化钠晶体中Na+与Cl-之间的静电作用,使Na+与Cl-逐渐脱离晶体表面并形成了自由移动的水合钠离子和水合氯离子(如下图所示)
NaCl在水中的溶解和电离示意图
【进一步分析】
将氯化钠加入到水中,在水分子的作用下,钠离子和氯离子脱离氯化钠晶体表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子,氯化钠发生了电离。
这一过程可以用电离方程式表示,为了简便起见,水合离子仍用离子符号表示。
氯化钠的电离过程可表示为NaCl=Na+ + Cl-
这样的式子我们称为电离方程式。
【探究】
1、写出下列物质的电离方程式:HCl、H2SO4、HNO3
2、根据它们的电离方程式,我们对酸的本质有什么新的认识?
答案:1、HCl=H+ + Cl-;
H2SO4 = 2H+ + SO42-
HNO3= H+ + NO3-
2、HCl、H2SO4、HNO3都能电离出H+,即酸电离出的阳离子都是H+。因此,我们可以这样来定义:电离时生成的阳离子全部是氢离子的化合物叫做酸。
【探究】
请写出NaOH、KOH、Ba(OH)2的电离方程式。我们对碱的本质有什么新的认识?
答案:NaOH=Na+ + OH-
KOH=K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH、KOH、Ba(OH)2都能电离出阴离子OH-。 因此,电离时生成的阴离子全部是 OH-的化合物叫做碱。
【练习3】
请写出Na2SO4、KNO3、NH4Cl的电离方程式。我们对盐的本质有什么新认识?
答案:Na2SO4 =2Na+ + SO42-
KNO3=K+ + NO3- NH4Cl=NH4+ + Cl-
Na2SO4、KNO3、 NH4Cl电离出来的是金属阳离子(包括NH4+)和酸根阴离子。因此,电离时能电离出金属阳离子和酸根阴离子的化合物叫做盐。
【归纳】
通过分析上述电离的特点,总结出酸、碱、盐的定义。
酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
盐:电离时能生成金属阳离子(包括NH4+)和酸根阴离子的化合物叫做盐。
书写电离方程式时的注意事项:
1、阴阳离子拆开写,但原子团不能拆,
如:NO3-、SO42-、OH-、NH4+、CO32-等
2、阴、阳离子的个数由化学式决定,带电荷数由化合价决定。
3、强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根(HCO3-、HSO3-等)不能拆。
书写电离方程式要注意什么?
1、正确书写离子符号
2、遵守质量守恒定律和电荷守恒定律
H2+
H2SO4
SO42-
+
MgCl2
Mg2+
+
Cl-
FeCl3
Fe2+
+
3Cl-
【练习】
写出下列物质在水溶液中的电离方程式
(1)硫酸氢钠 (2)氯化铁
(3)硫酸铝(4)碳酸氢钡
