离子反应
图片预览







文档简介
(共42张PPT)
一、复习——我们上一节主要学了什么?
1、离子反应
2、离子方程式的书写
书写四步中:“写”是基础, “改”是关键,“删” 是途径,而“查”是保证
练一练:用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和
2、硫酸中加入氢氧化钠溶液
3、澄清石灰水中滴入硝酸
H+ + OH- == H2O
H+ + OH- == H2O
H+ + OH- == H2O
启示:
①揭示了离子反应的实质
②不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。
离子方程式的含义:
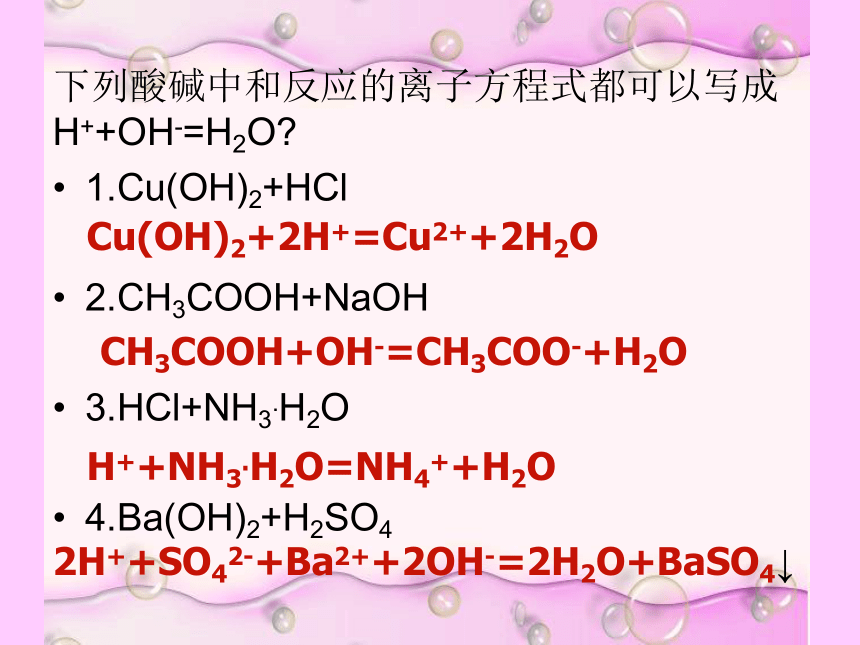
下列酸碱中和反应的离子方程式都可以写成 H++OH-=H2O
1.Cu(OH)2+HCl
2.CH3COOH+NaOH
3.HCl+NH3.H2O
4.Ba(OH)2+H2SO4
Cu(OH)2+2H+=Cu2++2H2O
CH3COOH+OH-=CH3COO-+H2O
H++NH3.H2O=NH4++H2O
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
小结:H++OH-=H2O这一离子方程式只能表示强酸和强碱生成可溶性盐和水的这一类型的中和反应。
b、书写离子方程式应注意的问题:
⑴凡是不在溶液中进行的反应一般不
能写离子方程式。
△
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
如:NH4Cl固体与Ca(OH)2固体混合加热,
只能写化学方程式。
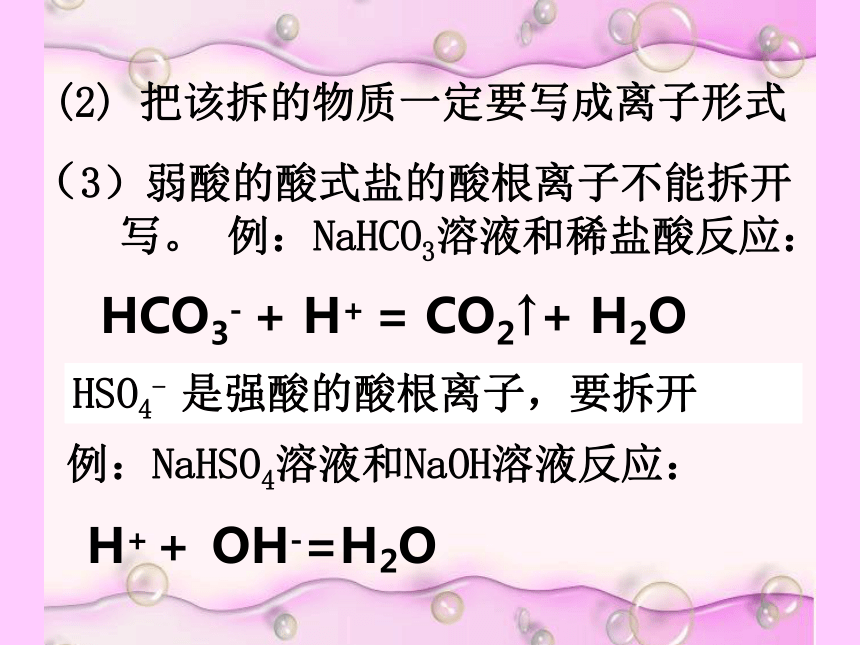
(2) 把该拆的物质一定要写成离子形式
(3)弱酸的酸式盐的酸根离子不能拆开
写。 例:NaHCO3溶液和稀盐酸反应:
HCO3- + H+ = CO2↑+ H2O
HSO4- 是强酸的酸根离子,要拆开
例:NaHSO4溶液和NaOH溶液反应:
H++ OH-=H2O
⑷对于微溶物的处理:
①在生成物中有微溶物,微溶物用化
学式。
②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。
③当反应物里有微溶物处于浊液或固
态,应写化学式。
如:Ca(OH)2+ 2HCl== CaCl2+ 2H2O
OH- + H+== H2O
练习1、下列离子方程式中正确的是( )
A、向碳酸钠溶液中加入盐酸
CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
Fe + Fe3+=2Fe2+
C、金属钠与水反应生成氢氧化钠和氢气
Na + H2O=Na++OH-+H2↑
D、氯化铵晶体和石灰粉共热产生氨气
NH4+ +OH-=NH3 ↑+H2O
△
A
(注意:不是在溶液中进行的反应,不能用离子方程式表示。)
2、下列离子方程式中,错误的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、纯碱水和硝酸反应
CO32- +2H+ =H2O + CO2↑
C、硫酸铵稀溶液和氢氧化钠溶液反应
NH4++OH-=NH3·H2O
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO_ + H2O
A
错例分析:指出下列离子方程式属于哪种错误,并改正
1、氢氧化铁与盐酸反应:H++OH-=H2O
2、石灰石与盐酸反应: CO32-+2H+=CO2↑+H2O
3、碳酸钠与醋酸反应: CO32-+2H+=CO2↑+H2O
4、铁和稀硫酸反应 : 2Fe+6H+=2Fe3++3H2↑
5、金属钠和水反应: Na+2H2O=Na++2OH-+H2↑
应为:
应为:
应为:
应为:
应为:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
Fe + 2H+ = Fe2+ + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
6、硫酸与氢氧化钡溶液的反应 :
H++SO42-+OH-+Ba2+=BaSO4↓+H2O
Ba2++SO42-=BaSO4↓
7、氯化钠和硝酸银溶液反应 :
Na++Cl-+Ag++NO3-=AgCl↓+Na++NO3-
8、氯化钠固体和浓硫酸强热制氯化氢 :
H++Cl-=HCl↑
应为:
应为:
该反应没有离子方程式
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
Cl- + Ag+ = AgCl↓
对不对?
1、碳酸钙与盐酸溶液反应
2、碳酸钾溶液与氢氧化钡溶液反应
3、锌和硫酸铜溶液反应
4、二氧化碳与澄清石灰水反应
练习、写出下列反应的离子方程式
5、氧化铁与盐酸溶液反应
6、向NaOH浓溶液中滴加CaCl2溶液
7、稀硫酸和氢氧化钡反应
(3)、离子方程式正误判断
1、以客观事实为依据
如:铁与稀盐酸反应
2Fe+6H+ = 2Fe3++3H2↑
2、以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+ = Al3++H2↑
3、以电荷守恒为依据
Fe3++Fe = 2Fe2+
4、以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
4、下列四个图示中,能表示向石灰水中通CO2气体至过量的是
( )
B
写出变化过程中发生的有关反应的离子方程式:
Ca2+ + 2OH- + CO2 = CaCO3 ↓+ H2O
CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
(三).离子反应发生的条件
编号 (1) (2) (3)
实验
现象 有大量气泡产生
解释
与
结论
BaCl2溶液
Na2SO4溶液
有白色沉淀生成
盐酸溶液
Na2CO3溶液
稀盐酸
NaOH溶液、酚酞
溶液红色褪去
Ba2++SO42-=BaSO4 ↓
H++OH-=H2 O
H++CO32-=H2O+CO2↑
(三).离子反应发生的条件
(1)生成难溶于水的物质
(2)生成难电离的物质
(H2O、弱酸、弱碱等)
(3)生成易挥发性的物质(气体)
共同特点
反应后
离子浓度
减小
(四)离子反应的特点:
离子反应总是向着某种离子浓度减小的方向进行
三、离子反应的应用
1.判断离子能否大量共存
这是离子能否反应的问题,掌握酸、碱、盐之间的反应能否发生:凡能生成难溶物质、挥发性物质或难电离的物质的离子均不能大量共存。
下列各组离子能在溶液中大量共存的是( )
A.Fe3+ Na+ NO3- OH- B.NH4+ Fe3+ SO42- NO3-
C.SO42- Cl- Ca2+ Mg2+ D.Ba2+ K+ CO32- Cl-
B
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、
Ca2+与SO42-等
⑵生成气体或挥发性物质:
NH4+与OH-
H+与CO32-、H+与HCO3-、H+与S2- 、H+与HS-、 H+与SO32-等
⑶生成难电离物质(即弱电解质):
H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+生成的弱碱;
H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
附加隐含条件的应用规律:
⑴ 溶液无色透明时,则溶液中一定没 有色 离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等
⑵ 强碱性溶液中肯定不存在与OH-反应的离子
⑶强酸性溶液中肯定不存在与H+反应的离子
7、将 离子方程式 改写成 化学方程式
H+
若有还原性离子(如S2-)不选用硝酸
强酸(硫酸,盐酸等)
OH-
可溶性强碱(NaOH, KOH 等)
酸根离子
钾盐、钠盐、铵盐
金属阳离子
强酸盐(硫酸盐,氯化物,
硝酸盐)
关键在选准离子方程式中各离子所对应的物质
练习:将下列 离子方程式 改写成 化学方程式
⑴ CO32- + 2H+ = H2O + CO2
⑵ Cu2++ 2OH- = Cu(OH)2
⑶ S2- + 2H+ = H2S
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
Na2S + 2HCl = 2NaCl + H2S
一、复习——我们上一节主要学了什么?
1、离子反应
2、离子方程式的书写
书写四步中:“写”是基础, “改”是关键,“删” 是途径,而“查”是保证
练一练:用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和
2、硫酸中加入氢氧化钠溶液
3、澄清石灰水中滴入硝酸
H+ + OH- == H2O
H+ + OH- == H2O
H+ + OH- == H2O
启示:
①揭示了离子反应的实质
②不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。
离子方程式的含义:
下列酸碱中和反应的离子方程式都可以写成 H++OH-=H2O
1.Cu(OH)2+HCl
2.CH3COOH+NaOH
3.HCl+NH3.H2O
4.Ba(OH)2+H2SO4
Cu(OH)2+2H+=Cu2++2H2O
CH3COOH+OH-=CH3COO-+H2O
H++NH3.H2O=NH4++H2O
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
小结:H++OH-=H2O这一离子方程式只能表示强酸和强碱生成可溶性盐和水的这一类型的中和反应。
b、书写离子方程式应注意的问题:
⑴凡是不在溶液中进行的反应一般不
能写离子方程式。
△
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
如:NH4Cl固体与Ca(OH)2固体混合加热,
只能写化学方程式。
(2) 把该拆的物质一定要写成离子形式
(3)弱酸的酸式盐的酸根离子不能拆开
写。 例:NaHCO3溶液和稀盐酸反应:
HCO3- + H+ = CO2↑+ H2O
HSO4- 是强酸的酸根离子,要拆开
例:NaHSO4溶液和NaOH溶液反应:
H++ OH-=H2O
⑷对于微溶物的处理:
①在生成物中有微溶物,微溶物用化
学式。
②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。
③当反应物里有微溶物处于浊液或固
态,应写化学式。
如:Ca(OH)2+ 2HCl== CaCl2+ 2H2O
OH- + H+== H2O
练习1、下列离子方程式中正确的是( )
A、向碳酸钠溶液中加入盐酸
CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
Fe + Fe3+=2Fe2+
C、金属钠与水反应生成氢氧化钠和氢气
Na + H2O=Na++OH-+H2↑
D、氯化铵晶体和石灰粉共热产生氨气
NH4+ +OH-=NH3 ↑+H2O
△
A
(注意:不是在溶液中进行的反应,不能用离子方程式表示。)
2、下列离子方程式中,错误的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、纯碱水和硝酸反应
CO32- +2H+ =H2O + CO2↑
C、硫酸铵稀溶液和氢氧化钠溶液反应
NH4++OH-=NH3·H2O
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO_ + H2O
A
错例分析:指出下列离子方程式属于哪种错误,并改正
1、氢氧化铁与盐酸反应:H++OH-=H2O
2、石灰石与盐酸反应: CO32-+2H+=CO2↑+H2O
3、碳酸钠与醋酸反应: CO32-+2H+=CO2↑+H2O
4、铁和稀硫酸反应 : 2Fe+6H+=2Fe3++3H2↑
5、金属钠和水反应: Na+2H2O=Na++2OH-+H2↑
应为:
应为:
应为:
应为:
应为:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
Fe + 2H+ = Fe2+ + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
6、硫酸与氢氧化钡溶液的反应 :
H++SO42-+OH-+Ba2+=BaSO4↓+H2O
Ba2++SO42-=BaSO4↓
7、氯化钠和硝酸银溶液反应 :
Na++Cl-+Ag++NO3-=AgCl↓+Na++NO3-
8、氯化钠固体和浓硫酸强热制氯化氢 :
H++Cl-=HCl↑
应为:
应为:
该反应没有离子方程式
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
Cl- + Ag+ = AgCl↓
对不对?
1、碳酸钙与盐酸溶液反应
2、碳酸钾溶液与氢氧化钡溶液反应
3、锌和硫酸铜溶液反应
4、二氧化碳与澄清石灰水反应
练习、写出下列反应的离子方程式
5、氧化铁与盐酸溶液反应
6、向NaOH浓溶液中滴加CaCl2溶液
7、稀硫酸和氢氧化钡反应
(3)、离子方程式正误判断
1、以客观事实为依据
如:铁与稀盐酸反应
2Fe+6H+ = 2Fe3++3H2↑
2、以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+ = Al3++H2↑
3、以电荷守恒为依据
Fe3++Fe = 2Fe2+
4、以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
4、下列四个图示中,能表示向石灰水中通CO2气体至过量的是
( )
B
写出变化过程中发生的有关反应的离子方程式:
Ca2+ + 2OH- + CO2 = CaCO3 ↓+ H2O
CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
(三).离子反应发生的条件
编号 (1) (2) (3)
实验
现象 有大量气泡产生
解释
与
结论
BaCl2溶液
Na2SO4溶液
有白色沉淀生成
盐酸溶液
Na2CO3溶液
稀盐酸
NaOH溶液、酚酞
溶液红色褪去
Ba2++SO42-=BaSO4 ↓
H++OH-=H2 O
H++CO32-=H2O+CO2↑
(三).离子反应发生的条件
(1)生成难溶于水的物质
(2)生成难电离的物质
(H2O、弱酸、弱碱等)
(3)生成易挥发性的物质(气体)
共同特点
反应后
离子浓度
减小
(四)离子反应的特点:
离子反应总是向着某种离子浓度减小的方向进行
三、离子反应的应用
1.判断离子能否大量共存
这是离子能否反应的问题,掌握酸、碱、盐之间的反应能否发生:凡能生成难溶物质、挥发性物质或难电离的物质的离子均不能大量共存。
下列各组离子能在溶液中大量共存的是( )
A.Fe3+ Na+ NO3- OH- B.NH4+ Fe3+ SO42- NO3-
C.SO42- Cl- Ca2+ Mg2+ D.Ba2+ K+ CO32- Cl-
B
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Br-、
Ca2+与SO42-等
⑵生成气体或挥发性物质:
NH4+与OH-
H+与CO32-、H+与HCO3-、H+与S2- 、H+与HS-、 H+与SO32-等
⑶生成难电离物质(即弱电解质):
H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+生成的弱碱;
H+与OH-生成水
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
附加隐含条件的应用规律:
⑴ 溶液无色透明时,则溶液中一定没 有色 离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等
⑵ 强碱性溶液中肯定不存在与OH-反应的离子
⑶强酸性溶液中肯定不存在与H+反应的离子
7、将 离子方程式 改写成 化学方程式
H+
若有还原性离子(如S2-)不选用硝酸
强酸(硫酸,盐酸等)
OH-
可溶性强碱(NaOH, KOH 等)
酸根离子
钾盐、钠盐、铵盐
金属阳离子
强酸盐(硫酸盐,氯化物,
硝酸盐)
关键在选准离子方程式中各离子所对应的物质
练习:将下列 离子方程式 改写成 化学方程式
⑴ CO32- + 2H+ = H2O + CO2
⑵ Cu2++ 2OH- = Cu(OH)2
⑶ S2- + 2H+ = H2S
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
Na2S + 2HCl = 2NaCl + H2S
