化学能与电能
图片预览







文档简介
(共63张PPT)
第一课时
有些人把能源分为一次能源和二次能
源,请问太阳能和电能属于那一类呢?
一次能源:直接从自然界取得的能源,
例如流水、风力、原煤、石油、天然
气、天然铀矿等。
想一想
二次能源:一次能源经过加工、转换得到的能源,例如电力、蒸汽等。
【资料卡片】
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
水电站
火电站
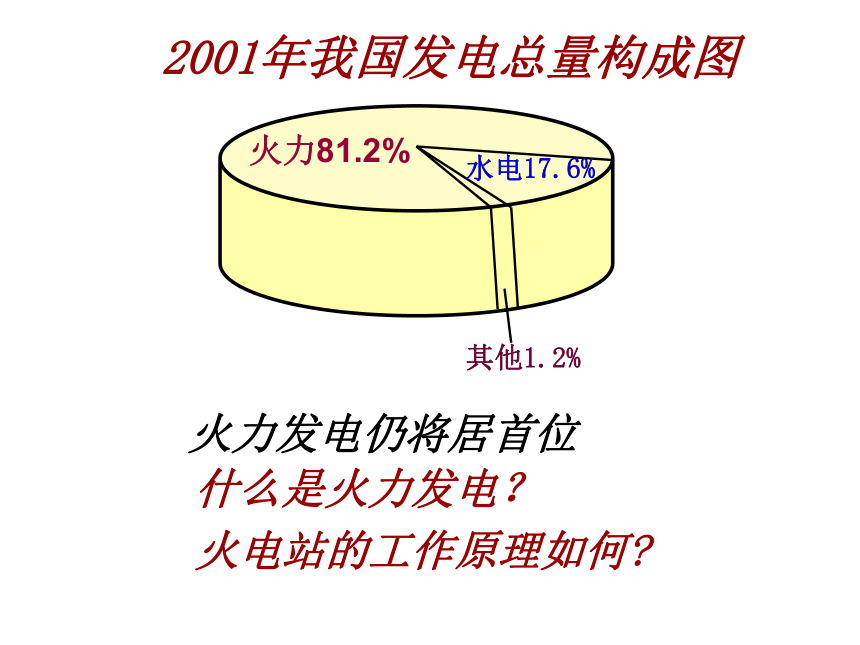
水电17.6%
其他1.2%
2001年我国发电总量构成图
火力81.2%
火力发电仍将居首位
什么是火力发电?
火电站的工作原理如何
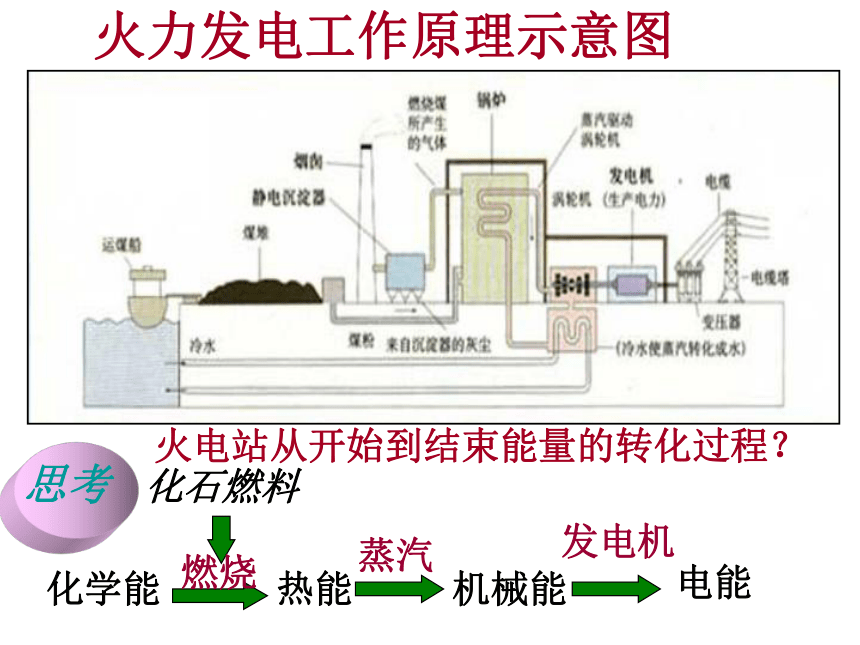
火力发电工作原理示意图
火电站从开始到结束能量的转化过程?
思考
化石燃料
化学能
燃烧
热能
蒸汽
机械能
电能
发电机
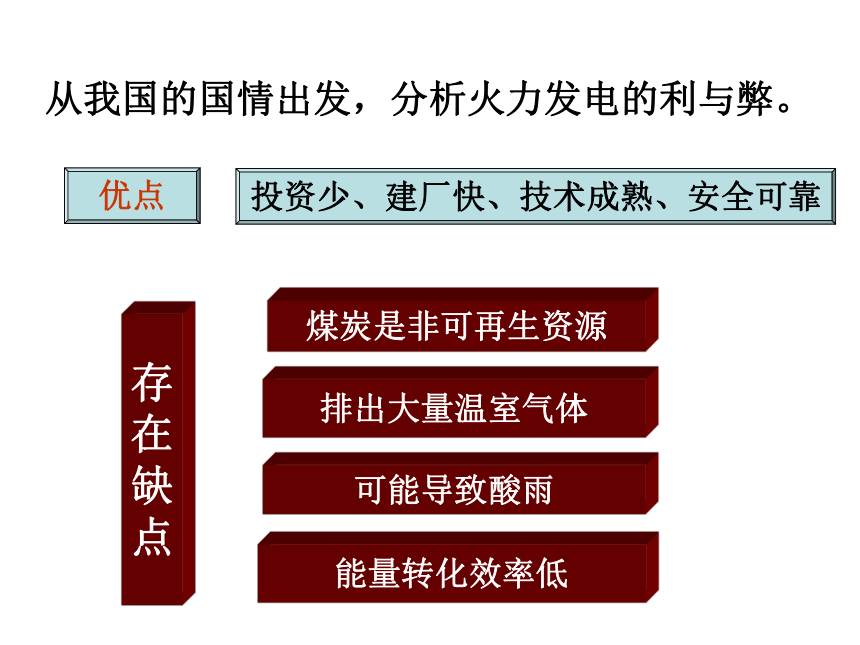
从我国的国情出发,分析火力发电的利与弊。
存
在
缺
点
排出大量温室气体
可能导致酸雨
能量转化效率低
煤炭是非可再生资源
优点
投资少、建厂快、技术成熟、安全可靠
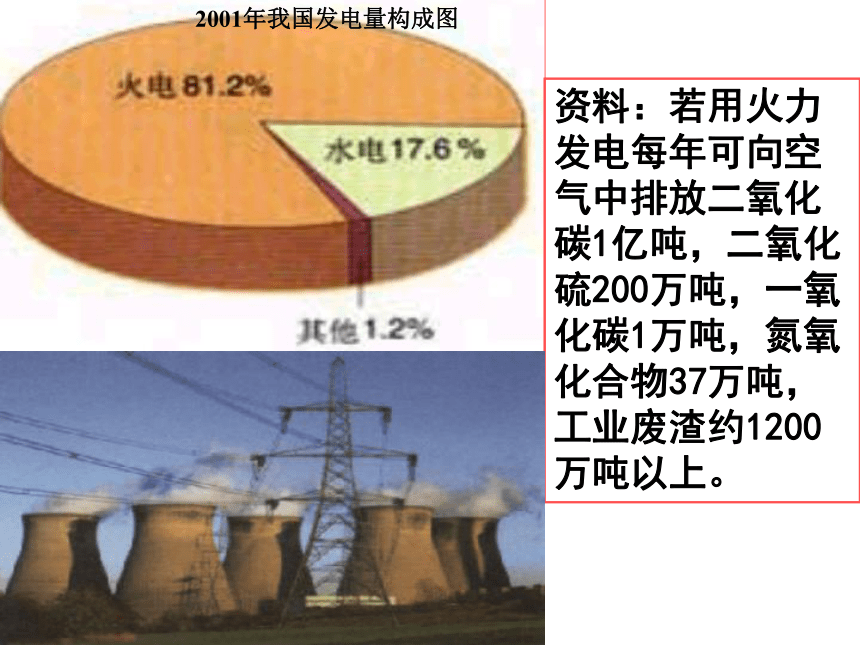
2001年我国发电量构成图
资料:若用火力发电每年可向空气中排放二氧化碳1亿吨,二氧化硫200万吨,一氧化碳1万吨,氮氧化合物37万吨,工业废渣约1200万吨以上。
化学能 电能
?
电池
你知道第一块电池的发明过程吗?
1780年,意大利解剖学家伽伐尼在做青蛙解剖时,两手分别拿着不同的金属器械,无意中同时碰在青蛙的大腿上,青蛙腿部的肌肉立刻抽搐了一下,仿佛受到电流的刺激,而只用一种金属器械去触动青蛙,却并无此种反应。伽伐尼认为,出现这种现象是因为动物躯体内部产生的一种电,他称之为“生物电”。意大利物理学家伏特在多次实验后认为:伽伐尼的“生物电”之说并不正确,青蛙的肌肉之所以能产生电流,大概是肌肉中某种液体在起作用。为了论证自己的观点,伏特把两种不同的金属片浸在各种溶液中进行试验。结果发现,这两种金属片中,只要有一种与溶液发生了化学反应,金属片之间就能够产生电流。1799年,伏特把一块锌板和一块银板浸在盐水里,发现连接两块金属的导线中有电流通过。于是,他就把许多锌片与银片之间垫上浸透盐水的绒布或纸片,平叠起来。用手触摸两端时,会感到强烈的电流刺激。伏特用这种方法成功的制成了世界上第一个电池──“伏特电堆”。这个“伏特电堆”实际上就是串联的电池组。它成为早期电学实验,电报机的电力来源。
根据以上资料,你能否总结电流产生的条件?
溶液
金属(两种不同的金属)
形成闭合回路
其中一种金属能与溶液起反应
⑴, 将Zn片插入H2SO4溶液中有什么现象?为什么?
⑵, 将Cu片插入H2SO4溶液中有什么现象?为什么?
演示探究
⑷,若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
⑶,将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
离子方程式
思考问题
寻找答案
你对问题
2的想法
稀H2SO4
Zn
Cu
锌表面有气泡产生,铜表面无明显现象
1.反应中,哪种物质失电子,哪种物质得电子
演示探究
实验现象
用导线将锌表面的电子引出来
Zn +2H+ = Zn 2+ +H2↑
2.用什么方法可不让H+直接在Zn表面得电子?
离子方程式
思考问题
寻找答案
组内交流 列出想法
演示探究
实验现象
Cu起传导电子的作用。
可用电流表测电流及方向。
Zn + 2H+ = Zn 2+ +H2↑
稀H2SO4
Zn
Cu
大量气泡从铜片逸出,锌片部分溶解
1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?
⑸,导线间接一电流计有何现象产生?为什么?
⑹,用一干电池连接电流计验证电子流向,确定Zn片, Cu片的正负极是怎样的?
解释实验现象
思考问题
寻找答案
组内交流
列出想法
演示探究
实验现象
化学能直接转化为电能
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
锌表面无气泡,
铜表面有气泡,
电流表发生偏转。
电子由Zn 导线 铜片 H+ 定向移动产生电流,故电流表的指针发生偏转
A
Zn
Cu
稀H2SO4
氧化反应
Zn-2e-=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e-=H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
①定义:能把化学能转变为电能的装
置,叫做原电池。
②原电池的电极
电极 电极材料 反应类型 电子流动方向
负极 还原性较强的金属 氧化反应 电子流出(流向正极)的一极
正极 还原性较弱的金属
还原反应 电子流入(来自负极)的一极
你觉得以上装置哪个能形成电流?
A
Zn
Cu
H2SO4
A
Zn
C
H2SO4
A
Zn
Cu
酒精
Zn
H2SO4
A
Cu
H2SO4
A
Zn
Zn
H2SO4
A
Zn
Cu
H2SO4
① ② ③ ④ ⑤
⑥
A
C
Cu
H2SO4
② ③
1.有两种活泼性不同的金属(或非金属)作电极
3.能自发地发生氧化还原反应
3.原电池的构成条件
4.两极相连形成闭合回路
2.电极材料均插入电解质溶液中
4.如何判定装置的正、负极?
思考与交流
正极
负极
电子流入的极
不活泼电极
发生还原反应
电子流出的极
较活泼电极
发生氧化反应
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
5.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
总反应: Zn + 2H+ = Zn 2+ + H2 ↑
总反应: Zn + Cu2+ = Zn 2+ + Cu
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑧
⑨
(×)
(∨)
负极:
正极:
总反应:
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
1、原电池:
把化学能转化为电能的装置
2、原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3、判断原电池正、负极的方法
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过导线流向较不活泼的金属(正极)
1、由组成原电池的两极材料判断;
2、根据电流方向或电子流动方向判断;
3、根据原电池两极发生的变化来判断;
4、电极反应现象.
活负惰正
4.构成原电池的条件:
1、自发进行的氧化还原反应
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
(一般负极与电解质发生氧化还原反应)
3、两极材料均插入电解质溶液中。
4、两极相连形成闭合回路。
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
下 页
上 页
首 页
小 结
结 束
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
你知道了吗?
哈哈!化学也能解决医学问题?
二、发展中的化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1、干电池结构及电极反应原理
干电池结构及电极反应原理
负极:Zn — 2e- == Zn2+
正极:2NH4+ + 2e- == 2NH3↑+H2↑
Zn + 2NH4+ == Zn2++2NH3↑+H2↑
电池总反应式:
特点:
a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命
2.充电电池
又称二次电池,能够重复使用至一定的周期。
铅蓄电池:最早使用的充电电池。
镍镉充电电池:它是一种体积少,具有残留性记忆的 充电电池,可重复使用500次以上。
铅蓄电池
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
铅蓄电池电极反应:
负极:Pb + SO42-—2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=
PbSO4 + 2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
镍铬电池
特点:比铅蓄电池耐用,可密封反复使用。
NiO2(S)+Cd(S)+2H2O(L)
=Ni(OH)2(S)+Cd(OH)2(S)
Ag2O(S)+Cd(S)+H2O(L)
=2Ag(S)+Cd(OH)2(S)
1.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
2.已知空气-锌电池的电极反应为:
锌片:Zn+20H--2e-=ZnO+H20
石墨:02+2H20+4e-=40H-
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
A
C
3.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是( )
C
6.据报道,锌电池可能取代目前广泛应用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+02=2ZnO,原料为锌粒、电解质和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
D
氢氧燃料电池
3.燃料电池
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
氢氧燃料电池:它是一种高效、环境友好
的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭
电极等。电极反应为
负极:2H2 + 4OH- - 4e- 4H2O
正极:O2 + 2H2O + 4e- 4OH-
总反应:2H2 + O2=2H2O
其他电池
空气电池
KOH溶液
H2
O2
H2O
a b
例,1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
a是 极,
b是 极
负
正
原电池设计思路:
1.能自发进行的氧化还原反应
2.通常须两个活性不同的电极
3.电解质溶液
4.还原剂在负极失电子,发生氧化反应,氧化剂在正极得电子,发生还原反应.
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
电解质溶液:
思 考 题
请根据反应:Fe+Cu2+=Fe2++Cu
设计原电池,你有哪些可行方案
Cu2+溶液
思 考 题
请根据反应2Fe3++Fe=3Fe2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3
Fe-C Fe(NO3)3
Fe-Ag Fe(SO4)3
4.由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为( )
A.3种 B.4种 C.5种 D.6种
5.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
A.在氧化还原反应中,甲失电子比乙失电子多
B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能
D.将甲与乙组成原电池时,甲为正极
C
C
7.
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
8.
试将下列两个氧化还原反应分别设计成两个原电池
⑴.
Zn + 2AgNO3=Zn(NO3)2+2Ag
⑵.
2Fe3++Fe=3Fe2+
( D )
( Zn∣AgNO3∣C )
( Fe∣Fe2(SO4)3∣C )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
第一课时
有些人把能源分为一次能源和二次能
源,请问太阳能和电能属于那一类呢?
一次能源:直接从自然界取得的能源,
例如流水、风力、原煤、石油、天然
气、天然铀矿等。
想一想
二次能源:一次能源经过加工、转换得到的能源,例如电力、蒸汽等。
【资料卡片】
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
水电站
火电站
水电17.6%
其他1.2%
2001年我国发电总量构成图
火力81.2%
火力发电仍将居首位
什么是火力发电?
火电站的工作原理如何
火力发电工作原理示意图
火电站从开始到结束能量的转化过程?
思考
化石燃料
化学能
燃烧
热能
蒸汽
机械能
电能
发电机
从我国的国情出发,分析火力发电的利与弊。
存
在
缺
点
排出大量温室气体
可能导致酸雨
能量转化效率低
煤炭是非可再生资源
优点
投资少、建厂快、技术成熟、安全可靠
2001年我国发电量构成图
资料:若用火力发电每年可向空气中排放二氧化碳1亿吨,二氧化硫200万吨,一氧化碳1万吨,氮氧化合物37万吨,工业废渣约1200万吨以上。
化学能 电能
?
电池
你知道第一块电池的发明过程吗?
1780年,意大利解剖学家伽伐尼在做青蛙解剖时,两手分别拿着不同的金属器械,无意中同时碰在青蛙的大腿上,青蛙腿部的肌肉立刻抽搐了一下,仿佛受到电流的刺激,而只用一种金属器械去触动青蛙,却并无此种反应。伽伐尼认为,出现这种现象是因为动物躯体内部产生的一种电,他称之为“生物电”。意大利物理学家伏特在多次实验后认为:伽伐尼的“生物电”之说并不正确,青蛙的肌肉之所以能产生电流,大概是肌肉中某种液体在起作用。为了论证自己的观点,伏特把两种不同的金属片浸在各种溶液中进行试验。结果发现,这两种金属片中,只要有一种与溶液发生了化学反应,金属片之间就能够产生电流。1799年,伏特把一块锌板和一块银板浸在盐水里,发现连接两块金属的导线中有电流通过。于是,他就把许多锌片与银片之间垫上浸透盐水的绒布或纸片,平叠起来。用手触摸两端时,会感到强烈的电流刺激。伏特用这种方法成功的制成了世界上第一个电池──“伏特电堆”。这个“伏特电堆”实际上就是串联的电池组。它成为早期电学实验,电报机的电力来源。
根据以上资料,你能否总结电流产生的条件?
溶液
金属(两种不同的金属)
形成闭合回路
其中一种金属能与溶液起反应
⑴, 将Zn片插入H2SO4溶液中有什么现象?为什么?
⑵, 将Cu片插入H2SO4溶液中有什么现象?为什么?
演示探究
⑷,若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
⑶,将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
离子方程式
思考问题
寻找答案
你对问题
2的想法
稀H2SO4
Zn
Cu
锌表面有气泡产生,铜表面无明显现象
1.反应中,哪种物质失电子,哪种物质得电子
演示探究
实验现象
用导线将锌表面的电子引出来
Zn +2H+ = Zn 2+ +H2↑
2.用什么方法可不让H+直接在Zn表面得电子?
离子方程式
思考问题
寻找答案
组内交流 列出想法
演示探究
实验现象
Cu起传导电子的作用。
可用电流表测电流及方向。
Zn + 2H+ = Zn 2+ +H2↑
稀H2SO4
Zn
Cu
大量气泡从铜片逸出,锌片部分溶解
1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?
⑸,导线间接一电流计有何现象产生?为什么?
⑹,用一干电池连接电流计验证电子流向,确定Zn片, Cu片的正负极是怎样的?
解释实验现象
思考问题
寻找答案
组内交流
列出想法
演示探究
实验现象
化学能直接转化为电能
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
锌表面无气泡,
铜表面有气泡,
电流表发生偏转。
电子由Zn 导线 铜片 H+ 定向移动产生电流,故电流表的指针发生偏转
A
Zn
Cu
稀H2SO4
氧化反应
Zn-2e-=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e-=H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
①定义:能把化学能转变为电能的装
置,叫做原电池。
②原电池的电极
电极 电极材料 反应类型 电子流动方向
负极 还原性较强的金属 氧化反应 电子流出(流向正极)的一极
正极 还原性较弱的金属
还原反应 电子流入(来自负极)的一极
你觉得以上装置哪个能形成电流?
A
Zn
Cu
H2SO4
A
Zn
C
H2SO4
A
Zn
Cu
酒精
Zn
H2SO4
A
Cu
H2SO4
A
Zn
Zn
H2SO4
A
Zn
Cu
H2SO4
① ② ③ ④ ⑤
⑥
A
C
Cu
H2SO4
② ③
1.有两种活泼性不同的金属(或非金属)作电极
3.能自发地发生氧化还原反应
3.原电池的构成条件
4.两极相连形成闭合回路
2.电极材料均插入电解质溶液中
4.如何判定装置的正、负极?
思考与交流
正极
负极
电子流入的极
不活泼电极
发生还原反应
电子流出的极
较活泼电极
发生氧化反应
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
5.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
总反应: Zn + 2H+ = Zn 2+ + H2 ↑
总反应: Zn + Cu2+ = Zn 2+ + Cu
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑧
⑨
(×)
(∨)
负极:
正极:
总反应:
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
1、原电池:
把化学能转化为电能的装置
2、原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3、判断原电池正、负极的方法
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过导线流向较不活泼的金属(正极)
1、由组成原电池的两极材料判断;
2、根据电流方向或电子流动方向判断;
3、根据原电池两极发生的变化来判断;
4、电极反应现象.
活负惰正
4.构成原电池的条件:
1、自发进行的氧化还原反应
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
(一般负极与电解质发生氧化还原反应)
3、两极材料均插入电解质溶液中。
4、两极相连形成闭合回路。
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
下 页
上 页
首 页
小 结
结 束
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
你知道了吗?
哈哈!化学也能解决医学问题?
二、发展中的化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1、干电池结构及电极反应原理
干电池结构及电极反应原理
负极:Zn — 2e- == Zn2+
正极:2NH4+ + 2e- == 2NH3↑+H2↑
Zn + 2NH4+ == Zn2++2NH3↑+H2↑
电池总反应式:
特点:
a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命
2.充电电池
又称二次电池,能够重复使用至一定的周期。
铅蓄电池:最早使用的充电电池。
镍镉充电电池:它是一种体积少,具有残留性记忆的 充电电池,可重复使用500次以上。
铅蓄电池
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
铅蓄电池电极反应:
负极:Pb + SO42-—2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=
PbSO4 + 2H2O
铅蓄电池充电和放电的总化学方程式:
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
放电
充电
镍铬电池
特点:比铅蓄电池耐用,可密封反复使用。
NiO2(S)+Cd(S)+2H2O(L)
=Ni(OH)2(S)+Cd(OH)2(S)
Ag2O(S)+Cd(S)+H2O(L)
=2Ag(S)+Cd(OH)2(S)
1.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
2.已知空气-锌电池的电极反应为:
锌片:Zn+20H--2e-=ZnO+H20
石墨:02+2H20+4e-=40H-
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
A
C
3.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是( )
C
6.据报道,锌电池可能取代目前广泛应用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+02=2ZnO,原料为锌粒、电解质和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
D
氢氧燃料电池
3.燃料电池
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
氢氧燃料电池:它是一种高效、环境友好
的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭
电极等。电极反应为
负极:2H2 + 4OH- - 4e- 4H2O
正极:O2 + 2H2O + 4e- 4OH-
总反应:2H2 + O2=2H2O
其他电池
空气电池
KOH溶液
H2
O2
H2O
a b
例,1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
a是 极,
b是 极
负
正
原电池设计思路:
1.能自发进行的氧化还原反应
2.通常须两个活性不同的电极
3.电解质溶液
4.还原剂在负极失电子,发生氧化反应,氧化剂在正极得电子,发生还原反应.
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
电解质溶液:
思 考 题
请根据反应:Fe+Cu2+=Fe2++Cu
设计原电池,你有哪些可行方案
Cu2+溶液
思 考 题
请根据反应2Fe3++Fe=3Fe2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3
Fe-C Fe(NO3)3
Fe-Ag Fe(SO4)3
4.由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为( )
A.3种 B.4种 C.5种 D.6种
5.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
A.在氧化还原反应中,甲失电子比乙失电子多
B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能
D.将甲与乙组成原电池时,甲为正极
C
C
7.
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
8.
试将下列两个氧化还原反应分别设计成两个原电池
⑴.
Zn + 2AgNO3=Zn(NO3)2+2Ag
⑵.
2Fe3++Fe=3Fe2+
( D )
( Zn∣AgNO3∣C )
( Fe∣Fe2(SO4)3∣C )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
