第二章 化学反应速
图片预览











文档简介
(共40张PPT)
第二章 化学反应速率和化学平衡
化学反应进行的方向(推动力)
本章学习内容 化学反应的快慢(速率)
化学反应的限度(反应物能否全部
转变为产物)
第一节 化学反应速率
下列化学反应进行快慢是否一样?
①神七点火
②溶洞形成
③氢氧混合气体遇火
④酸碱中和反应
⑤钢铁生锈
⑥煤和石油的形成
1、描述化学反应快慢的现象有
反应物消失的快慢或生成物出现的快慢
气泡逸出的快慢
浑浊出现的快慢
颜色变化的快慢
2、以上这种判断方法的缺点是什么呢?
不能定量描述化学反应的快慢
一、化学反应速率
1.定义:是描述化学反应进行快慢的物理 量。
2.表示方法:用单位时间内某一反应物的物质的量浓度的减少或生成物的物质的量浓度的增加来表示。
3. 公式:V=△C/△t
4 .单位:mol/(L.h) 、mol/(L.min) 、mol/(L.s)
如反应方程式∶mA+nB=pY+qZ
则VA=△C(A)/△t,VB=△C(B)/△t,
VY=△C(Y)/△t,VZ=△C(Z)/△t。
例析∶
密闭容器中,合成氨反应∶
N2 + 3H2 = 2NH3
起始浓度
(mol/L) 8 20 0
5min后
(mol/L) 6
浓度变化
(mol/L)
-2
推出→ -6 推出→ +4
也可判断 14 也可判断 4
则V(N2)=△C/△t= 2mol ﹒ L-1/5min= 0.4mol/(L﹒min);
V(H2 )=6 mol ﹒ L-1 /5min=1.2mol/( L﹒min);
V(NH3)=4 mol ﹒ L-1 / 5min=0.8mol /( L﹒min)。
由以上可知∶ V(N2): V(H2 ): V(NH3)=0.4:1.2:0.8=1:3:2 即同一反应中,各物质的反应速率之比为化学方程式中化学式前面的计量数之比。
2、在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须用下标说明用哪种物质来做标准。
注意:
1、一般来说,化学反应速率随反应的进行而逐渐减慢.因此,某一段时间内的反应速率,是平均速率,而不是指瞬时速率.无论浓度的变化是增加还是减少,规定反应速率都取正值,所以为统一起见,有些书本将化学反应速率定义为:
4、用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应转化同一物质来比较。
3、用同一反应体系中不同物质表示同一速率时,其数值比一定等于化学方程式中相应的化学计量数之比。
5、化学反应速率一般不能用固体或纯液体表示。
练习∶ (1)在一定条件下,密闭容器中合成氨,3H2+N2==2NH3,开始时测得[H2]=4mol/L ,[N2]=1mol/L,2S末,测得[N2]=0.9mol/L。求
V H2为多大?
(2)实验室利用氯酸钾制氧气。某学生测得生成氧气的平均速率为0.01mol/L·min,氧气的密度z约为1.28g/L,欲制取500mL(标态下)的氧气,需要时间为:( )
A、2min B、4min C、6min D、8min
(3)向2L的密闭容器(内有
催化剂)充入2mol的SO2和
1molO2,经2S,测得容器内
有1mol的SO3,则该反应的速率可怎样表示?
练习
(4)在下列过程,需要加快化学反应速率的是
A、钢铁腐蚀 B、塑料老化 C、食物腐烂
D、工业炼钢
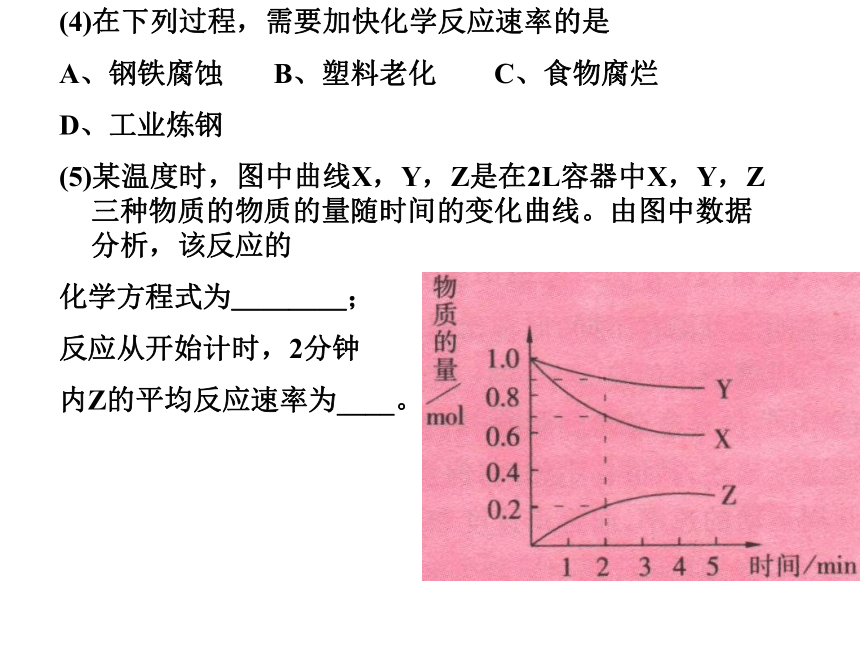
(5)某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。由图中数据分析,该反应的
化学方程式为____;
反应从开始计时,2分钟
内Z的平均反应速率为____。
练习6
在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是 。
2A+B=2C
练习7
则该反应速率的快慢顺序为:
反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)ν(A)=0.3mol/(L·s )
(2) ν(B)=0.6mol/(L·s)
(3) ν(C)=0.4mol/(L·s)
(4) ν(D)=0.45mol/(L·s)
(1)>(4)>(2)=(3)
反思:比较反应的快慢,应取同一参照物
五、化学反应的速率是通过实验测定的。
测定方法有∶
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
课本上的演示实验注意事项:
1、为了使实验结果更准确,将气体收集装置改为用量筒用排水法收集。
2、组装好仪器后,用液差法检测装置的气密性。
3、读液体体积的注意事项:室温、室压、眼睛与凹液面最低处平齐。
实验结果
1、可以通过测量气体体积来判断速率的快慢。
2、也可以通过测得的数据,算出该反应的平均速率。
3、反应物浓度不同,化学反应速率不一样。
第二节影响化学反应速率的因素
想一想,我们以前学过的、用过的和日常生活中改变速率的方法有哪些?
我们知道的改变反应速率的措施有∶加热、搅拌、增大反应物的浓度、使用催化剂、汽车加大油门、炉膛安装鼓风机、把煤块粉碎后使用、用冰箱保存食物、糕点盒装小包除氧剂等等。
思考:
1、在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、夏天,人们常把事物存放在冰箱中,这样做的依据是什么?
3、实验室中用双氧水制氧气为什么通常加入二氧化锰?
一、速率理论(碰撞理论)
1、微观粒子都看成是小球(且处在不停的运动中)。
2、物质间要发生反应首先要发生碰撞。
3、能发生反应碰撞称为有效碰撞。
4 、能发生有效碰撞的分子是活化分子。
5、能量较高的分子称为活化分子,活化分子必须按一定的方向才能发生有效碰撞。
6、一定温度下,活化分子百分数是一个定值与浓度无关。
化学反应的过程是反应物分子中的原子
重新组合,生成生成物分子的过程;也是
反应物分子中化学键的断裂、生成物分子
化学键的形成的过程。
如化学键的形成的过程∶旧键的断裂、新键的形成都是通过反应物分子(或离子)的相互碰撞来实现的,如果反应物分子(或离子)的相互不接触、不碰撞,就不可能发生化学反应;因此,反应物分子(或离子)的碰撞是发生反应的前提条件。
例如在101k Pa和500OC时, 0.001mol/L的 HI气体,每升气体中,分子碰撞达每秒3.5x1028 次之多。又如2,在常温下常 压下, H2和O2混合可以长时间共存而不发生明显反应,可见反应物分子(或离子)的每次碰撞不一定都能发生化学反应。
我们把能够发生化学反应的碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫活化分子。
2.活化能(Ea)
能发生化学反应的分子必须是吸收能量后形成的活化分子,而活化能是普通反应物分子形成活化分子所吸收的能量
活化能越高,反应越 进行,反应速率常数越 .
AB+C
△H
Ea
A ··· B···C
A+BC
难
小
Ea’
反应进程
能量
影响速率的因素∶
一、内因:
物质本身的结构和性质是化学反应速率大小的决定因素,反应类型不同有不同的化学反应速率,反应类型相同但反应物不同,化学反应速率也不同。
影响化学反应速率的因素
二、外因(反应物的浓度、温度、体系的压强、催化剂、溶剂、光辐射、放射线辐射、超声波、电弧、强磁场、高速研磨、颗粒大小等等)
影响化学反应速率的因素:
二.外因
(1)回顾浓度对化学反应速率大小的影响 (实验2一2)∶ 2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 2MnSO4+10CO2↑+8H2O
实验表明,加入较浓的草酸溶液的试管溶液褪色更快些。 结论∶其他条件相同时,增大反应物浓度反应速率加快,反之减慢。(适宜有溶液和气体参加的反应)
(2 )压强对化学反应速率的影响: 对于气体反应,当其它条件不变时,增大压强相当于增大反应物的浓度,反应速率加快;减小压强相当于减少反应物的浓度,反应速率减慢。 (只适宜有气体参加或生成的反应,如果只有固体或液体参加的反应,压强的变化对于反应速率可以忽略不计。)
实验2一3
Na2S2O4+H2SO4==Na2SO4+SO2+ S↓+H2O
从实验中可以得出结论∶加热的一组首先出现浑浊。
科学探究∶碘化钾加入稀硫酸,振荡加淀粉溶液,加热的试管先出现蓝色。
(3 )温度对化学反应速率的影响:
当其它条件不变时,升高温度,化学反应速率加快;降低温度,化学反应速率减慢。实验测得:温度每升高100C,化学反应速率通常 增大到原来的2---4倍。
在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。当然,由于升高温度,会使 分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应也会相应加快,但这不是主要原因。
(4)催化剂对化学反应速率的影响
催化剂能够降低反应所需要的活化能,这样使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占百分数,从而提高了有效碰撞的频率,成千上万倍地增大化学反应速率。如以下反应,加入二氧化锰加速过氧化氢的分解速度。
(实验2一4) MnO2
2H2O====2H2O+O2↑
影响化学反应速率的因素
内因:反应物本身的性质(决定因素)
外因: 浓度、温度、压强、 催化剂
固体接触面的大小
光、电磁波等
2、催化剂:催化剂能成千上万倍地加快化学反应速率。
3、浓度:当其它条件不变时,增加反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
4、压强:对于气体反应来说,增大压强若增加了反应物的浓度,可以增大化学反应速率;减小压强若减小了浓度,化学反应速率减小。
5、固体的表面积:化学反应时,与固体的接触面积越大,化学反应速率就越快。反之,就越慢。如:把固体粉碎、溶解、液化或气化。
小结:外界条件对化学反应速率的影响
1、温度:升高温度化学反应速率加快,降低温度化学反应速率减小。
练习题1
对于在一个密闭容器中进行的可逆反应:
C(s)+ O2 = CO2 (s)
下列说法中错误的是( D )
A将碳块粉碎成粉末可以加快化学反应速率
B增大氧气的量可以加快化学反应速率
C增大压强可以加快化学反应速率
D增加碳的量可以加快化学反应速率
练习题2
NO和 CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2 和 N2 ,对此反应有关的叙述中不正确的是(A、D ) A、降低温度能加快化学反应速率; B、使用适当催化剂可以加快化学反应速率; C、增大一氧化氮的量可以加快化学反应速率; D改变压强对化学反应速率没有影响。
△科学探究∶(教材23页)
1、滴加0.1mol/L三氯化铁溶液到过氧化氢中比滴加0.1mol/L硫酸铜溶液到过氧化氢中,使过氧化氢的分解速率快很多,因此过氧化氢分解用三氯化铁作催化剂比用硫酸铜好得多;
2、高锰酸钾溶液(紫红色)加入草酸溶液,紫红色褪色,如果同时再加硫酸锰则褪色慢些。
3、硫酸溶液比唾液对淀粉水解的催化效果差。
▲催化剂的应用
从以上三个实验(科学探究)中可以看到,催化剂不同,化学反应的速率有着显著的区别,因此催化剂具有选择性。目前,催化作用的研究一直是受到高度重视的高科技领域。
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性)
练习与思考
1、对于反应∶N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( A、B )
A、缩小体积使压强增大;B、体积不变充入氮气使压强增大;C、体积不变充入惰性气体;D、使总压强不变,充入惰性气体。
练习与思考
2、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的( B.D ) A、氢氧化钠固体; B、水; C、氯化铵固体; D、醋酸钠固体。
3、把镁条投入到盛有盐酸的敞口容器中,产生氢气的速率变化如图,分析其原因:
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
第二章 化学反应速率和化学平衡
化学反应进行的方向(推动力)
本章学习内容 化学反应的快慢(速率)
化学反应的限度(反应物能否全部
转变为产物)
第一节 化学反应速率
下列化学反应进行快慢是否一样?
①神七点火
②溶洞形成
③氢氧混合气体遇火
④酸碱中和反应
⑤钢铁生锈
⑥煤和石油的形成
1、描述化学反应快慢的现象有
反应物消失的快慢或生成物出现的快慢
气泡逸出的快慢
浑浊出现的快慢
颜色变化的快慢
2、以上这种判断方法的缺点是什么呢?
不能定量描述化学反应的快慢
一、化学反应速率
1.定义:是描述化学反应进行快慢的物理 量。
2.表示方法:用单位时间内某一反应物的物质的量浓度的减少或生成物的物质的量浓度的增加来表示。
3. 公式:V=△C/△t
4 .单位:mol/(L.h) 、mol/(L.min) 、mol/(L.s)
如反应方程式∶mA+nB=pY+qZ
则VA=△C(A)/△t,VB=△C(B)/△t,
VY=△C(Y)/△t,VZ=△C(Z)/△t。
例析∶
密闭容器中,合成氨反应∶
N2 + 3H2 = 2NH3
起始浓度
(mol/L) 8 20 0
5min后
(mol/L) 6
浓度变化
(mol/L)
-2
推出→ -6 推出→ +4
也可判断 14 也可判断 4
则V(N2)=△C/△t= 2mol ﹒ L-1/5min= 0.4mol/(L﹒min);
V(H2 )=6 mol ﹒ L-1 /5min=1.2mol/( L﹒min);
V(NH3)=4 mol ﹒ L-1 / 5min=0.8mol /( L﹒min)。
由以上可知∶ V(N2): V(H2 ): V(NH3)=0.4:1.2:0.8=1:3:2 即同一反应中,各物质的反应速率之比为化学方程式中化学式前面的计量数之比。
2、在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须用下标说明用哪种物质来做标准。
注意:
1、一般来说,化学反应速率随反应的进行而逐渐减慢.因此,某一段时间内的反应速率,是平均速率,而不是指瞬时速率.无论浓度的变化是增加还是减少,规定反应速率都取正值,所以为统一起见,有些书本将化学反应速率定义为:
4、用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应转化同一物质来比较。
3、用同一反应体系中不同物质表示同一速率时,其数值比一定等于化学方程式中相应的化学计量数之比。
5、化学反应速率一般不能用固体或纯液体表示。
练习∶ (1)在一定条件下,密闭容器中合成氨,3H2+N2==2NH3,开始时测得[H2]=4mol/L ,[N2]=1mol/L,2S末,测得[N2]=0.9mol/L。求
V H2为多大?
(2)实验室利用氯酸钾制氧气。某学生测得生成氧气的平均速率为0.01mol/L·min,氧气的密度z约为1.28g/L,欲制取500mL(标态下)的氧气,需要时间为:( )
A、2min B、4min C、6min D、8min
(3)向2L的密闭容器(内有
催化剂)充入2mol的SO2和
1molO2,经2S,测得容器内
有1mol的SO3,则该反应的速率可怎样表示?
练习
(4)在下列过程,需要加快化学反应速率的是
A、钢铁腐蚀 B、塑料老化 C、食物腐烂
D、工业炼钢
(5)某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。由图中数据分析,该反应的
化学方程式为____;
反应从开始计时,2分钟
内Z的平均反应速率为____。
练习6
在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是 。
2A+B=2C
练习7
则该反应速率的快慢顺序为:
反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)ν(A)=0.3mol/(L·s )
(2) ν(B)=0.6mol/(L·s)
(3) ν(C)=0.4mol/(L·s)
(4) ν(D)=0.45mol/(L·s)
(1)>(4)>(2)=(3)
反思:比较反应的快慢,应取同一参照物
五、化学反应的速率是通过实验测定的。
测定方法有∶
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
课本上的演示实验注意事项:
1、为了使实验结果更准确,将气体收集装置改为用量筒用排水法收集。
2、组装好仪器后,用液差法检测装置的气密性。
3、读液体体积的注意事项:室温、室压、眼睛与凹液面最低处平齐。
实验结果
1、可以通过测量气体体积来判断速率的快慢。
2、也可以通过测得的数据,算出该反应的平均速率。
3、反应物浓度不同,化学反应速率不一样。
第二节影响化学反应速率的因素
想一想,我们以前学过的、用过的和日常生活中改变速率的方法有哪些?
我们知道的改变反应速率的措施有∶加热、搅拌、增大反应物的浓度、使用催化剂、汽车加大油门、炉膛安装鼓风机、把煤块粉碎后使用、用冰箱保存食物、糕点盒装小包除氧剂等等。
思考:
1、在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、夏天,人们常把事物存放在冰箱中,这样做的依据是什么?
3、实验室中用双氧水制氧气为什么通常加入二氧化锰?
一、速率理论(碰撞理论)
1、微观粒子都看成是小球(且处在不停的运动中)。
2、物质间要发生反应首先要发生碰撞。
3、能发生反应碰撞称为有效碰撞。
4 、能发生有效碰撞的分子是活化分子。
5、能量较高的分子称为活化分子,活化分子必须按一定的方向才能发生有效碰撞。
6、一定温度下,活化分子百分数是一个定值与浓度无关。
化学反应的过程是反应物分子中的原子
重新组合,生成生成物分子的过程;也是
反应物分子中化学键的断裂、生成物分子
化学键的形成的过程。
如化学键的形成的过程∶旧键的断裂、新键的形成都是通过反应物分子(或离子)的相互碰撞来实现的,如果反应物分子(或离子)的相互不接触、不碰撞,就不可能发生化学反应;因此,反应物分子(或离子)的碰撞是发生反应的前提条件。
例如在101k Pa和500OC时, 0.001mol/L的 HI气体,每升气体中,分子碰撞达每秒3.5x1028 次之多。又如2,在常温下常 压下, H2和O2混合可以长时间共存而不发生明显反应,可见反应物分子(或离子)的每次碰撞不一定都能发生化学反应。
我们把能够发生化学反应的碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫活化分子。
2.活化能(Ea)
能发生化学反应的分子必须是吸收能量后形成的活化分子,而活化能是普通反应物分子形成活化分子所吸收的能量
活化能越高,反应越 进行,反应速率常数越 .
AB+C
△H
Ea
A ··· B···C
A+BC
难
小
Ea’
反应进程
能量
影响速率的因素∶
一、内因:
物质本身的结构和性质是化学反应速率大小的决定因素,反应类型不同有不同的化学反应速率,反应类型相同但反应物不同,化学反应速率也不同。
影响化学反应速率的因素
二、外因(反应物的浓度、温度、体系的压强、催化剂、溶剂、光辐射、放射线辐射、超声波、电弧、强磁场、高速研磨、颗粒大小等等)
影响化学反应速率的因素:
二.外因
(1)回顾浓度对化学反应速率大小的影响 (实验2一2)∶ 2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 2MnSO4+10CO2↑+8H2O
实验表明,加入较浓的草酸溶液的试管溶液褪色更快些。 结论∶其他条件相同时,增大反应物浓度反应速率加快,反之减慢。(适宜有溶液和气体参加的反应)
(2 )压强对化学反应速率的影响: 对于气体反应,当其它条件不变时,增大压强相当于增大反应物的浓度,反应速率加快;减小压强相当于减少反应物的浓度,反应速率减慢。 (只适宜有气体参加或生成的反应,如果只有固体或液体参加的反应,压强的变化对于反应速率可以忽略不计。)
实验2一3
Na2S2O4+H2SO4==Na2SO4+SO2+ S↓+H2O
从实验中可以得出结论∶加热的一组首先出现浑浊。
科学探究∶碘化钾加入稀硫酸,振荡加淀粉溶液,加热的试管先出现蓝色。
(3 )温度对化学反应速率的影响:
当其它条件不变时,升高温度,化学反应速率加快;降低温度,化学反应速率减慢。实验测得:温度每升高100C,化学反应速率通常 增大到原来的2---4倍。
在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。当然,由于升高温度,会使 分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应也会相应加快,但这不是主要原因。
(4)催化剂对化学反应速率的影响
催化剂能够降低反应所需要的活化能,这样使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占百分数,从而提高了有效碰撞的频率,成千上万倍地增大化学反应速率。如以下反应,加入二氧化锰加速过氧化氢的分解速度。
(实验2一4) MnO2
2H2O====2H2O+O2↑
影响化学反应速率的因素
内因:反应物本身的性质(决定因素)
外因: 浓度、温度、压强、 催化剂
固体接触面的大小
光、电磁波等
2、催化剂:催化剂能成千上万倍地加快化学反应速率。
3、浓度:当其它条件不变时,增加反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
4、压强:对于气体反应来说,增大压强若增加了反应物的浓度,可以增大化学反应速率;减小压强若减小了浓度,化学反应速率减小。
5、固体的表面积:化学反应时,与固体的接触面积越大,化学反应速率就越快。反之,就越慢。如:把固体粉碎、溶解、液化或气化。
小结:外界条件对化学反应速率的影响
1、温度:升高温度化学反应速率加快,降低温度化学反应速率减小。
练习题1
对于在一个密闭容器中进行的可逆反应:
C(s)+ O2 = CO2 (s)
下列说法中错误的是( D )
A将碳块粉碎成粉末可以加快化学反应速率
B增大氧气的量可以加快化学反应速率
C增大压强可以加快化学反应速率
D增加碳的量可以加快化学反应速率
练习题2
NO和 CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2 和 N2 ,对此反应有关的叙述中不正确的是(A、D ) A、降低温度能加快化学反应速率; B、使用适当催化剂可以加快化学反应速率; C、增大一氧化氮的量可以加快化学反应速率; D改变压强对化学反应速率没有影响。
△科学探究∶(教材23页)
1、滴加0.1mol/L三氯化铁溶液到过氧化氢中比滴加0.1mol/L硫酸铜溶液到过氧化氢中,使过氧化氢的分解速率快很多,因此过氧化氢分解用三氯化铁作催化剂比用硫酸铜好得多;
2、高锰酸钾溶液(紫红色)加入草酸溶液,紫红色褪色,如果同时再加硫酸锰则褪色慢些。
3、硫酸溶液比唾液对淀粉水解的催化效果差。
▲催化剂的应用
从以上三个实验(科学探究)中可以看到,催化剂不同,化学反应的速率有着显著的区别,因此催化剂具有选择性。目前,催化作用的研究一直是受到高度重视的高科技领域。
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性)
练习与思考
1、对于反应∶N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( A、B )
A、缩小体积使压强增大;B、体积不变充入氮气使压强增大;C、体积不变充入惰性气体;D、使总压强不变,充入惰性气体。
练习与思考
2、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的( B.D ) A、氢氧化钠固体; B、水; C、氯化铵固体; D、醋酸钠固体。
3、把镁条投入到盛有盐酸的敞口容器中,产生氢气的速率变化如图,分析其原因:
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
