②⒊2制取氧气(第1课时)
图片预览
文档简介
科目 化学 课题 ②⒊2制取氧气(第1课时)
时间 2011年 月 日 主备教师 范老师 评价等级
学生姓名 年级 九年级 班别 小组
【复习】
氧气是一种化学性质 的气体,具有 。氧气的用途: 、
;化合反应: ;氧化反应: ;
【目标】
1.了解实验室用过氧化氢制取氧气的反应原理和操作方法;
2.了解催化剂的概念。知道二氧化锰在分解过氧化氢反应中的催化作用;
3.理解分解反应的定义及其与化合反应的区别; 4.了解工业上制氧气的方法。
【导课】
我们在探究氧气的化学性质时,使用了许多瓶氧气,那么这些氧气是怎样制得的?
【预习】课本71—73、76—77页
一、用过氧化氢制氧气
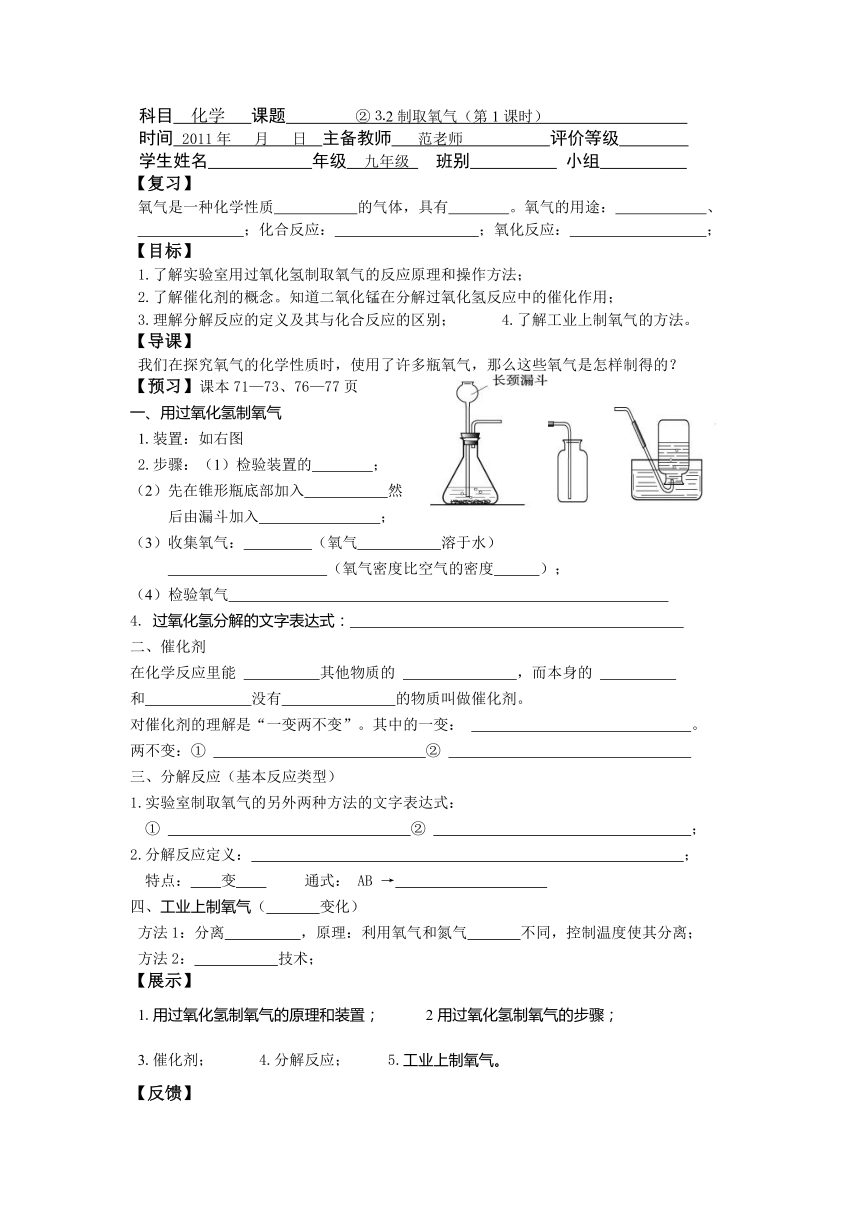
1.装置:如右图
2.步骤:(1)检验装置的 ;
(2)先在锥形瓶底部加入 然
后由漏斗加入 ;
(3)收集氧气: (氧气 溶于水)
(氧气密度比空气的密度 );
(4)检验氧气
4. 过氧化氢分解的文字表达式:
二、催化剂
在化学反应里能 其他物质的 ,而本身的
和 没有 的物质叫做催化剂。
对催化剂的理解是“一变两不变”。其中的一变: 。
两不变:① ②
三、分解反应(基本反应类型)
1.实验室制取氧气的另外两种方法的文字表达式:
① ② ;
2.分解反应定义: ;
特点: 变 通式: AB →
四、工业上制氧气( 变化)
方法1:分离 ,原理:利用氧气和氮气 不同,控制温度使其分离;
方法2: 技术;
【展示】
1.用过氧化氢制氧气的原理和装置; 2用过氧化氢制氧气的步骤;
3.催化剂; 4.分解反应; 5.工业上制氧气。
【反馈】
1.检验氧气的方法是( )。
A.用火柴去点 B.用带火星木条接近气体 C.用鼻子去嗅气味 D.用天平称量
2.工业上制取大量氧气的方法是( )。
A.加热氯酸钾 B.加热高锰酸钾 C.分离液态空气 D.加热二氧化锰
3.催化剂在化学反应中所起的作用是( )。
A.加快化学反应速率B.生成物质量增加C.改变化学反应速率D.减慢化学反应速率
4.www.中考资源网4.4.4飘尘是物质燃烧时产生的粒状飘浮物,颗粒很小,不易沉降。它与空气中的二氧化硫、氧气接触时,二氧化硫会部分转化为三氧化硫,飘尘所起的作用可能是( )。www.中考资源网
www.中.考资源网 A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
5.在101 kPa时,液态氮的沸点是-195.8 ℃,液态氧的沸点是-183 ℃,液态氦的沸点是-219 ℃,液态二氧化碳的沸点是-78.44 ℃。在分离液态空气的时候,上述气体随温度升高而被分离出来的顺序为( )
A.氮气、氧气、氦气、二氧化碳 B.氦气、氮气、氧气、二氧化碳
C.二氧化碳、氧气、氦气、氮气 D.氮气、二氧化碳、氧气、氦气
6.下列化学反应中,属于化合反应的是 (填序号,下同)只属于氧化反应不属于化合反应的是 。属于分解反应的是 。
① 镁+氧气 氧化镁 ②乙炔+氧气 二氧化碳+水
③ 碱式碳酸铜 加热 氧化铜+水+二氧化碳 ④ 水 氢气 + 氧气
7.实验室用过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气。小明设计了如右图所示的实验装置,可以通过分液漏斗的活塞控制液体的滴加速度。请回答下列问题。
(1)分液漏斗中应放入的物质是 ,锥形瓶中应放入的 物质是 ;
(2)这种方法与加热高锰酸钾制取氧气相比,优点是 。
①生成物只有氧气和水;②不需加热;③需加热。
(3)该方法制取氧气的文字表达式
【反思与收获】
点燃
点燃
通电
时间 2011年 月 日 主备教师 范老师 评价等级
学生姓名 年级 九年级 班别 小组
【复习】
氧气是一种化学性质 的气体,具有 。氧气的用途: 、
;化合反应: ;氧化反应: ;
【目标】
1.了解实验室用过氧化氢制取氧气的反应原理和操作方法;
2.了解催化剂的概念。知道二氧化锰在分解过氧化氢反应中的催化作用;
3.理解分解反应的定义及其与化合反应的区别; 4.了解工业上制氧气的方法。
【导课】
我们在探究氧气的化学性质时,使用了许多瓶氧气,那么这些氧气是怎样制得的?
【预习】课本71—73、76—77页
一、用过氧化氢制氧气
1.装置:如右图
2.步骤:(1)检验装置的 ;
(2)先在锥形瓶底部加入 然
后由漏斗加入 ;
(3)收集氧气: (氧气 溶于水)
(氧气密度比空气的密度 );
(4)检验氧气
4. 过氧化氢分解的文字表达式:
二、催化剂
在化学反应里能 其他物质的 ,而本身的
和 没有 的物质叫做催化剂。
对催化剂的理解是“一变两不变”。其中的一变: 。
两不变:① ②
三、分解反应(基本反应类型)
1.实验室制取氧气的另外两种方法的文字表达式:
① ② ;
2.分解反应定义: ;
特点: 变 通式: AB →
四、工业上制氧气( 变化)
方法1:分离 ,原理:利用氧气和氮气 不同,控制温度使其分离;
方法2: 技术;
【展示】
1.用过氧化氢制氧气的原理和装置; 2用过氧化氢制氧气的步骤;
3.催化剂; 4.分解反应; 5.工业上制氧气。
【反馈】
1.检验氧气的方法是( )。
A.用火柴去点 B.用带火星木条接近气体 C.用鼻子去嗅气味 D.用天平称量
2.工业上制取大量氧气的方法是( )。
A.加热氯酸钾 B.加热高锰酸钾 C.分离液态空气 D.加热二氧化锰
3.催化剂在化学反应中所起的作用是( )。
A.加快化学反应速率B.生成物质量增加C.改变化学反应速率D.减慢化学反应速率
4.www.中考资源网4.4.4飘尘是物质燃烧时产生的粒状飘浮物,颗粒很小,不易沉降。它与空气中的二氧化硫、氧气接触时,二氧化硫会部分转化为三氧化硫,飘尘所起的作用可能是( )。www.中考资源网
www.中.考资源网 A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
5.在101 kPa时,液态氮的沸点是-195.8 ℃,液态氧的沸点是-183 ℃,液态氦的沸点是-219 ℃,液态二氧化碳的沸点是-78.44 ℃。在分离液态空气的时候,上述气体随温度升高而被分离出来的顺序为( )
A.氮气、氧气、氦气、二氧化碳 B.氦气、氮气、氧气、二氧化碳
C.二氧化碳、氧气、氦气、氮气 D.氮气、二氧化碳、氧气、氦气
6.下列化学反应中,属于化合反应的是 (填序号,下同)只属于氧化反应不属于化合反应的是 。属于分解反应的是 。
① 镁+氧气 氧化镁 ②乙炔+氧气 二氧化碳+水
③ 碱式碳酸铜 加热 氧化铜+水+二氧化碳 ④ 水 氢气 + 氧气
7.实验室用过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气。小明设计了如右图所示的实验装置,可以通过分液漏斗的活塞控制液体的滴加速度。请回答下列问题。
(1)分液漏斗中应放入的物质是 ,锥形瓶中应放入的 物质是 ;
(2)这种方法与加热高锰酸钾制取氧气相比,优点是 。
①生成物只有氧气和水;②不需加热;③需加热。
(3)该方法制取氧气的文字表达式
【反思与收获】
点燃
点燃
通电
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
