1.5 物质的溶解(三) 课件(共54张PPT)
文档属性
| 名称 | 1.5 物质的溶解(三) 课件(共54张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-08-31 00:00:00 | ||
图片预览









文档简介
物质的溶解(三)
课前检测
选择题每题2分,填空题每空2分,限时12分钟,共计18分。
1.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
2
{5940675A-B579-460E-94D1-54222C63F5DA}
课前检测
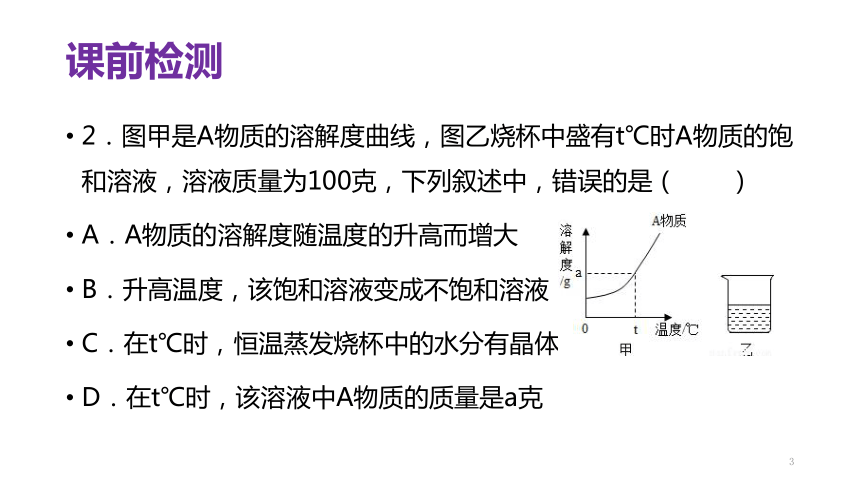
2.图甲是A物质的溶解度曲线,图乙烧杯中盛有t℃时A物质的饱和溶液,溶液质量为100克,下列叙述中,错误的是( )
A.A物质的溶解度随温度的升高而增大 ??????
B.升高温度,该饱和溶液变成不饱和溶液
C.在t℃时,恒温蒸发烧杯中的水分有晶体析出 ??
D.在t℃时,该溶液中A物质的质量是a克
3
课前检测
3.下列关于溶解度说法正确的是( )
A.一定温度下,该物质在100克溶剂中所溶解的克数。
B.一定温度下,该物质在100克饱和溶液中所含溶质的克数。
C.该物质在100克溶剂中达到饱和状态所溶解的克数。
D.一定温度下,该物质在100克溶剂中最多能溶解的克数。
4
课前检测
4.右图是A、B、C三种固体物质的溶解度曲线,回答
(1)P点表示的意义是 。
(2)Q点表示的意义是 。
(3)溶解度受温度影响最小的是 。
(4) t 0 ℃ A、B、C三种物质溶解度由大到小的顺序
。
5
S
T
t0
t1
t2
m
n
p
C
B
A
Q
0
解析
1.A 2.B 3.D 4.(1)t2时,C 物质溶解度为m克 。(2)t1 时,Q 点A、B、C三者的溶解度相等。(3)B (4)A、B、C
6
NO.2 物质的溶解性
7
知识导入
生活中有时需要准确知道溶液的浓度
8
飞机喷洒农药
药液太稀不能杀死害虫和病菌, 药液太浓又会毒害农作物或树木。
药水杀虫
一、溶质的质量分数
1.概念:溶质质量与溶液质量之比。
2.关系式:
9
溶质的质量分数= ×100%
溶质质量
溶液质量
= ×100%
溶质质量
溶质质量+溶剂质量
溶质的质量=
溶液的质量×溶质的质量分数
溶液的质量=
溶质的质量
溶质的质量分数
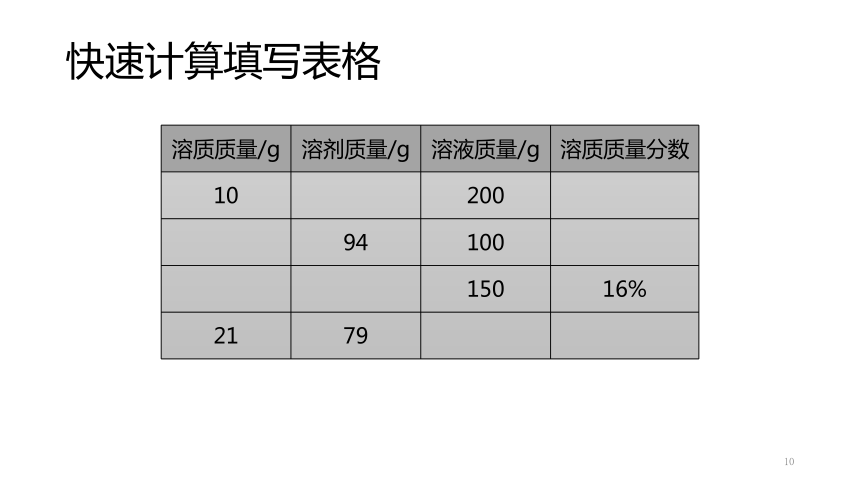
快速计算填写表格
10
{69C7853C-536D-4A76-A0AE-DD22124D55A5}溶质质量/g
溶剂质量/g
溶液质量/g
溶质质量分数
10
200
94
100
150
16%
21
79
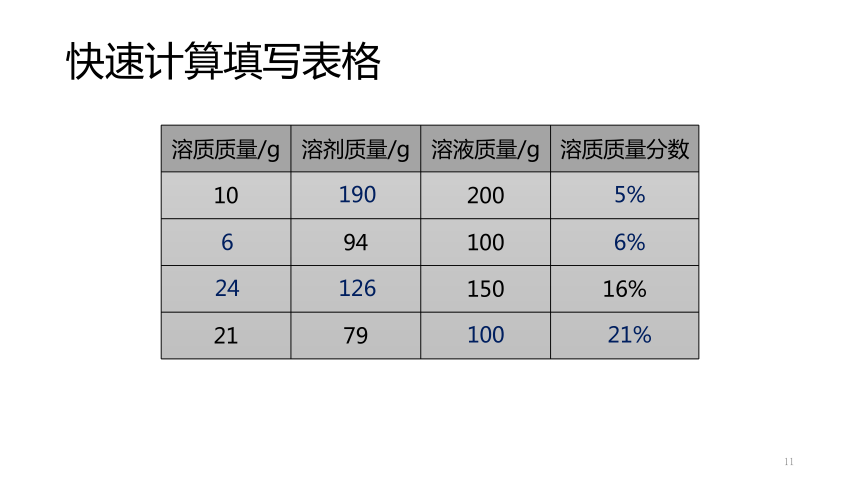
快速计算填写表格
11
{69C7853C-536D-4A76-A0AE-DD22124D55A5}溶质质量/g
溶剂质量/g
溶液质量/g
溶质质量分数
10
200
94
100
150
16%
21
79
190
5%
6
24
6%
126
100
21%
思考与讨论
如:20℃时,氯化钠在100克水中最多能溶解36克,则20克氯化钠放入50克水中溶解后,溶质的质量只能是18克,而不是20克。
由此可见,饱和溶液的溶质的质量分数可以有哪些计算方法?
12
二、饱和溶液的溶质的质量分数有两种计算
13
a.溶质的质量分数= ×100%
溶质质量
溶液质量
b.溶质的质量分数= ×100%
溶解度
溶解度+100克
20℃时,氯化钠的溶解度为36克,则40克氯化钠放入100克水中溶解后,所得溶液的质量分数为多少?
溶解度与溶质质量分数的比较
14
{69C7853C-536D-4A76-A0AE-DD22124D55A5}区别?
溶解度 ?
溶质的质量分数 ?
概念 ?
一定温度时,100g溶剂中最多溶解溶质的质量 ?
任意溶液中,溶质质量与溶液质量之比 ?
表示
意义 ?
某物质溶解能力的大小 ?
任一溶液的浓度大小 ?
条件 ?
一定温度
不定温度 ?
状态 ?
饱和状态 ?
可饱和,可不饱和 ?
单位 ?
g ?
无单位 ?
小结
1.溶质的质量是指形成溶液的那部分溶质的质量,没有进入溶液的溶质不在考虑范围之内。
2.溶液的质量是指该溶液中溶解的全部溶质的质量与溶剂的质量之和,可以是一种或几种溶质。
3.计算溶质质量分数时,上、下质量单位应统一。
4.计算溶液溶质质量分数时,最后结果是百分数或小数。
5.同一温度下,同种溶质饱和溶液的溶质的质量分数最大。
15
三、溶质质量分数的意义
溶质的质量分数定量表示溶液的浓度。
16
溶液在人类的生产、生活和科学研究中具有广泛应用。
三、溶质质量分数的意义
三种浓稀不同的硫酸铜溶液
17
溶质的质量分数越大,溶液中的溶质相对含量就越大,溶液的浓度也越大。
三、溶质质量分数的意义
按下表所定的量配制氯化钠溶液并计算。
18
10g氯化钠
20g氯化钠
90g水 100g氯化钠溶液
80g水 100g氯化钠溶液
溶质质量/g
溶剂(水)质量/g
现象
溶液中溶质的质量分数
10
90
20
80
全部溶解
全部溶解
10%
20%
练一练
1.在农业生产上,有时用10%~20%食盐溶液来选种。如果要配制150千克质量分数为16% 的食盐溶液,需要食盐和水各多少千克?
19
练一练
1.在农业生产上,有时用10%~20%食盐溶液来选种。如果要配制150千克质量分数为16% 的食盐溶液,需要食盐和水各多少千克?
20
解:
m食盐=150千克×16%=24千克
m水=150千克-24千克=26千克
答:配制16%食盐溶液150千克,需要食盐24千克和水126千克。
练一练
2.下列叙述是否正确?为什么?
(1)在100g水中溶解20g氯化钠,所得氯化钠溶液的溶质质量分数为20%。
(2)从100g溶质质量分数为20%的碳酸钠溶液中取出10g溶液,则取出的溶液的溶质质量分数为20%。
21
练一练
2.下列叙述是否正确?为什么?
(1)在100g水中溶解20g氯化钠,所得氯化钠溶液的溶质质量分数为20%。
(2)从100g溶质质量分数为20%的碳酸钠溶液中取出10g溶液,则取出的溶液的溶质质量分数为20%。
22
不正确,溶质质量分数为
20g
100g+20g
×100%=16.7%
正确,溶液是均一的,溶质的质量分数还是20%
NO.3 溶液的配制
23
一、溶液的配制
实验目的:配制一定溶质质量分数的某溶液。
实验仪器:托盘天平,烧杯、量筒、玻璃棒、药匙。
实验步骤:计算→称量和量取→溶解→装瓶保存
24
一、溶液的配制
配制溶质的质量分数为10% 的氯化钠溶液50 克
1.计算:配制此溶液需要氯化钠________ 克,水________ 毫升。
2.称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。用量筒量取所需的水。
25
一、溶液的配制
3.溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌。待氯化钠完全溶解时,10% 的氯化钠溶液就配制好了。
4.把配好的溶液装入试剂瓶中,塞好瓶塞瓶贴上标签,放到试剂柜中。
26
二、误差分析
分析:如果最后所得溶质质量分数大于16%的原因可能是什么?
27
二、误差分析
分析:如果最后所得溶质质量分数大于16%的原因可能是什么?
将量筒中的水倒入烧杯时,不慎溅到烧杯的外面。
量取水时俯视读数
将量筒中的水倒入烧杯时,没有倒干净
天平未调零,指针偏右
……
28
二、误差分析
如果所配溶液的溶质质量分数略小于16%,你认为可能的原因有哪些?
29
二、误差分析
如果所配溶液的溶质质量分数略小于16%,你认为可能的原因有哪些?
未洗涤烧杯和玻璃棒
纸上粘有食盐
装瓶时试剂瓶未干燥
将盐倒入烧杯时撒到桌子上
用量筒量水读数时仰视
30
三、稀释问题
如果将20%的氯化钠溶液配制成10%的氯化钠溶液可以有哪些方法?
如果加水稀释,操作的主要步骤应该是什么?
31
三、稀释问题
如果将20%的氯化钠溶液配制成10%的氯化钠溶液可以有哪些方法?
如果加水稀释,操作的主要步骤应该是什么?
32
加水稀释或加入小于10%的氯化钠溶液
(1)计算
(2)量取
(3)稀释
(4)装瓶存放(贴好标签)
探究溶液稀释和浓缩
33
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
探究溶液稀释和浓缩
34
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
不变
不变
增大
增大
增大
减小
减小
减小
四、溶液稀释问题的计算
将100 g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。
35
四、溶液稀释问题的计算
将100 g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。
36
溶液稀释前后,溶质的质量不变
m质前=m质后
m浓溶液×A浓%=m稀溶液×A稀%
解:设稀释后溶液的质量为x。
100 g×25%=x×10%
x=
100 g×25%
10%
=250 g
需要水的质量为:250 g-100 g=150 g
答:稀释需要水的质量为150 g。
五、溶液浓缩的计算
现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
37
五、溶液浓缩的计算
现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
解:设蒸发掉水的质量为x。
38
100g×10%
= 20%
100g-x
×100%
x =50g
答:蒸发掉水的质量为50g。
六、溶液中溶质的质量分数与溶液密度的关系
溶液中溶质的质量分数不同,意味着一定质量的溶液中所含溶质的质量不同,可见质量分数不同的溶液,溶液的密度也不同。
硫酸的密度和硫酸溶液中溶质的质量分数对照表
39
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}密度
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.81
1.84
质量
分数
10
20
30
40
50
60
70
90
98
练一练
例:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升?
40
练一练
例:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升?
41
m前= 1.84 g/cm3×V浓 m后= 1.07 g/cm3×V稀
V稀= 1000 mL= 1000cm3
因为溶质的质量在稀释前后是不变的,可得到:
m前×98%=m后×10%
1.84g/cm3×V浓×98%=1.07g/cm3×1000cm3×10%
V浓= ≈59.3cm3=59.3mL
1070g×10%
1.84g/cm3×98%
七、溶液混合溶质的质量分数计算
30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
42
七、溶液混合溶质的质量分数计算
30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
43
解:溶质的质量为30%×100g+10%×100g=40g
×100%=20%
100g+100g
40g
溶质的质量分数为
答:所得溶液的溶质的质量分数为20%。
汇总
浓溶液在加水稀释前后,溶液、溶质、溶剂三者的质量将发生怎样的变化?
44
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
加溶质
倾倒
不变
不变
增大
减少
增大
减少
不变
减少
增大
减少
增大
减少
减少
增大
不变
可能增大
课堂总结
一、溶质质量分数
溶质质量分数=
溶质的质量
溶液的质量
×100%
计算(溶剂和溶质的质量或体积)
称量(称量和量取)
溶解(装瓶保存)
溶液稀释前后,溶质的质量不变
m浓溶液×A浓%=m稀溶液×A稀%
二、溶液配制
溶液质量分数越大,溶液的密度也越大
NO.4 课堂练习
46
课堂练习
1.配制一定溶质质量分数的溶液,正确的操作步骤是( )。
A.称量(量取)、计算、溶解 B.计算、称量(量取)、溶解
C.计算、溶解、称量(量取) D.溶解、计算、称量(量取)
2.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A.100克醋酸中含醋为10克 B.100克醋酸的水溶液中含醋酸10克
C.100克水中含醋酸为10克 D.100克醋酸的水溶液中含水10克
47
课堂练习
3.把10克氯化钠放入40克水中,完全溶解后,溶液中氯化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4.下列溶液,溶质的质量分数最大的是( )
A.20%的蔗糖溶液。
B.把40g蔗糖完全溶解在210g水中所配成的溶液。
C.其中含有27克蔗糖的150克蔗糖水。
D.把ag水加入ag 30%的蔗糖溶液中所配成的溶液。
48
课堂练习
5.关于100g5%NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl B.5g NaCl溶解在95g水中
C.溶液中NaCl和水的质量比为1:20 D.溶液中NaCl和水的质量比为19:1
6.每天补充适量的维生素C,有利于提高人体的免疫力。某维生素C泡腾片,每片含1克维生素C。将一片该泡腾片投入适量的水中,最终得到250克溶液,此溶液中维生素C的质量分数为( )
A.0.4% B.1% C.2.5% D.4%
49
课堂练习
7.①、②、③、④四个烧杯分别盛有50克水,在20 ℃时,向四个烧杯中依次加入27克、9克、36克、18克的NaCl,充分溶解后的情况如图所示,则下列叙述不正确的是( )
A.①③溶液的溶质质量分数相等
B.②中所得溶液一定是不饱和溶液
C.④所得溶液的溶质质量分数为36%
D.20 ℃时,如果①②中的物质混合后刚好达到饱和,则④中溶液一定饱和
50
课堂练习
8.如表所示为硝酸钾(不含结晶水)在不同温度下的溶解度:关硝酸钾的说法正确的是(?? )
A.在以上温度范围内,硝酸钾属于易溶物质,且温度升高,溶解度增加变慢??????????
B.40℃时,硝酸钾饱和溶液的溶质质量分数为64%
C.若要从硝酸钾溶液中得到硝酸钾晶体,只能采用冷却热饱和溶液法??????????
D.若要将30℃含50克水的硝酸钾饱和溶液降温至10℃,可析出12.5g晶体
51
课堂练习
9.表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃),试回答下列问题。
(1)将 100 克稀释成 3%的溶液,需要加水多少克?
(2)配制 100 克 12%的硫酸溶液,需要 24%的硫酸溶液多少克?12%的氨水
52
{5940675A-B579-460E-94D1-54222C63F5DA}溶液中溶质的质量分数(%)
4
12
16
24
28
硫酸溶液的密度(克/厘米 3)
1.02
1.08
1.11
1.17
1.20
氨水的密度(克/厘米 3)
0.98
0.95
0.94
0.91
0.90
解析
1.B 2.B 3.B 4.A 5.B【解析】溶质质量分数是溶液中溶质的质量与溶液的质量之比。6.A 7.C 8.D【解析】
A.硝酸钾溶解度大于10g,属于易溶,温度越高,每升高10度,溶解度增加更快。A错
B.根据公式算出40度饱和溶液的溶质质量分数是64/164小于64%。B错
C.溶解度随温度变化明显的可以选用冷却热饱和溶液,但是还可以用蒸发溶剂。C错
D.30度下含50g水的硝酸钾饱和溶液含有溶质23g,降温到10度,溶解度变成21,溶解度降低25g,但是这个溶剂只有50g,所以析出12.5g晶体。D对
53
解析
9(1)增大;减小;(2)300;(3)50;42.7
【解析】
(1)设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×12%=(100g+x)×3% x=300g
(2)配制100克12%的硫酸溶液,设需要24%的硫酸溶液的质量为y,则100g×12%=24%y y=50g
24%的硫酸溶液的密度为1.17g/mL,即需取24%的硫酸溶液的体积为50g÷1.17g/mL≈42.7mL
54
课前检测
选择题每题2分,填空题每空2分,限时12分钟,共计18分。
1.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
2
{5940675A-B579-460E-94D1-54222C63F5DA}
课前检测
2.图甲是A物质的溶解度曲线,图乙烧杯中盛有t℃时A物质的饱和溶液,溶液质量为100克,下列叙述中,错误的是( )
A.A物质的溶解度随温度的升高而增大 ??????
B.升高温度,该饱和溶液变成不饱和溶液
C.在t℃时,恒温蒸发烧杯中的水分有晶体析出 ??
D.在t℃时,该溶液中A物质的质量是a克
3
课前检测
3.下列关于溶解度说法正确的是( )
A.一定温度下,该物质在100克溶剂中所溶解的克数。
B.一定温度下,该物质在100克饱和溶液中所含溶质的克数。
C.该物质在100克溶剂中达到饱和状态所溶解的克数。
D.一定温度下,该物质在100克溶剂中最多能溶解的克数。
4
课前检测
4.右图是A、B、C三种固体物质的溶解度曲线,回答
(1)P点表示的意义是 。
(2)Q点表示的意义是 。
(3)溶解度受温度影响最小的是 。
(4) t 0 ℃ A、B、C三种物质溶解度由大到小的顺序
。
5
S
T
t0
t1
t2
m
n
p
C
B
A
Q
0
解析
1.A 2.B 3.D 4.(1)t2时,C 物质溶解度为m克 。(2)t1 时,Q 点A、B、C三者的溶解度相等。(3)B (4)A、B、C
6
NO.2 物质的溶解性
7
知识导入
生活中有时需要准确知道溶液的浓度
8
飞机喷洒农药
药液太稀不能杀死害虫和病菌, 药液太浓又会毒害农作物或树木。
药水杀虫
一、溶质的质量分数
1.概念:溶质质量与溶液质量之比。
2.关系式:
9
溶质的质量分数= ×100%
溶质质量
溶液质量
= ×100%
溶质质量
溶质质量+溶剂质量
溶质的质量=
溶液的质量×溶质的质量分数
溶液的质量=
溶质的质量
溶质的质量分数
快速计算填写表格
10
{69C7853C-536D-4A76-A0AE-DD22124D55A5}溶质质量/g
溶剂质量/g
溶液质量/g
溶质质量分数
10
200
94
100
150
16%
21
79
快速计算填写表格
11
{69C7853C-536D-4A76-A0AE-DD22124D55A5}溶质质量/g
溶剂质量/g
溶液质量/g
溶质质量分数
10
200
94
100
150
16%
21
79
190
5%
6
24
6%
126
100
21%
思考与讨论
如:20℃时,氯化钠在100克水中最多能溶解36克,则20克氯化钠放入50克水中溶解后,溶质的质量只能是18克,而不是20克。
由此可见,饱和溶液的溶质的质量分数可以有哪些计算方法?
12
二、饱和溶液的溶质的质量分数有两种计算
13
a.溶质的质量分数= ×100%
溶质质量
溶液质量
b.溶质的质量分数= ×100%
溶解度
溶解度+100克
20℃时,氯化钠的溶解度为36克,则40克氯化钠放入100克水中溶解后,所得溶液的质量分数为多少?
溶解度与溶质质量分数的比较
14
{69C7853C-536D-4A76-A0AE-DD22124D55A5}区别?
溶解度 ?
溶质的质量分数 ?
概念 ?
一定温度时,100g溶剂中最多溶解溶质的质量 ?
任意溶液中,溶质质量与溶液质量之比 ?
表示
意义 ?
某物质溶解能力的大小 ?
任一溶液的浓度大小 ?
条件 ?
一定温度
不定温度 ?
状态 ?
饱和状态 ?
可饱和,可不饱和 ?
单位 ?
g ?
无单位 ?
小结
1.溶质的质量是指形成溶液的那部分溶质的质量,没有进入溶液的溶质不在考虑范围之内。
2.溶液的质量是指该溶液中溶解的全部溶质的质量与溶剂的质量之和,可以是一种或几种溶质。
3.计算溶质质量分数时,上、下质量单位应统一。
4.计算溶液溶质质量分数时,最后结果是百分数或小数。
5.同一温度下,同种溶质饱和溶液的溶质的质量分数最大。
15
三、溶质质量分数的意义
溶质的质量分数定量表示溶液的浓度。
16
溶液在人类的生产、生活和科学研究中具有广泛应用。
三、溶质质量分数的意义
三种浓稀不同的硫酸铜溶液
17
溶质的质量分数越大,溶液中的溶质相对含量就越大,溶液的浓度也越大。
三、溶质质量分数的意义
按下表所定的量配制氯化钠溶液并计算。
18
10g氯化钠
20g氯化钠
90g水 100g氯化钠溶液
80g水 100g氯化钠溶液
溶质质量/g
溶剂(水)质量/g
现象
溶液中溶质的质量分数
10
90
20
80
全部溶解
全部溶解
10%
20%
练一练
1.在农业生产上,有时用10%~20%食盐溶液来选种。如果要配制150千克质量分数为16% 的食盐溶液,需要食盐和水各多少千克?
19
练一练
1.在农业生产上,有时用10%~20%食盐溶液来选种。如果要配制150千克质量分数为16% 的食盐溶液,需要食盐和水各多少千克?
20
解:
m食盐=150千克×16%=24千克
m水=150千克-24千克=26千克
答:配制16%食盐溶液150千克,需要食盐24千克和水126千克。
练一练
2.下列叙述是否正确?为什么?
(1)在100g水中溶解20g氯化钠,所得氯化钠溶液的溶质质量分数为20%。
(2)从100g溶质质量分数为20%的碳酸钠溶液中取出10g溶液,则取出的溶液的溶质质量分数为20%。
21
练一练
2.下列叙述是否正确?为什么?
(1)在100g水中溶解20g氯化钠,所得氯化钠溶液的溶质质量分数为20%。
(2)从100g溶质质量分数为20%的碳酸钠溶液中取出10g溶液,则取出的溶液的溶质质量分数为20%。
22
不正确,溶质质量分数为
20g
100g+20g
×100%=16.7%
正确,溶液是均一的,溶质的质量分数还是20%
NO.3 溶液的配制
23
一、溶液的配制
实验目的:配制一定溶质质量分数的某溶液。
实验仪器:托盘天平,烧杯、量筒、玻璃棒、药匙。
实验步骤:计算→称量和量取→溶解→装瓶保存
24
一、溶液的配制
配制溶质的质量分数为10% 的氯化钠溶液50 克
1.计算:配制此溶液需要氯化钠________ 克,水________ 毫升。
2.称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。用量筒量取所需的水。
25
一、溶液的配制
3.溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌。待氯化钠完全溶解时,10% 的氯化钠溶液就配制好了。
4.把配好的溶液装入试剂瓶中,塞好瓶塞瓶贴上标签,放到试剂柜中。
26
二、误差分析
分析:如果最后所得溶质质量分数大于16%的原因可能是什么?
27
二、误差分析
分析:如果最后所得溶质质量分数大于16%的原因可能是什么?
将量筒中的水倒入烧杯时,不慎溅到烧杯的外面。
量取水时俯视读数
将量筒中的水倒入烧杯时,没有倒干净
天平未调零,指针偏右
……
28
二、误差分析
如果所配溶液的溶质质量分数略小于16%,你认为可能的原因有哪些?
29
二、误差分析
如果所配溶液的溶质质量分数略小于16%,你认为可能的原因有哪些?
未洗涤烧杯和玻璃棒
纸上粘有食盐
装瓶时试剂瓶未干燥
将盐倒入烧杯时撒到桌子上
用量筒量水读数时仰视
30
三、稀释问题
如果将20%的氯化钠溶液配制成10%的氯化钠溶液可以有哪些方法?
如果加水稀释,操作的主要步骤应该是什么?
31
三、稀释问题
如果将20%的氯化钠溶液配制成10%的氯化钠溶液可以有哪些方法?
如果加水稀释,操作的主要步骤应该是什么?
32
加水稀释或加入小于10%的氯化钠溶液
(1)计算
(2)量取
(3)稀释
(4)装瓶存放(贴好标签)
探究溶液稀释和浓缩
33
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
探究溶液稀释和浓缩
34
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
不变
不变
增大
增大
增大
减小
减小
减小
四、溶液稀释问题的计算
将100 g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。
35
四、溶液稀释问题的计算
将100 g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。
36
溶液稀释前后,溶质的质量不变
m质前=m质后
m浓溶液×A浓%=m稀溶液×A稀%
解:设稀释后溶液的质量为x。
100 g×25%=x×10%
x=
100 g×25%
10%
=250 g
需要水的质量为:250 g-100 g=150 g
答:稀释需要水的质量为150 g。
五、溶液浓缩的计算
现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
37
五、溶液浓缩的计算
现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
解:设蒸发掉水的质量为x。
38
100g×10%
= 20%
100g-x
×100%
x =50g
答:蒸发掉水的质量为50g。
六、溶液中溶质的质量分数与溶液密度的关系
溶液中溶质的质量分数不同,意味着一定质量的溶液中所含溶质的质量不同,可见质量分数不同的溶液,溶液的密度也不同。
硫酸的密度和硫酸溶液中溶质的质量分数对照表
39
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}密度
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.81
1.84
质量
分数
10
20
30
40
50
60
70
90
98
练一练
例:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升?
40
练一练
例:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升?
41
m前= 1.84 g/cm3×V浓 m后= 1.07 g/cm3×V稀
V稀= 1000 mL= 1000cm3
因为溶质的质量在稀释前后是不变的,可得到:
m前×98%=m后×10%
1.84g/cm3×V浓×98%=1.07g/cm3×1000cm3×10%
V浓= ≈59.3cm3=59.3mL
1070g×10%
1.84g/cm3×98%
七、溶液混合溶质的质量分数计算
30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
42
七、溶液混合溶质的质量分数计算
30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
43
解:溶质的质量为30%×100g+10%×100g=40g
×100%=20%
100g+100g
40g
溶质的质量分数为
答:所得溶液的溶质的质量分数为20%。
汇总
浓溶液在加水稀释前后,溶液、溶质、溶剂三者的质量将发生怎样的变化?
44
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}溶液
溶质质量
溶剂质量
溶液质量
溶质质量分数
稀释
浓缩
加溶质
倾倒
不变
不变
增大
减少
增大
减少
不变
减少
增大
减少
增大
减少
减少
增大
不变
可能增大
课堂总结
一、溶质质量分数
溶质质量分数=
溶质的质量
溶液的质量
×100%
计算(溶剂和溶质的质量或体积)
称量(称量和量取)
溶解(装瓶保存)
溶液稀释前后,溶质的质量不变
m浓溶液×A浓%=m稀溶液×A稀%
二、溶液配制
溶液质量分数越大,溶液的密度也越大
NO.4 课堂练习
46
课堂练习
1.配制一定溶质质量分数的溶液,正确的操作步骤是( )。
A.称量(量取)、计算、溶解 B.计算、称量(量取)、溶解
C.计算、溶解、称量(量取) D.溶解、计算、称量(量取)
2.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A.100克醋酸中含醋为10克 B.100克醋酸的水溶液中含醋酸10克
C.100克水中含醋酸为10克 D.100克醋酸的水溶液中含水10克
47
课堂练习
3.把10克氯化钠放入40克水中,完全溶解后,溶液中氯化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4.下列溶液,溶质的质量分数最大的是( )
A.20%的蔗糖溶液。
B.把40g蔗糖完全溶解在210g水中所配成的溶液。
C.其中含有27克蔗糖的150克蔗糖水。
D.把ag水加入ag 30%的蔗糖溶液中所配成的溶液。
48
课堂练习
5.关于100g5%NaCl溶液,下列叙述正确的是( )
A.100g水溶解了5g NaCl B.5g NaCl溶解在95g水中
C.溶液中NaCl和水的质量比为1:20 D.溶液中NaCl和水的质量比为19:1
6.每天补充适量的维生素C,有利于提高人体的免疫力。某维生素C泡腾片,每片含1克维生素C。将一片该泡腾片投入适量的水中,最终得到250克溶液,此溶液中维生素C的质量分数为( )
A.0.4% B.1% C.2.5% D.4%
49
课堂练习
7.①、②、③、④四个烧杯分别盛有50克水,在20 ℃时,向四个烧杯中依次加入27克、9克、36克、18克的NaCl,充分溶解后的情况如图所示,则下列叙述不正确的是( )
A.①③溶液的溶质质量分数相等
B.②中所得溶液一定是不饱和溶液
C.④所得溶液的溶质质量分数为36%
D.20 ℃时,如果①②中的物质混合后刚好达到饱和,则④中溶液一定饱和
50
课堂练习
8.如表所示为硝酸钾(不含结晶水)在不同温度下的溶解度:关硝酸钾的说法正确的是(?? )
A.在以上温度范围内,硝酸钾属于易溶物质,且温度升高,溶解度增加变慢??????????
B.40℃时,硝酸钾饱和溶液的溶质质量分数为64%
C.若要从硝酸钾溶液中得到硝酸钾晶体,只能采用冷却热饱和溶液法??????????
D.若要将30℃含50克水的硝酸钾饱和溶液降温至10℃,可析出12.5g晶体
51
课堂练习
9.表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃),试回答下列问题。
(1)将 100 克稀释成 3%的溶液,需要加水多少克?
(2)配制 100 克 12%的硫酸溶液,需要 24%的硫酸溶液多少克?12%的氨水
52
{5940675A-B579-460E-94D1-54222C63F5DA}溶液中溶质的质量分数(%)
4
12
16
24
28
硫酸溶液的密度(克/厘米 3)
1.02
1.08
1.11
1.17
1.20
氨水的密度(克/厘米 3)
0.98
0.95
0.94
0.91
0.90
解析
1.B 2.B 3.B 4.A 5.B【解析】溶质质量分数是溶液中溶质的质量与溶液的质量之比。6.A 7.C 8.D【解析】
A.硝酸钾溶解度大于10g,属于易溶,温度越高,每升高10度,溶解度增加更快。A错
B.根据公式算出40度饱和溶液的溶质质量分数是64/164小于64%。B错
C.溶解度随温度变化明显的可以选用冷却热饱和溶液,但是还可以用蒸发溶剂。C错
D.30度下含50g水的硝酸钾饱和溶液含有溶质23g,降温到10度,溶解度变成21,溶解度降低25g,但是这个溶剂只有50g,所以析出12.5g晶体。D对
53
解析
9(1)增大;减小;(2)300;(3)50;42.7
【解析】
(1)设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×12%=(100g+x)×3% x=300g
(2)配制100克12%的硫酸溶液,设需要24%的硫酸溶液的质量为y,则100g×12%=24%y y=50g
24%的硫酸溶液的密度为1.17g/mL,即需取24%的硫酸溶液的体积为50g÷1.17g/mL≈42.7mL
54
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
