2011-2012学年苏教版化学必修1同步练习专题二单元测试
文档属性
| 名称 | 2011-2012学年苏教版化学必修1同步练习专题二单元测试 |

|
|
| 格式 | zip | ||
| 文件大小 | 85.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-08-14 00:00:00 | ||
图片预览


文档简介
2011-2012学年苏教版化学必修1同步练习专题二单元测试
一、选择题:(只有一个正确的选项,每小题3分,共48分)
1.氯气用于自来水消毒100多年了,目前仍然大量采用,其原因是( )
A.氯气有毒,可以毒死细菌、病毒
B.氯气具有刺激性气味,可以熏死细菌、病毒
C.氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒
D.氯气用于自来水消毒没有任何有毒物质残留
2.下列物质属于纯净物的是( )
A.液氯 B.漂白粉 C.氯水 D.食盐水
3.下列各组物质中,前者为强电解质,后者为弱电解质的是( )
A.硫酸,硫酸镁 B.碳酸,碳酸钠
C.食盐,酒精 D.碳酸氢钠,醋酸
4.M、X、Y、Z是四种元素,其常见化合价均为+2价,且X2+与单质M不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z;这四种离子的氧化性大小符合( )
A.M 2+>X 2+>Z 2+>Y 2+ B.X 2+>M 2+>Y 2+>Z 2+
C.Y 2+>Z 2+>M 2+>X 2+ D.Z 2+>X 2+>M 2+>Y 2+
5.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭和O2
6.下列物质既能与酸反应又能与碱反应的是( )
A.Na2CO3 B.NaOH C.BaCl2 D.NaHCO3
7.对于反应3Cl2+6NaOH ==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
C.Cl2既是氧化剂又是还原剂
D.每生成1mol的NaClO3转移6mol的电子
8.不能使湿润的碘化钾淀粉试纸变蓝的是( )
A.氯水 B.碘水 C.溴水 D.氯化钾溶液
9.下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
10.下列有关氯水的叙述,正确的是( )
A.新制氯水只含有氯分子和次氯酸分子;
B.新制氯水可使紫色石蕊试液先变红后褪色;
C.氯水光照时有气泡逸出,该气体的主要成分是氯气;
D.氯水放置数天后,其酸性逐渐减弱。
11.下列电离方程式中,正确的是( )
A.Al2(SO4)3=2Al3++3SO42- B.NaHCO3=Na++H++CO32-
C.CH3COOH=CH3COO-+H+ D.Na2CO3=Na2++CO32-
12.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
① 密度较小 ②熔点较低 ③ 硬度较小 ④还原性强 ⑤ 该反应生成相应的碱 ⑥ 该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥ C.除③⑥之外 D.全部
13.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
14.工业上制造镁粉是将镁蒸气在气体中冷却。可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.④⑤
15.下列各组溶液中离子,能在溶液中大量共存的是( )
A.H+、Ca2+、NO3-、CO32- B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+ D.NH4+、K+、OH-、SO42-
16.用1L1mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A.1︰3 B.1︰2 C.2︰3 D.3︰2
二、填空题(共33分)
△17.(11分)(1)下列物质:①H2O ②石墨 ③NH4NO3 ④硫酸
⑤ CH3COOH ⑥蔗糖 属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 (用编号填写)。
(2)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含少量苏打___________,②苏打固体中含少量小苏打___________,③CO2气体中混有少量的HCl气体_____________________。
△18.(12分)A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体。它们按下图所示的关系相互转化,已知A为单质。分别写出有关反应的化学方程式。
(1)用化学式来表示下列物质:
B: D: E: _ _
(2)写出以下几步反应的化学方程式
A→D:_________________ __________________________
C→E:_________________ ___________________________
D→E:_________________ ___________________________
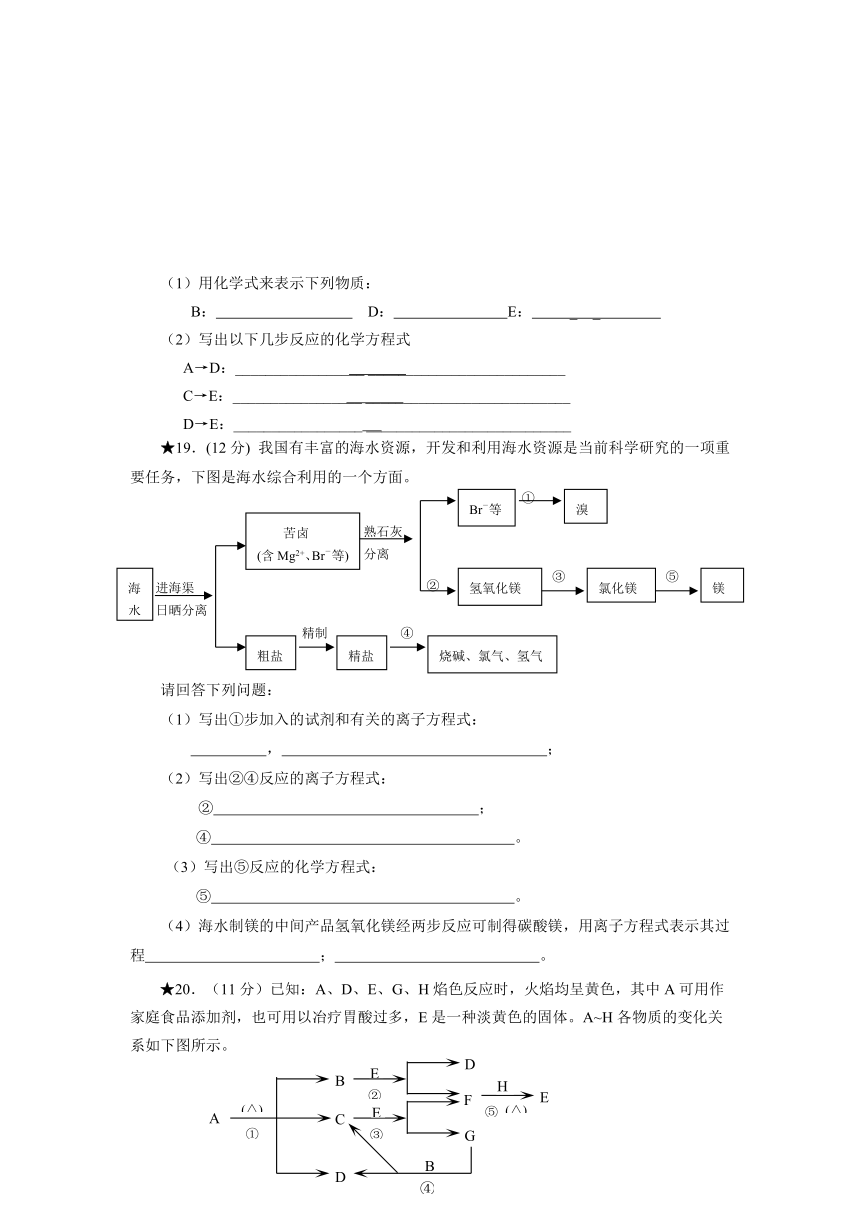
★19.(12分) 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
请回答下列问题:
(1)写出①步加入的试剂和有关的离子方程式:
, ;
(2)写出②④反应的离子方程式:
② ;
④ 。
(3)写出⑤反应的化学方程式:
⑤ 。
(4)海水制镁的中间产品氢氧化镁经两步反应可制得碳酸镁,用离子方程式表示其过程 ; 。
★20.(11分)已知:A、D、E、G、H焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多,E是一种淡黄色的固体。A~H各物质的变化关系如下图所示。
(1)用化学式来表示下列物质:
A: E:
(2)写出以下几步反应的化学方程式
反应①
反应③
反应⑤
(3)上述三步反应中属于氧化还原反应的有 (填编号)
21.(10分)将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下
2FeCl3+Cu= 2FeCl2+CuCl2
(1)请用双线桥法标出电子转移的方向和数目。
(2)在该反应中,氧化剂是___________,氧化产物是___________。
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为___________。
(4)请将以上反应改写为离子方程式_______________________________。
三、实验题(共12分)
22.(12分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A试剂为 ,B试剂为 ,离子方程式为 ;
(2)C试剂为 ;D试剂作用为 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ,脱脂棉的作用是 ;
(5)H中试剂为 ,离子方程式为 。
四、计算题(共7分)
23.(7分)充分加热碳酸钠和碳酸氢钠的混合物19g,完全反应后固体质量减轻了3.1g,求:(1)原混合物中碳酸钠的质量。(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)。
附加题:另加15分
24.(15分)工业纯碱中常含有少量的氯化钠,某校兴趣小组设计实验欲测定纯碱样品中碳酸钠的质量分数,提出不同的实验方案:
甲、乙同学均采用了通过测定反应生成的CO2的量来间接测定碳酸钠质量的方案,设计之装置分别如下:
(甲同学设计) (乙同学设计)
(1)甲、乙两同学均设计在反应停止后缓缓鼓入空气数分钟,该步骤的目的是:_____
____________________________________________________________________。
(2)请你比较甲、乙两同学设计之装置,指出它们各自的优点。
①甲装置:__________________________________________________;
②乙装置:__________________________________________________。
(3)兴趣小组经讨论后,组装成如下实验装置:
指导老师指出:该装置仍然存在缺陷,会造成实验误差。你认为缺陷在哪里?如何改进?
①装置缺陷:___________________________________________________________。
②改进方法:___________________________________________________________。
(4)用改进后的装置做实验:取样品ag,使之与稀硫酸充分反应,测得反应前C仪器和药品的质量为b g,反应后C仪器和药品的质量为c g。
=_____________
(5)丙和丁同学都提出了用沉淀法测定CO32-的方案:
丙方案:加入氯化钙溶液使CO32-完全沉淀,过滤、洗涤、干燥、称量,计算碳酸钠的质量分数。
丁方案:加入氯化钡溶液使CO32-完全沉淀,过滤、洗涤、干燥、称量,计算碳酸钠的质量分数。
从实验误差角度分析,丙方案 丁方案(填“优于”、“劣于”或“等同于”)。
参考答案
一、选择题(每小题3分,共48分,每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8
选项 C A D A C D C D
题号 9 10 11 12 13 14 15 16
选项 C B A D D D B A
二、填空题(共32分)
△17.(11分)(1)③④;①⑤;⑥;(5分,每项1分)
(2)①过量的CO2气体;②加热;③饱和的NaHCO3溶液。(各2分)
△18.(12分)(1)B:Na2O(2分);D:NaOH(2分);E:Na2CO3(2分)
(2)2Na+2H2O=2NaOH+H2↑(2分);2Na2O2+2CO2= 2Na2CO3+O2(2分);
2NaOH+ CO2= Na2CO3+H2O(2分)。
★19.(12分) (1)Cl2;2Br-+Cl2=2Cl-+Br2 (2分)
(2)②Mg2++2OH-=Mg(OH)2↓(2分)
④2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
(3)MgCl2 Mg+Cl2↑(2分)
(4)Mg(OH)2+2H+= Mg2++2H2O(2分) Mg2++CO32-= MgCO3↓(2分)
★20.(11分)(1)A:NaHCO3(2分);E:Na2O2(2分)
①:2NaHCO3Na2CO3+H2O+CO2↑(2分)
③:2Na2O2+2H2O=4NaOH+O2(2分)
⑤:2Na+O2Na2O2(2分);③⑤(1分)
21.(10分)(1)略(2分); (2)FeCl3; CuCl2(各2分)
(3)3.2g(2分) (4)2Fe3++Cu=2Fe2++Cu2+(2分)
三、实验题(共12分)
22.(12分) (1)浓盐酸 (1分);MnO2 (1分);
MnO2+4H++2Cl--Mn2++Cl2↑+2H2O(2分);
(2)饱和食盐水 (1分);吸水氯气中的水蒸气 (1分)
(3)不褪色 (1分);
(4)棕黄色的烟 (1分);防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管 (1分)
(4)NaOH溶液 (1分) Cl2+2OH-=Cl-+ClO-+H2O(2分)
四、计算题(共7分)
23.(7分)(1)10.6g(4分);(2)3.36L(3分)
附加题:另加15分
24.(15分)(1)使反应装置中生成的CO2完全排入碱石灰吸收装置中。(2分)
(2)①在A、C中加入B装置,防止了水蒸气对测定的干扰;(2分)
②D装置防止了通入空气时引入CO2的干扰。(2分)
(3)①C装置中的碱石灰会吸收空气中的CO2和水蒸气,从而影响测定结果。(2分)
②在C装置之后再连接一个盛有碱石灰的干燥管。(2分,其它合理答案同样得分)
(4)或×100﹪等其它合理答案(3分)(5)劣于。(2分)
A
C
E
B
D
空气中短期放置
空气中点燃
CO2
H2O
H2O
H2O
熟石灰
分离
④
精制
③
⑤
①
②
进海渠
日晒分离
海
水
苦卤
(含Mg2+、Br-等)
氢氧化镁
氯化镁
Br-等
镁
粗盐
精盐
烧碱、氯气、氢气
溴
(△)
A
B
C
D
D
F
G
E
H
B
E
E
④
(△)
①
②
③
⑤
电解
电解
一、选择题:(只有一个正确的选项,每小题3分,共48分)
1.氯气用于自来水消毒100多年了,目前仍然大量采用,其原因是( )
A.氯气有毒,可以毒死细菌、病毒
B.氯气具有刺激性气味,可以熏死细菌、病毒
C.氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒
D.氯气用于自来水消毒没有任何有毒物质残留
2.下列物质属于纯净物的是( )
A.液氯 B.漂白粉 C.氯水 D.食盐水
3.下列各组物质中,前者为强电解质,后者为弱电解质的是( )
A.硫酸,硫酸镁 B.碳酸,碳酸钠
C.食盐,酒精 D.碳酸氢钠,醋酸
4.M、X、Y、Z是四种元素,其常见化合价均为+2价,且X2+与单质M不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z;这四种离子的氧化性大小符合( )
A.M 2+>X 2+>Z 2+>Y 2+ B.X 2+>M 2+>Y 2+>Z 2+
C.Y 2+>Z 2+>M 2+>X 2+ D.Z 2+>X 2+>M 2+>Y 2+
5.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭和O2
6.下列物质既能与酸反应又能与碱反应的是( )
A.Na2CO3 B.NaOH C.BaCl2 D.NaHCO3
7.对于反应3Cl2+6NaOH ==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
C.Cl2既是氧化剂又是还原剂
D.每生成1mol的NaClO3转移6mol的电子
8.不能使湿润的碘化钾淀粉试纸变蓝的是( )
A.氯水 B.碘水 C.溴水 D.氯化钾溶液
9.下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
10.下列有关氯水的叙述,正确的是( )
A.新制氯水只含有氯分子和次氯酸分子;
B.新制氯水可使紫色石蕊试液先变红后褪色;
C.氯水光照时有气泡逸出,该气体的主要成分是氯气;
D.氯水放置数天后,其酸性逐渐减弱。
11.下列电离方程式中,正确的是( )
A.Al2(SO4)3=2Al3++3SO42- B.NaHCO3=Na++H++CO32-
C.CH3COOH=CH3COO-+H+ D.Na2CO3=Na2++CO32-
12.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
① 密度较小 ②熔点较低 ③ 硬度较小 ④还原性强 ⑤ 该反应生成相应的碱 ⑥ 该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥ C.除③⑥之外 D.全部
13.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
14.工业上制造镁粉是将镁蒸气在气体中冷却。可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.④⑤
15.下列各组溶液中离子,能在溶液中大量共存的是( )
A.H+、Ca2+、NO3-、CO32- B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+ D.NH4+、K+、OH-、SO42-
16.用1L1mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A.1︰3 B.1︰2 C.2︰3 D.3︰2
二、填空题(共33分)
△17.(11分)(1)下列物质:①H2O ②石墨 ③NH4NO3 ④硫酸
⑤ CH3COOH ⑥蔗糖 属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 (用编号填写)。
(2)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含少量苏打___________,②苏打固体中含少量小苏打___________,③CO2气体中混有少量的HCl气体_____________________。
△18.(12分)A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体。它们按下图所示的关系相互转化,已知A为单质。分别写出有关反应的化学方程式。
(1)用化学式来表示下列物质:
B: D: E: _ _
(2)写出以下几步反应的化学方程式
A→D:_________________ __________________________
C→E:_________________ ___________________________
D→E:_________________ ___________________________
★19.(12分) 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
请回答下列问题:
(1)写出①步加入的试剂和有关的离子方程式:
, ;
(2)写出②④反应的离子方程式:
② ;
④ 。
(3)写出⑤反应的化学方程式:
⑤ 。
(4)海水制镁的中间产品氢氧化镁经两步反应可制得碳酸镁,用离子方程式表示其过程 ; 。
★20.(11分)已知:A、D、E、G、H焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多,E是一种淡黄色的固体。A~H各物质的变化关系如下图所示。
(1)用化学式来表示下列物质:
A: E:
(2)写出以下几步反应的化学方程式
反应①
反应③
反应⑤
(3)上述三步反应中属于氧化还原反应的有 (填编号)
21.(10分)将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下
2FeCl3+Cu= 2FeCl2+CuCl2
(1)请用双线桥法标出电子转移的方向和数目。
(2)在该反应中,氧化剂是___________,氧化产物是___________。
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为___________。
(4)请将以上反应改写为离子方程式_______________________________。
三、实验题(共12分)
22.(12分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A试剂为 ,B试剂为 ,离子方程式为 ;
(2)C试剂为 ;D试剂作用为 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ,脱脂棉的作用是 ;
(5)H中试剂为 ,离子方程式为 。
四、计算题(共7分)
23.(7分)充分加热碳酸钠和碳酸氢钠的混合物19g,完全反应后固体质量减轻了3.1g,求:(1)原混合物中碳酸钠的质量。(2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)。
附加题:另加15分
24.(15分)工业纯碱中常含有少量的氯化钠,某校兴趣小组设计实验欲测定纯碱样品中碳酸钠的质量分数,提出不同的实验方案:
甲、乙同学均采用了通过测定反应生成的CO2的量来间接测定碳酸钠质量的方案,设计之装置分别如下:
(甲同学设计) (乙同学设计)
(1)甲、乙两同学均设计在反应停止后缓缓鼓入空气数分钟,该步骤的目的是:_____
____________________________________________________________________。
(2)请你比较甲、乙两同学设计之装置,指出它们各自的优点。
①甲装置:__________________________________________________;
②乙装置:__________________________________________________。
(3)兴趣小组经讨论后,组装成如下实验装置:
指导老师指出:该装置仍然存在缺陷,会造成实验误差。你认为缺陷在哪里?如何改进?
①装置缺陷:___________________________________________________________。
②改进方法:___________________________________________________________。
(4)用改进后的装置做实验:取样品ag,使之与稀硫酸充分反应,测得反应前C仪器和药品的质量为b g,反应后C仪器和药品的质量为c g。
=_____________
(5)丙和丁同学都提出了用沉淀法测定CO32-的方案:
丙方案:加入氯化钙溶液使CO32-完全沉淀,过滤、洗涤、干燥、称量,计算碳酸钠的质量分数。
丁方案:加入氯化钡溶液使CO32-完全沉淀,过滤、洗涤、干燥、称量,计算碳酸钠的质量分数。
从实验误差角度分析,丙方案 丁方案(填“优于”、“劣于”或“等同于”)。
参考答案
一、选择题(每小题3分,共48分,每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8
选项 C A D A C D C D
题号 9 10 11 12 13 14 15 16
选项 C B A D D D B A
二、填空题(共32分)
△17.(11分)(1)③④;①⑤;⑥;(5分,每项1分)
(2)①过量的CO2气体;②加热;③饱和的NaHCO3溶液。(各2分)
△18.(12分)(1)B:Na2O(2分);D:NaOH(2分);E:Na2CO3(2分)
(2)2Na+2H2O=2NaOH+H2↑(2分);2Na2O2+2CO2= 2Na2CO3+O2(2分);
2NaOH+ CO2= Na2CO3+H2O(2分)。
★19.(12分) (1)Cl2;2Br-+Cl2=2Cl-+Br2 (2分)
(2)②Mg2++2OH-=Mg(OH)2↓(2分)
④2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
(3)MgCl2 Mg+Cl2↑(2分)
(4)Mg(OH)2+2H+= Mg2++2H2O(2分) Mg2++CO32-= MgCO3↓(2分)
★20.(11分)(1)A:NaHCO3(2分);E:Na2O2(2分)
①:2NaHCO3Na2CO3+H2O+CO2↑(2分)
③:2Na2O2+2H2O=4NaOH+O2(2分)
⑤:2Na+O2Na2O2(2分);③⑤(1分)
21.(10分)(1)略(2分); (2)FeCl3; CuCl2(各2分)
(3)3.2g(2分) (4)2Fe3++Cu=2Fe2++Cu2+(2分)
三、实验题(共12分)
22.(12分) (1)浓盐酸 (1分);MnO2 (1分);
MnO2+4H++2Cl--Mn2++Cl2↑+2H2O(2分);
(2)饱和食盐水 (1分);吸水氯气中的水蒸气 (1分)
(3)不褪色 (1分);
(4)棕黄色的烟 (1分);防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管 (1分)
(4)NaOH溶液 (1分) Cl2+2OH-=Cl-+ClO-+H2O(2分)
四、计算题(共7分)
23.(7分)(1)10.6g(4分);(2)3.36L(3分)
附加题:另加15分
24.(15分)(1)使反应装置中生成的CO2完全排入碱石灰吸收装置中。(2分)
(2)①在A、C中加入B装置,防止了水蒸气对测定的干扰;(2分)
②D装置防止了通入空气时引入CO2的干扰。(2分)
(3)①C装置中的碱石灰会吸收空气中的CO2和水蒸气,从而影响测定结果。(2分)
②在C装置之后再连接一个盛有碱石灰的干燥管。(2分,其它合理答案同样得分)
(4)或×100﹪等其它合理答案(3分)(5)劣于。(2分)
A
C
E
B
D
空气中短期放置
空气中点燃
CO2
H2O
H2O
H2O
熟石灰
分离
④
精制
③
⑤
①
②
进海渠
日晒分离
海
水
苦卤
(含Mg2+、Br-等)
氢氧化镁
氯化镁
Br-等
镁
粗盐
精盐
烧碱、氯气、氢气
溴
(△)
A
B
C
D
D
F
G
E
H
B
E
E
④
(△)
①
②
③
⑤
电解
电解
