四川省宜宾市叙州二中2021届高三上学期开学考试理综-化学试题 Word版含答案
文档属性
| 名称 | 四川省宜宾市叙州二中2021届高三上学期开学考试理综-化学试题 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 471.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-02 00:00:00 | ||
图片预览


文档简介
2020年秋四川省叙州二中高三开学考试
理科综合化学
7.“白墙黑瓦青石板,烟雨小巷油纸伞”,是著名诗人戴望舒《雨巷》中描述的景象,下列有关说法中错误的是
A.“白墙”的白色源于墙体表层的CaO
B.“黑瓦”与陶瓷的主要成分都是硅酸盐
C.做伞骨架的竹纤维的主要成分可表示为(C6H10O5)n
D.刷在伞面上的熟桐油是天然植物油,具有防水作用
8.设NA为阿伏加德罗常数的值,下列说法正确的是
A.100 g溶质质量分数为46%的乙醇水溶液中,含有4NA个氧原子
B.标准状况下,11 g T216O中含有的质子数目为6NA
C.3.65 g液态HCl中含有的粒子总数为0.2NA
D.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+
9.化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.化合物X不能发生氧化反应
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W、X、Y的最外层电子数之和与Z的最外层电子数相等,Y的族序数等于其周期数。下列说法错误的是
A.四种元素形成的单质中,Z的单质沸点最低 B.WZ3中W满足8电子稳定结构
C.Y、Z形成的化合物的水溶液呈酸性 D.X的氧化物可能既含离子键又含共价键
11.对下列实验现象或操作解释正确的是
现象或操作 解释
A KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 SO2具有漂白性
B 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 抑制Fe3+水解,并防止Fe3+变质
C 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 不能说明该溶液中一定含有SO42-
D 向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 Ksp(Ag2S)<Ksp(CuS)
A.A B.B C.C D.D
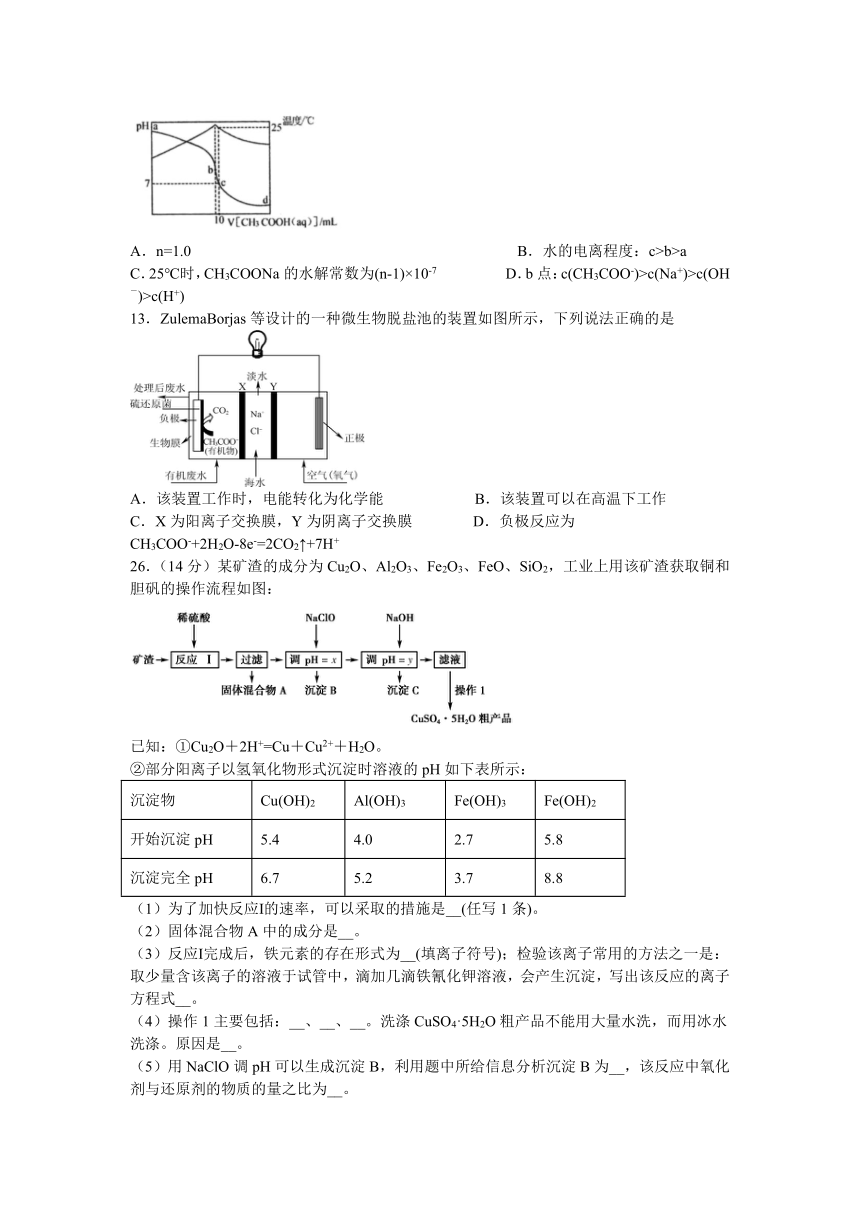
12.在某温度时,将n mol/L醋酸滴入10mL 1.0mo/L氢氧化钠溶液中,溶液pH和温度随加入醋酸体积变化曲线如图所示。下列有关说法正确的是
A.n=1.0 B.水的电离程度:c>b>a
C.25℃时,CH3COONa的水解常数为(n-1)×10-7 D.b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
13.ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
A.该装置工作时,电能转化为化学能 B.该装置可以在高温下工作
C.X为阳离子交换膜,Y为阴离子交换膜 D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
26.(14分)某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 Cu(OH)2 Al(OH)3 Fe(OH)3 Fe(OH)2
开始沉淀pH 5.4 4.0 2.7 5.8
沉淀完全pH 6.7 5.2 3.7 8.8
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。
27.(14分)硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为)直接制取硫酸铅粉末的转化流程图如下:
已知:①②
回答下列问题:
(1)浸出过程中,产物中以形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________。
(3)氧化过程中通常加入,发生反应的离子方程式为__________。
(4)向固体中加入,发生反应的方程式为,计算该反应的平衡常数为________。
(5)单位体积溶液中加入的质量对方铅矿的浸出率的影响如图,高于之后,浸出率基本不变,可能的原因是_____________。
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________(任写两点)。
28.(15分)丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中的配比对催化剂活性的影响如表所示。其中C3H6收率最高时的配比是___。
35.[化学——选修3:物质结构与性质](15分)
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
36.[化学——选修5:有机化学基础](15分)
药物中间体Q、医用材料PVA的合成路线如下。
已知:
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
化学参考答案
7.A 8.A 9.C 10.B 11.C 12.C 13.D
26.适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 SiO2、Cu Fe2+ 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 蒸发浓缩 冷却结晶 过滤 冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失 Fe(OH)3 1:2 5.2~5.4或5.2≤pH<5.4
27. 是吸热反应,降温有助于平衡逆向移动,便于获得更多的固体 浸出后的溶液已经是的饱和溶液,再增加氯化钠,浸取率基本不变 流程简单;能耗低;不产生,对环境无污染
28.+125kJ/mol 20% 5000 B > C+CO2=2CO有利于消除积炭 1:2.4
35.第五周期VIII族 N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子
36.取代反应 浓硫酸、浓硝酸 碳碳双键、酯基
理科综合化学
7.“白墙黑瓦青石板,烟雨小巷油纸伞”,是著名诗人戴望舒《雨巷》中描述的景象,下列有关说法中错误的是
A.“白墙”的白色源于墙体表层的CaO
B.“黑瓦”与陶瓷的主要成分都是硅酸盐
C.做伞骨架的竹纤维的主要成分可表示为(C6H10O5)n
D.刷在伞面上的熟桐油是天然植物油,具有防水作用
8.设NA为阿伏加德罗常数的值,下列说法正确的是
A.100 g溶质质量分数为46%的乙醇水溶液中,含有4NA个氧原子
B.标准状况下,11 g T216O中含有的质子数目为6NA
C.3.65 g液态HCl中含有的粒子总数为0.2NA
D.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+
9.化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.化合物X不能发生氧化反应
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W、X、Y的最外层电子数之和与Z的最外层电子数相等,Y的族序数等于其周期数。下列说法错误的是
A.四种元素形成的单质中,Z的单质沸点最低 B.WZ3中W满足8电子稳定结构
C.Y、Z形成的化合物的水溶液呈酸性 D.X的氧化物可能既含离子键又含共价键
11.对下列实验现象或操作解释正确的是
现象或操作 解释
A KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 SO2具有漂白性
B 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 抑制Fe3+水解,并防止Fe3+变质
C 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 不能说明该溶液中一定含有SO42-
D 向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 Ksp(Ag2S)<Ksp(CuS)
A.A B.B C.C D.D
12.在某温度时,将n mol/L醋酸滴入10mL 1.0mo/L氢氧化钠溶液中,溶液pH和温度随加入醋酸体积变化曲线如图所示。下列有关说法正确的是
A.n=1.0 B.水的电离程度:c>b>a
C.25℃时,CH3COONa的水解常数为(n-1)×10-7 D.b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
13.ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
A.该装置工作时,电能转化为化学能 B.该装置可以在高温下工作
C.X为阳离子交换膜,Y为阴离子交换膜 D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
26.(14分)某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 Cu(OH)2 Al(OH)3 Fe(OH)3 Fe(OH)2
开始沉淀pH 5.4 4.0 2.7 5.8
沉淀完全pH 6.7 5.2 3.7 8.8
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。
27.(14分)硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为)直接制取硫酸铅粉末的转化流程图如下:
已知:①②
回答下列问题:
(1)浸出过程中,产物中以形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________。
(3)氧化过程中通常加入,发生反应的离子方程式为__________。
(4)向固体中加入,发生反应的方程式为,计算该反应的平衡常数为________。
(5)单位体积溶液中加入的质量对方铅矿的浸出率的影响如图,高于之后,浸出率基本不变,可能的原因是_____________。
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________(任写两点)。
28.(15分)丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中的配比对催化剂活性的影响如表所示。其中C3H6收率最高时的配比是___。
35.[化学——选修3:物质结构与性质](15分)
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
36.[化学——选修5:有机化学基础](15分)
药物中间体Q、医用材料PVA的合成路线如下。
已知:
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
化学参考答案
7.A 8.A 9.C 10.B 11.C 12.C 13.D
26.适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 SiO2、Cu Fe2+ 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 蒸发浓缩 冷却结晶 过滤 冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失 Fe(OH)3 1:2 5.2~5.4或5.2≤pH<5.4
27. 是吸热反应,降温有助于平衡逆向移动,便于获得更多的固体 浸出后的溶液已经是的饱和溶液,再增加氯化钠,浸取率基本不变 流程简单;能耗低;不产生,对环境无污染
28.+125kJ/mol 20% 5000 B > C+CO2=2CO有利于消除积炭 1:2.4
35.第五周期VIII族 N>O>C 平面三角形 sp2 直线形 1:1 不是 H2O和NO 0价 分子
36.取代反应 浓硫酸、浓硝酸 碳碳双键、酯基
同课章节目录
