四川省宜宾市叙州一中2021届高三上学期开学考试理综-化学试题 Word版含答案
文档属性
| 名称 | 四川省宜宾市叙州一中2021届高三上学期开学考试理综-化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 281.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-02 11:16:13 | ||
图片预览

文档简介
2020年秋四川省叙州一中高三开学考试
理科综合化学
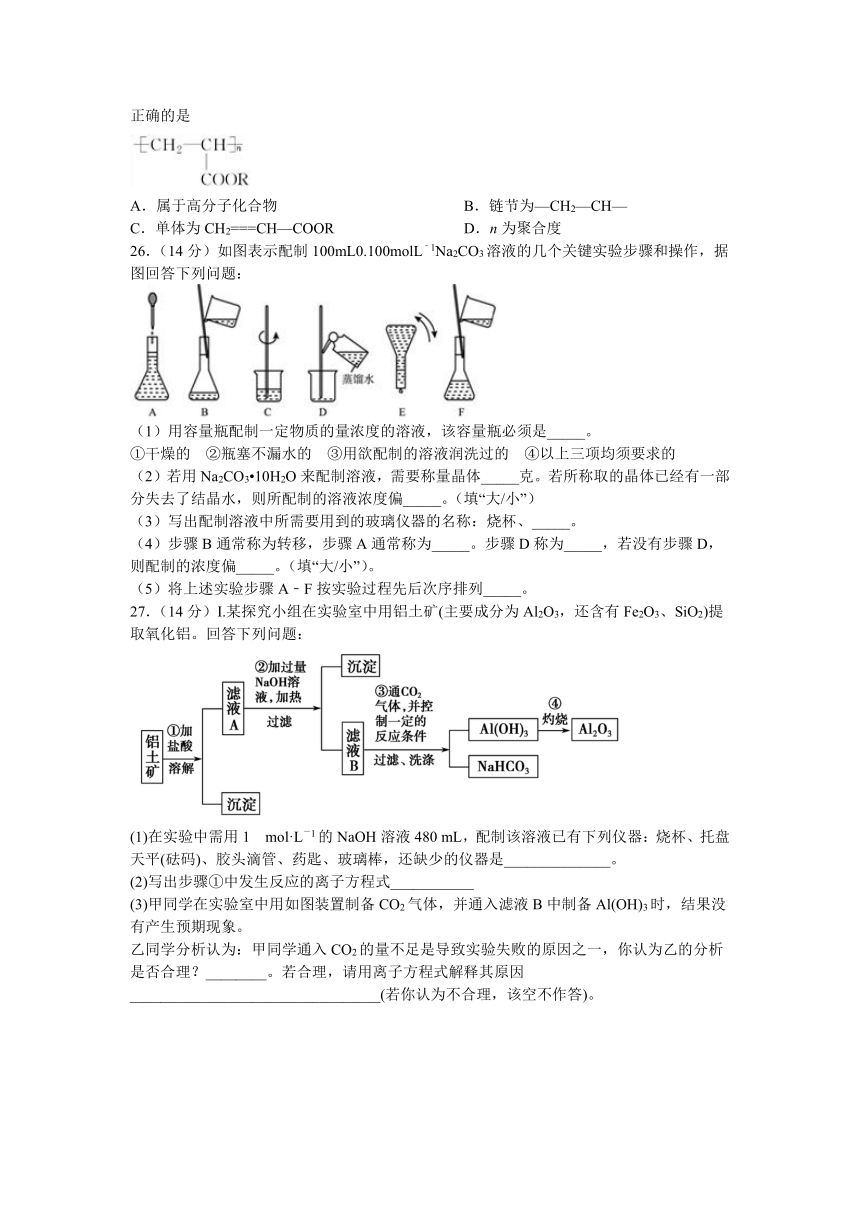
7.下列说法正确的是
A.植物油和矿物油都是酯,都可以作为有机溶剂
B.“酒是陈年香”是因为酒的保存过程中有酯生成
C.人的三大营养物质是糖、蛋白质与油脂,前两种是高分子化合物
D.蛋白质的盐析是可逆的,可用于精制蛋白质.所以,动物食用NaCl是不会中毒的
8.NA表示阿伏加德罗常数的值。下列说法正确的是
A.1molYb(镱)中含有的中子数为70NA
B.常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C.在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D.常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
9.下列有关物质性质或用途的说法不正确的是
A.常温下浓硫酸可贮存在铁罐中
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.燃着的镁条放入盛满二氧化碳的集气瓶中可继续燃烧
D.铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
10.用下列实验装置进行相应的实验,能达到实验目的的是
A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去Cl2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
11.能正确表示下列化学反应的离子方程式的是
A.氢氧化钡溶液与稀硝酸反应:OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.醋酸与氢氧化钠溶液反应:H++OH-=H2O
D.碳酸钡溶于稀盐酸中:CO32-+2H+=H2O+CO2↑
12.X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体。下列叙述正确的是
A.原子半径的大小:Z>X>Y B.Z的氢化物的沸点比X的高
C.W的最高价氧化物对应水化物的酸性在同主族中最强 D.Y的单质可通过铝热反应冶炼
13.聚丙烯酸酯的结构简式如图所示,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是
A.属于高分子化合物 B.链节为—CH2—CH—
C.单体为CH2===CH—COOR D.n为聚合度
26.(14分)如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO3?10H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
27.(14分)I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。
II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉?碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
28.(15分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)?H=-1648kJ/mol
C(s)+O2(g)=CO2(g)?H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)?H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
35.[化学——选修3:物质结构与性质](15分)
硼、硅、硒等元素及其化合物用途广泛。请回答下列问题:
(1)基态硒原子的价电子排布式为_______;SeO2常温下为白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体为________晶体。
(2)在硼、硅、硒的气态氢化物中,其立体构型为正四面体的是_______(填化学式),在硅的氢化物中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性大小为Se_____Si(填“>”或“<”)。
(3)在周期表的第二周期中,第一电离能介于硼元素和氮元素之间的元素有_____种。
(4)硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3·NH3中B与N之间形成______键;NH3中N原子的杂化轨道类型为______,写出与NH3等电子体的一种离子符号________。
(5)金刚砂(SiC)的摩氏硬度为9.5,其晶胞结构如图所示。在SiC中,每个Si原子周围距离最近的Si原子数目为________;若金刚砂的密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则晶胞中碳原子与硅原子的最近距离为________pm。(用含ρ和NA的式子表示)
36.[化学——选修5:有机化学基础](15分)
消炎药洛索洛芬的一种合成路线如下:
回答下列问题:
(1)A的化学名称为___________,烃基-R的结构简式为___________。
(2)脱羧反应是羧酸失去羧基放出CO2的反应。①~⑦中,包含脱羧反应的有___________。
(3)写出反应⑤的化学方程式(注明反应条件):___________。
(4)G中所含官能团的名称为___________。
(5)写岀与C互为同分异构体的芳香酯的结构简式(核磁共振氢谱为两组峰,峰面积比为3︰2):___________。
(6)设计由A和乙炔为起始原料制备3-丁烯酸(CH2=CHCH2COOH)的合成路线(无机试剂任选) _______。
化学参考答案
7.B 8.D 9.D 10.A 11.A 12.C 13.B
26.② 2.9 大 玻璃棒,胶头滴管、100 mL容量瓶 定容 洗涤 小 CBDFAE
27.500mL容量瓶;Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O合理CO2+2OH-=CO32-+H2O2I-+ClO-+2H+=Cl-+I2+H2O4×10-3molClO->I2>SO42-
28.Fe2O3+6H+=2Fe3++3H2O BC Fe2+被氧化为Fe3+,Fe3+水解产生H+ FeS2+4e-=Fe+2S2- 4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) ?H=-256kJ/mol -
35.4s24p4 分子 SiH4 > 3 配位 sp3 H3O+ 12
36.丙二酸二乙酯; ③⑦ +CH3OH+H2O; 羰基和酯基; CH2=CHClCH2=CH-CH2COOH;
理科综合化学
7.下列说法正确的是
A.植物油和矿物油都是酯,都可以作为有机溶剂
B.“酒是陈年香”是因为酒的保存过程中有酯生成
C.人的三大营养物质是糖、蛋白质与油脂,前两种是高分子化合物
D.蛋白质的盐析是可逆的,可用于精制蛋白质.所以,动物食用NaCl是不会中毒的
8.NA表示阿伏加德罗常数的值。下列说法正确的是
A.1molYb(镱)中含有的中子数为70NA
B.常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C.在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D.常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
9.下列有关物质性质或用途的说法不正确的是
A.常温下浓硫酸可贮存在铁罐中
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.燃着的镁条放入盛满二氧化碳的集气瓶中可继续燃烧
D.铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
10.用下列实验装置进行相应的实验,能达到实验目的的是
A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去Cl2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
11.能正确表示下列化学反应的离子方程式的是
A.氢氧化钡溶液与稀硝酸反应:OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.醋酸与氢氧化钠溶液反应:H++OH-=H2O
D.碳酸钡溶于稀盐酸中:CO32-+2H+=H2O+CO2↑
12.X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体。下列叙述正确的是
A.原子半径的大小:Z>X>Y B.Z的氢化物的沸点比X的高
C.W的最高价氧化物对应水化物的酸性在同主族中最强 D.Y的单质可通过铝热反应冶炼
13.聚丙烯酸酯的结构简式如图所示,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是
A.属于高分子化合物 B.链节为—CH2—CH—
C.单体为CH2===CH—COOR D.n为聚合度
26.(14分)如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO3?10H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
27.(14分)I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。
II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉?碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
28.(15分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)?H=-1648kJ/mol
C(s)+O2(g)=CO2(g)?H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)?H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
35.[化学——选修3:物质结构与性质](15分)
硼、硅、硒等元素及其化合物用途广泛。请回答下列问题:
(1)基态硒原子的价电子排布式为_______;SeO2常温下为白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体为________晶体。
(2)在硼、硅、硒的气态氢化物中,其立体构型为正四面体的是_______(填化学式),在硅的氢化物中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性大小为Se_____Si(填“>”或“<”)。
(3)在周期表的第二周期中,第一电离能介于硼元素和氮元素之间的元素有_____种。
(4)硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3·NH3中B与N之间形成______键;NH3中N原子的杂化轨道类型为______,写出与NH3等电子体的一种离子符号________。
(5)金刚砂(SiC)的摩氏硬度为9.5,其晶胞结构如图所示。在SiC中,每个Si原子周围距离最近的Si原子数目为________;若金刚砂的密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则晶胞中碳原子与硅原子的最近距离为________pm。(用含ρ和NA的式子表示)
36.[化学——选修5:有机化学基础](15分)
消炎药洛索洛芬的一种合成路线如下:
回答下列问题:
(1)A的化学名称为___________,烃基-R的结构简式为___________。
(2)脱羧反应是羧酸失去羧基放出CO2的反应。①~⑦中,包含脱羧反应的有___________。
(3)写出反应⑤的化学方程式(注明反应条件):___________。
(4)G中所含官能团的名称为___________。
(5)写岀与C互为同分异构体的芳香酯的结构简式(核磁共振氢谱为两组峰,峰面积比为3︰2):___________。
(6)设计由A和乙炔为起始原料制备3-丁烯酸(CH2=CHCH2COOH)的合成路线(无机试剂任选) _______。
化学参考答案
7.B 8.D 9.D 10.A 11.A 12.C 13.B
26.② 2.9 大 玻璃棒,胶头滴管、100 mL容量瓶 定容 洗涤 小 CBDFAE
27.500mL容量瓶;Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O合理CO2+2OH-=CO32-+H2O2I-+ClO-+2H+=Cl-+I2+H2O4×10-3molClO->I2>SO42-
28.Fe2O3+6H+=2Fe3++3H2O BC Fe2+被氧化为Fe3+,Fe3+水解产生H+ FeS2+4e-=Fe+2S2- 4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) ?H=-256kJ/mol -
35.4s24p4 分子 SiH4 > 3 配位 sp3 H3O+ 12
36.丙二酸二乙酯; ③⑦ +CH3OH+H2O; 羰基和酯基; CH2=CHClCH2=CH-CH2COOH;
同课章节目录
