黑龙江省佳木斯一中2021届高三上学期第三次调研(开学考试)考试化学试题
文档属性
| 名称 | 黑龙江省佳木斯一中2021届高三上学期第三次调研(开学考试)考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 437.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-03 22:15:04 | ||
图片预览


文档简介
1107440011811000佳木斯一中2021届高三上学期第三次调研(开学考试)考试
化学试题
本试题分选择题和非选择题两部分。时间90分钟,满分100?分。
可能用到的相对原子质量:H 1? C 12 N?14 O 16 ?Na 23 Cl 35.5
第I卷 (选择题共56分)
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中只有一项是符合题目要求的)
1.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.蜡是高级脂肪酸酯,属于高分子聚合物
2.关于化合物2-苯基丙烯(),?下列说法?正确的是( ?)
A.不能使酸性高锰酸钾溶液褪色
B.可以发生加成聚合反应
C.分子中所有原子共平面
D.易溶于水及甲苯
3.下列说法不正确的是
A.煤的干馏发生了化学变化
B.淀粉和纤维素互为同分异构体
C.羊毛、塑料、合成橡胶都属于有机高分子材料
D.利用油脂在碱性条件下的水解,可以制得肥皂
4?NA以是阿伏加德罗常数的值,下列说法正确的是
A.3 g3He含有的中子数为NA
B.1?mol?Fe溶于过量硝酸,电子转移数为2NA
C.标准状况下,2.24?LCCI4含有的共价键数为0.4NA
D.1 mol?K2Cr2O7全部被还原为Cr3+时,转移的电子数为3NA
5.?NA是阿伏加德罗常数的值,下列说法正确的是
A.钠在空气中燃烧可生成多种氧化物。23 g?钠充分燃烧时转移电子数为1NA
B.标准状况下,?22.4 L氯气与足量铝充分反应,转移的电子数为3NA
C.1 mol?NaCl约含有6.02x1023个NaCl分子
D.物质的量浓度为0.5?mol/L?MgCl2溶液中,含有C1-个数一定为?NA
6.下列离子方程式书写正确的是
A.钠与水反应:?Na+2H2O=Na++2OH-+H2↑
B.稀盐酸与铁屑反应:?2Fe+6H+=2Fe3++3H2↑
C.碳酸氢钠溶液与氢氧化钠溶液反应:HCO3-+OH-?=CO32-?+H20
D.向碳酸钠溶液中加入少量盐酸:CO32-?+2H+=CO2↑+H2O
7.相同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,其c(Cl-)之比是
A.1:2:3 B.3:2:?1 C.1:1:1 D.?6:3:?1
8.以乙醇为原料设计合成 的方案,需要经过的反应类型是
A.消去、取代、水解、加成
B.消去、加成、水解、取代
c.消去、加成、取代、水解
D.取代、消去、加成、水解
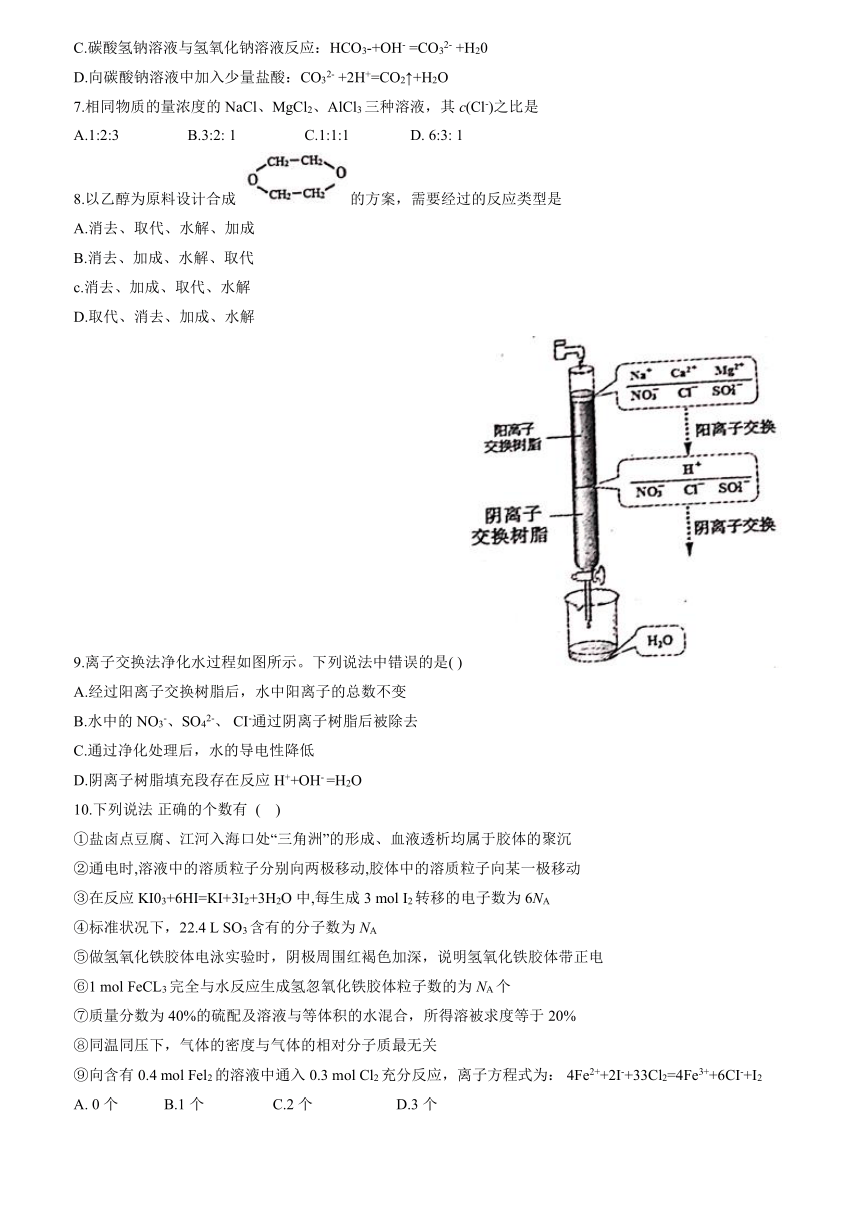
9.离子交换法净化水过程如图所示。下列说法中错误的是(?)
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、?CI-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-?=H2O
10.下列说法?正确的个数有 ( )
①盐卤点豆腐、江河入海口处“三角洲”的形成、血液透析均属于胶体的聚沉
②通电时,溶液中的溶质粒子分别向两极移动,胶体中的溶质粒子向某一极移动
③在反应KI03+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
④标准状况下,22.4 L?SO3含有的分子数为NA
⑤做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电
⑥1 mol?FeCL3完全与水反应生成氢忽氧化铁胶体粒子数的为NA个
⑦质量分数为40%的硫配及溶液与等体积的水混合,所得溶被求度等于20%
⑧同温同压下,气体的密度与气体的相对分子质最无关
⑨向含有0.4?mol?Fel2的溶液中通入0.3?mol?Cl2充分反应,离子方程式为:?4Fe2++2I-+33Cl2=4Fe3++6CI-+I2
A.?0个 B.1个 C.2个 D.3个
二选择题(本题共12小题,每小题3分,共36分。在每小题给出的四个选项中只有一项是符合题目要求的)
11.分类是学习化学的重要方法。下列归纳正确的是(?)
A.?SO2、SiO2、?CO均为酸性氧化物
B.纯碱、烧碱、熟石灰都属于碱类
C.氨气、冰醋酸、食盐均为电解质
D.碱性氧化物都是金属氧化物
12.室温下,下列各组离子在指定溶液中能大量共存的是(?)
A.0.1?mol/LNaOH溶液:?Na+、?K+、Co32-、?AlO2-
B.0.1?mol/LFeCl2溶液:?K+、Mg2+、0H-、MnO4-
C.0.1?mol/LK2CO3溶液:?Na+、?Ba2+、?CI-、H+
D.0.1?mol/LH2SO4溶液:?Ag+、?NH4+、NO3-、?HCO3-
13.下列离子方程式书写正确的是
A.向沸水中滴加饱和氯化铁溶液得到胶体:Fe3++3H2O=?Fe(OH)3↓+3H+
B.?Ca?(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.氧化亚铁溶于稀硝酸:FeO+2H+?=?Fe2+?+H2O
D.Na与CuSO4水溶液反应:?2Na+Cu2+?=Cu+2Na+
14.已知:?2KMnO4+16HCI(浓)?=?2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正确的是
A.HCl发生了还原反应
B.氧化性:?Cl2>KMnO4
C.氧化剂与还原剂的物质的量比为1:8
D.当标准状况下产生22.4 L氯气,转移电子数为2NA
15.下列叙述中不正确的是
A.?Na2O2?是淡黄色固体,?Na2O是白色固体,二者都能与水反应生成
B.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
C.?Na2O?与CO2发生化合反应生成Na2CO3,Na2O2?与CO2发生置换反应生成O2
D.2gH2充分燃烧后产物被Na2O2完全吸收,?Na2O2固体增重2 g
16.下列叙述正确的的是
A.Na2CO3溶液和NaHCO3溶液可以用Ca(OH)2溶液鉴别
B.小苏打和氢氧化铝均可与盐酸反应,在医药上常用作胃酸中和剂
C.?Na2O?和Na2O2都能与水反应产生碱,所以它们都是碱性氧化物
D.灼烧白色粉末,火焰呈黄色,证明该粉末中有Na+,无K+
17.分子式为C4H9Cl的有机物共有(不含立体异构)( )
A.6种 B.5种 C.?4种 D.3种
18.香叶醇是合成成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
19.甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
A.甲、乙的化学式均为C8H14
B.乙的一氯代物共有2种(不考虑立体异构)
c.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
20.下列实验装置图正确的是 ( )
A.实验室制备及收集乙烯乙酯
B.石油分馏
C.实验室制硝基苯
D.实验室制乙酸乙酯
21.用下列方法均可制得氯气:
①MnO2+4HCl(浓) MnCl+Cl2↑+2H2O
②KClO3+?6HCl(浓)=KCl+3Cl2↑+3H2O
③2KMnO4+?16HCl(浓)=2KCl+2MnCl2+?5Cl2↑+?8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为(?)
A.6:5:6 B.?1?:3:5 C.1:1:1 D.1:6:10
22.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列说法不正确的是
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
第II卷 (非选铎题共44分)
三、填空题
23.?(10分)1.有A、B、C、D四种化合物,分别由K+、Ba2+、?SO42-、CO32-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;
②B不溶于水,但洛于盐酸,并放出无色无刺敬性气味的气体E;
③C的水溶液呈破性,与硫酸反应生成A;
④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、D的化学式:A、_______,?D、_____________。
(2)写出下列反应的离子方程式。
B与盐酸反应:___________________________。
C与硫酸反应:___________________________。
E(少量)与澄清石灰水反应:___________________________。
II?.(3)用单线桥法表示反应Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑电子转移的方向和数目(在化学方程式上标出)_____________________。
24.?(6?分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HC1的物质的量浓度为__________mol/。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.200 mol/L的稀盐酸。
①本实验除了用到量筒、烧杯、玻璃棒,还要用到的玻璃仪器是__________、_____________。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有_________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面。
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
25.?(14?分)过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_____溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
①A中发生反应离子方程式为_________________。
②将仪器连接好以后,必须进行的第一步操作是_________________。
③B装置出来的气体是否需要干燥__________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_________________。。
⑤D中NaOH溶液的作用_________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_________________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_____________。
26.(14分)化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)A中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳___________________。
(3)反应④所需的试剂和条件是____________________。
(4)⑤的反应类型是__________________。
(5)写出B到C的反应方程式___________________。
(6)与B互为同分异构体,且具有六元环结构、并能发生银镜反应的有机物有________种(不考虑立体异构)。任意写出2个符合上述条件的有机物的结构简式______________、_________________。
化学试题
本试题分选择题和非选择题两部分。时间90分钟,满分100?分。
可能用到的相对原子质量:H 1? C 12 N?14 O 16 ?Na 23 Cl 35.5
第I卷 (选择题共56分)
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中只有一项是符合题目要求的)
1.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.蜡是高级脂肪酸酯,属于高分子聚合物
2.关于化合物2-苯基丙烯(),?下列说法?正确的是( ?)
A.不能使酸性高锰酸钾溶液褪色
B.可以发生加成聚合反应
C.分子中所有原子共平面
D.易溶于水及甲苯
3.下列说法不正确的是
A.煤的干馏发生了化学变化
B.淀粉和纤维素互为同分异构体
C.羊毛、塑料、合成橡胶都属于有机高分子材料
D.利用油脂在碱性条件下的水解,可以制得肥皂
4?NA以是阿伏加德罗常数的值,下列说法正确的是
A.3 g3He含有的中子数为NA
B.1?mol?Fe溶于过量硝酸,电子转移数为2NA
C.标准状况下,2.24?LCCI4含有的共价键数为0.4NA
D.1 mol?K2Cr2O7全部被还原为Cr3+时,转移的电子数为3NA
5.?NA是阿伏加德罗常数的值,下列说法正确的是
A.钠在空气中燃烧可生成多种氧化物。23 g?钠充分燃烧时转移电子数为1NA
B.标准状况下,?22.4 L氯气与足量铝充分反应,转移的电子数为3NA
C.1 mol?NaCl约含有6.02x1023个NaCl分子
D.物质的量浓度为0.5?mol/L?MgCl2溶液中,含有C1-个数一定为?NA
6.下列离子方程式书写正确的是
A.钠与水反应:?Na+2H2O=Na++2OH-+H2↑
B.稀盐酸与铁屑反应:?2Fe+6H+=2Fe3++3H2↑
C.碳酸氢钠溶液与氢氧化钠溶液反应:HCO3-+OH-?=CO32-?+H20
D.向碳酸钠溶液中加入少量盐酸:CO32-?+2H+=CO2↑+H2O
7.相同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,其c(Cl-)之比是
A.1:2:3 B.3:2:?1 C.1:1:1 D.?6:3:?1
8.以乙醇为原料设计合成 的方案,需要经过的反应类型是
A.消去、取代、水解、加成
B.消去、加成、水解、取代
c.消去、加成、取代、水解
D.取代、消去、加成、水解
9.离子交换法净化水过程如图所示。下列说法中错误的是(?)
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、?CI-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-?=H2O
10.下列说法?正确的个数有 ( )
①盐卤点豆腐、江河入海口处“三角洲”的形成、血液透析均属于胶体的聚沉
②通电时,溶液中的溶质粒子分别向两极移动,胶体中的溶质粒子向某一极移动
③在反应KI03+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
④标准状况下,22.4 L?SO3含有的分子数为NA
⑤做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电
⑥1 mol?FeCL3完全与水反应生成氢忽氧化铁胶体粒子数的为NA个
⑦质量分数为40%的硫配及溶液与等体积的水混合,所得溶被求度等于20%
⑧同温同压下,气体的密度与气体的相对分子质最无关
⑨向含有0.4?mol?Fel2的溶液中通入0.3?mol?Cl2充分反应,离子方程式为:?4Fe2++2I-+33Cl2=4Fe3++6CI-+I2
A.?0个 B.1个 C.2个 D.3个
二选择题(本题共12小题,每小题3分,共36分。在每小题给出的四个选项中只有一项是符合题目要求的)
11.分类是学习化学的重要方法。下列归纳正确的是(?)
A.?SO2、SiO2、?CO均为酸性氧化物
B.纯碱、烧碱、熟石灰都属于碱类
C.氨气、冰醋酸、食盐均为电解质
D.碱性氧化物都是金属氧化物
12.室温下,下列各组离子在指定溶液中能大量共存的是(?)
A.0.1?mol/LNaOH溶液:?Na+、?K+、Co32-、?AlO2-
B.0.1?mol/LFeCl2溶液:?K+、Mg2+、0H-、MnO4-
C.0.1?mol/LK2CO3溶液:?Na+、?Ba2+、?CI-、H+
D.0.1?mol/LH2SO4溶液:?Ag+、?NH4+、NO3-、?HCO3-
13.下列离子方程式书写正确的是
A.向沸水中滴加饱和氯化铁溶液得到胶体:Fe3++3H2O=?Fe(OH)3↓+3H+
B.?Ca?(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.氧化亚铁溶于稀硝酸:FeO+2H+?=?Fe2+?+H2O
D.Na与CuSO4水溶液反应:?2Na+Cu2+?=Cu+2Na+
14.已知:?2KMnO4+16HCI(浓)?=?2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正确的是
A.HCl发生了还原反应
B.氧化性:?Cl2>KMnO4
C.氧化剂与还原剂的物质的量比为1:8
D.当标准状况下产生22.4 L氯气,转移电子数为2NA
15.下列叙述中不正确的是
A.?Na2O2?是淡黄色固体,?Na2O是白色固体,二者都能与水反应生成
B.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
C.?Na2O?与CO2发生化合反应生成Na2CO3,Na2O2?与CO2发生置换反应生成O2
D.2gH2充分燃烧后产物被Na2O2完全吸收,?Na2O2固体增重2 g
16.下列叙述正确的的是
A.Na2CO3溶液和NaHCO3溶液可以用Ca(OH)2溶液鉴别
B.小苏打和氢氧化铝均可与盐酸反应,在医药上常用作胃酸中和剂
C.?Na2O?和Na2O2都能与水反应产生碱,所以它们都是碱性氧化物
D.灼烧白色粉末,火焰呈黄色,证明该粉末中有Na+,无K+
17.分子式为C4H9Cl的有机物共有(不含立体异构)( )
A.6种 B.5种 C.?4种 D.3种
18.香叶醇是合成成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
19.甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
A.甲、乙的化学式均为C8H14
B.乙的一氯代物共有2种(不考虑立体异构)
c.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
20.下列实验装置图正确的是 ( )
A.实验室制备及收集乙烯乙酯
B.石油分馏
C.实验室制硝基苯
D.实验室制乙酸乙酯
21.用下列方法均可制得氯气:
①MnO2+4HCl(浓) MnCl+Cl2↑+2H2O
②KClO3+?6HCl(浓)=KCl+3Cl2↑+3H2O
③2KMnO4+?16HCl(浓)=2KCl+2MnCl2+?5Cl2↑+?8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为(?)
A.6:5:6 B.?1?:3:5 C.1:1:1 D.1:6:10
22.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列说法不正确的是
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
第II卷 (非选铎题共44分)
三、填空题
23.?(10分)1.有A、B、C、D四种化合物,分别由K+、Ba2+、?SO42-、CO32-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;
②B不溶于水,但洛于盐酸,并放出无色无刺敬性气味的气体E;
③C的水溶液呈破性,与硫酸反应生成A;
④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、D的化学式:A、_______,?D、_____________。
(2)写出下列反应的离子方程式。
B与盐酸反应:___________________________。
C与硫酸反应:___________________________。
E(少量)与澄清石灰水反应:___________________________。
II?.(3)用单线桥法表示反应Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑电子转移的方向和数目(在化学方程式上标出)_____________________。
24.?(6?分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HC1的物质的量浓度为__________mol/。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.200 mol/L的稀盐酸。
①本实验除了用到量筒、烧杯、玻璃棒,还要用到的玻璃仪器是__________、_____________。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有_________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面。
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
25.?(14?分)过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_____溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
①A中发生反应离子方程式为_________________。
②将仪器连接好以后,必须进行的第一步操作是_________________。
③B装置出来的气体是否需要干燥__________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_________________。。
⑤D中NaOH溶液的作用_________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_________________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_____________。
26.(14分)化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)A中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳___________________。
(3)反应④所需的试剂和条件是____________________。
(4)⑤的反应类型是__________________。
(5)写出B到C的反应方程式___________________。
(6)与B互为同分异构体,且具有六元环结构、并能发生银镜反应的有机物有________种(不考虑立体异构)。任意写出2个符合上述条件的有机物的结构简式______________、_________________。
同课章节目录
