人教版九年级化学上册 第六单元 碳和碳的氧化物 单元知识点、考点梳理(含答案)
文档属性
| 名称 | 人教版九年级化学上册 第六单元 碳和碳的氧化物 单元知识点、考点梳理(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 74.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-04 17:45:52 | ||
图片预览




文档简介
第六单元 碳和碳的氧化物
课题1 金刚石、石墨和C60
第1课时 碳单质的物理性质
一、碳单质的物理性质和用途
1.金刚石是一种____________、____________形状的固体,硬度__________。
可用于制________、________、玻璃刀等。
2.石墨是一种________色、有金属光泽、__________状固体,硬度__________,有良好的__________,且有____________。可用于制________、________、________等。
3.金刚石和石墨物理性质差异较大的原因是________________________。
注意:一种元素可以组成不同的单质,故同种元素组成的物质可能是________或________。同种元素组成的不同单质之间的转化属于________变化。
二、无定形碳
1.木炭:有________性,作吸附剂。
2.活性炭:有________性(比木炭强),作吸附剂,用于制作防毒面具等。
注意:吸附性是利用某些物质疏松多孔的结构把一些气体或色素吸附在表面,不是与其发生化学反应,吸附性是物理性质。
3.焦炭:用于冶炼金属。
4.炭黑:用于制油墨、填充橡胶(增加橡胶的耐磨性)。
第2课时 碳单质的化学性质
一、碳的化学性质
1.常温下,碳单质的化学性质________。因为碳原子最外层有4个电子,不易得失电子。
2.可燃性
(1)氧气充足:__________________(写出化学方程式)。
(2)氧气不充足:__________________(写出化学方程式)。
3.还原性
INCLUDEPICTURE"A+14.tif"
(1)木炭还原氧化铜
发生反应的化学方程式:C+2CuO2Cu+CO2↑
实验现象:________________________________________。
实验细节
①酒精灯加网罩的目的是________________________________。
②反应结束后,先__________________,再__________________,防止__________________________。
(2)木炭还原氧化铁的化学方程式:________________________________。
(3)木炭与二氧化碳反应的化学方程式:______________________________。
二、还原反应
含氧化合物里的氧被夺去的反应,叫做________反应。反应中提供氧的物质具有________性,夺取氧的物质具有________性。
课题2 二氧化碳制取的研究
一、实验室制取二氧化碳
1.药品:______________________________。
2.原理:______________________________。
注意:(1)不能用浓盐酸代替稀盐酸,因为_____________________________________________________。
(2)不能用碳酸钠代替石灰石(或大理石),因为_________________________________________________。
(3)不能用稀硫酸代替稀盐酸,因为__________________________________________________________。
3.装置
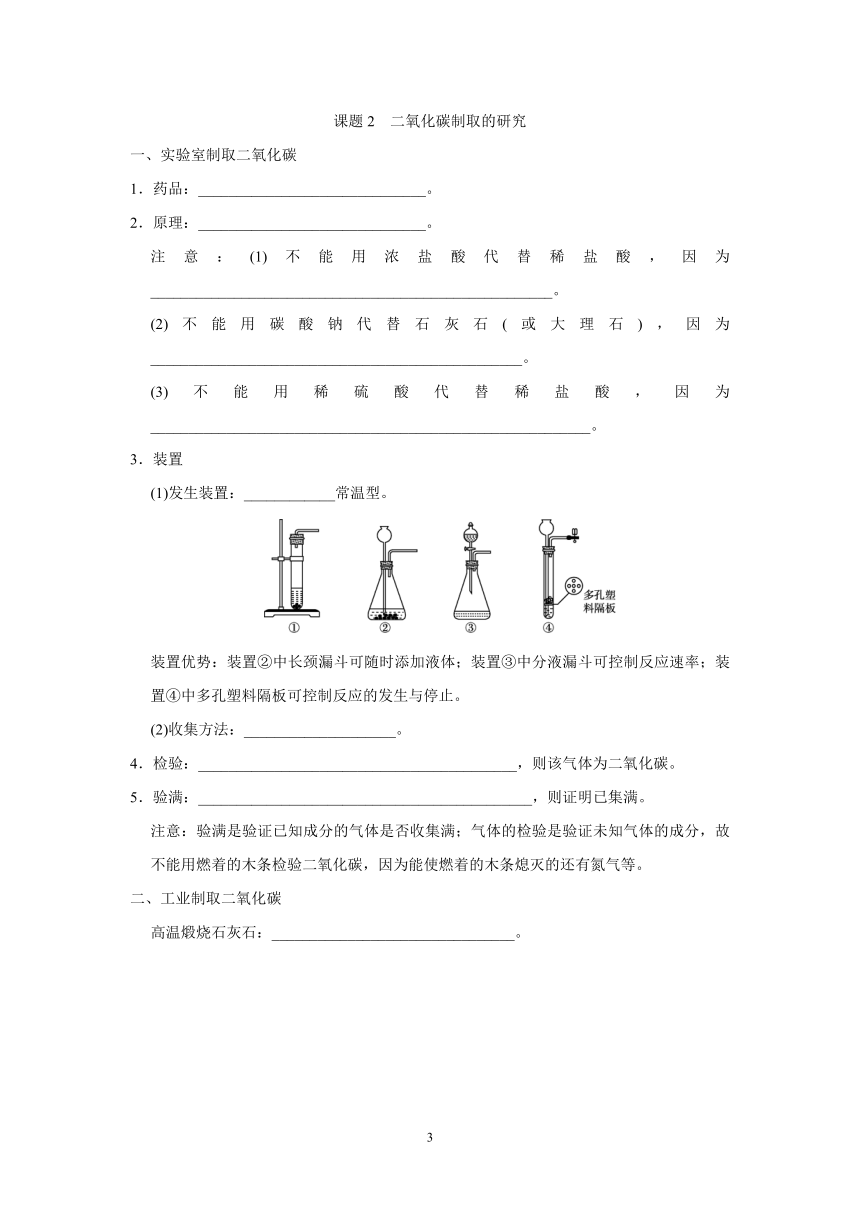
(1)发生装置:____________常温型。
INCLUDEPICTURE"A+15.tif"
装置优势:装置②中长颈漏斗可随时添加液体;装置③中分液漏斗可控制反应速率;装置④中多孔塑料隔板可控制反应的发生与停止。
(2)收集方法:____________________。
4.检验:__________________________________________,则该气体为二氧化碳。
5.验满:____________________________________________,则证明已集满。
注意:验满是验证已知成分的气体是否收集满;气体的检验是验证未知气体的成分,故不能用燃着的木条检验二氧化碳,因为能使燃着的木条熄灭的还有氮气等。
二、工业制取二氧化碳
高温煅烧石灰石:________________________________。
课题3 二氧化碳和一氧化碳
第1课时 二氧化碳
一、二氧化碳的性质
1.物理性质:通常状况下是一种____________的气体,密度比空气________,________溶于水。
固态二氧化碳称为________,易________。
2.化学性质
(1)一般情况下,二氧化碳不燃烧,也不________________。
(2)二氧化碳不能供给呼吸。
(3)二氧化碳能与水反应,反应的化学方程式为____________________________。
碳酸不稳定,容易分解,反应的化学方程式为______________________________。
(4)二氧化碳能与澄清石灰水反应,反应的化学方程式为______________________________
(现象:____________________),此反应用于检验二氧化碳。
(5)二氧化碳能与灼热的碳反应,反应的化学方程式为______________________________。
3.实验探究
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
操作
石蕊干花喷稀醋酸
石蕊干花喷水
石蕊干花直接放入二氧化碳中
石蕊干花喷水后放入二氧化碳中
烘干Ⅳ中的花
现象
变红
不变色
不变色
变红
变回紫色
分析
酸能使石蕊变红
______________________________
_____________________________
______________________________
碳酸分解
二、二氧化碳的用途
二氧化碳可用于________________________________________________________________________。
三、二氧化碳对环境的影响
1.二氧化碳不能供给呼吸,当空气中的二氧化碳超过正常量时,会对人体健康产生影响。因此在人群密集的地方应该注意通风换气。
2.引起温室效应
(1)温室气体有CO2、____________、____________、氟氯代烷(商品名为氟利昂)等。
(2)防止温室效应的措施:__________________________________。
第2课时 一氧化碳
一、一氧化碳
1.物理性质:通常状况下是一种______色______味的气体,密度比空气________,________溶于水。
2.化学性质
(1)可燃性
一氧化碳燃烧的化学方程式为________________________。
现象:燃烧产生蓝色火焰,放热,生成________________________气体。
(2)还原性
INCLUDEPICTURE"001.tif"
一氧化碳还原氧化铜的化学方程式为________________________________________________。
现象:____________________________________________。
注意:①先通气体再加热,目的是________________________。
②实验结束,先熄灭酒精灯A,继续通一氧化碳至冷却,目的是________________________________。
③一定要有尾气处理装置。
(3)毒性
一氧化碳极易与血液中的血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧中毒。
3.用途:(1)______________;(2)______________。
二、二氧化碳与一氧化碳
1.CO2和CO化学性质的比较:
CO2
CO
CO2不可燃
CO可燃
CO2无毒
CO有毒
能使澄清石灰水变浑浊
不能使澄清石灰水变浑浊
无还原性
有还原性
两者化学性质不同的原因:______________________________________________。
2.两种气体鉴别的方法:(1)___________________________________
________________________;
(2)______________________________________________________(写出两种即可)。
3.除去气体中的杂质:
(1)除去CO2中的CO:
_________________________________________________________(不能用点燃);
除去CO中的CO2:
___________________________________________________________;
除去CO2中的O2:
____________________________________________________________。
参考答案
第六单元 碳和碳的氧化物
课题1 金刚石、石墨和C60
第1课时 碳单质的物理性质
一、1.无色透明;正八面体;大;装饰品;钻头
2.深灰;细鳞片;小;导电性;滑腻感;铅笔芯;电极;润滑剂
3.碳原子排列方式不同;单质;混合物;化学
二、1.吸附
2.吸附
第2课时 碳单质的化学性质
一、1.不活泼
2.(1)C+O2CO2
(2)2C+O22CO
3.(1)黑色固体变为红色,澄清石灰水变浑浊
①集中火焰,提高加热温度
②将导管撤出;熄灭酒精灯;液体倒流,试管炸裂
(2)3C+2Fe2O34Fe+3CO2↑
(3)C+CO22CO
二、还原;氧化;还原
课题2 二氧化碳制取的研究
一、1.石灰石(或大理石)、稀盐酸
2.CaCO3+2HCl===CaCl2+H2O+CO2↑
(1)浓盐酸易挥发,使制得的二氧化碳不纯
(2)碳酸钠与稀盐酸反应速率太快,不利于收集
(3)稀硫酸与碳酸钙反应生成微溶的硫酸钙覆盖在石灰石(或大理石)表面,阻碍反应进一步进行
3.(1)固—液 (2)向上排空气法
4.将气体通入澄清石灰水中,若澄清石灰水变浑浊
5.将燃着的木条放在集气瓶口,若木条熄灭
二、CaCO3CaO+CO2↑
课题3 二氧化碳和一氧化碳
第1课时 二氧化碳
一、1.无色、无味;大;能;干冰;升华
2.(1)支持燃烧
(3)CO2+H2O===H2CO3;H2CO3===H2O+CO2↑
(4)CO2+Ca(OH)2===CaCO3↓+H2O;澄清石灰水变浑浊
(5)C+CO22CO
3.
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
操作
石蕊干花喷稀醋酸
石蕊干花喷水
石蕊干花直接放入二氧化碳中
石蕊干花喷水后放入二氧化碳中
烘干Ⅳ中的花
现象
变红
不变色
不变色
变红
变回紫色
分析
酸能使石蕊变红
水不能使石蕊变红
二氧化碳不能使石蕊变红
二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变成红色
碳酸分解
二、生产汽水等碳酸饮料、灭火、光合作用、人工降雨、化工原料等
三、2.(1)臭氧(O3);甲烷(CH4)
(2)减少化石燃料的使用、植树造林等
第2课时 一氧化碳
一、1.无;无;略小;难
2.(1)2CO+O22CO2;能使澄清石灰水变浑浊的
(2)CO+CuOCu+CO2;黑色固体变为红色,澄清石灰水变浑浊
①排尽空气,防止爆炸
②防止空气进入,铜再次被氧化
3.(1)作燃料
(2)冶炼金属
二、1.分子构成不同
2.(1)取样,伸入燃着的小木条,使木条熄灭的是CO2
(2)取样,加入适量的澄清石灰水,使澄清石灰水变浑浊的是CO2
3.(1)通过灼热的氧化铜
(2)通入氢氧化钠溶液(或通入澄清石灰水或通过灼热的碳)
(3)通过灼热的铜网
课题1 金刚石、石墨和C60
第1课时 碳单质的物理性质
一、碳单质的物理性质和用途
1.金刚石是一种____________、____________形状的固体,硬度__________。
可用于制________、________、玻璃刀等。
2.石墨是一种________色、有金属光泽、__________状固体,硬度__________,有良好的__________,且有____________。可用于制________、________、________等。
3.金刚石和石墨物理性质差异较大的原因是________________________。
注意:一种元素可以组成不同的单质,故同种元素组成的物质可能是________或________。同种元素组成的不同单质之间的转化属于________变化。
二、无定形碳
1.木炭:有________性,作吸附剂。
2.活性炭:有________性(比木炭强),作吸附剂,用于制作防毒面具等。
注意:吸附性是利用某些物质疏松多孔的结构把一些气体或色素吸附在表面,不是与其发生化学反应,吸附性是物理性质。
3.焦炭:用于冶炼金属。
4.炭黑:用于制油墨、填充橡胶(增加橡胶的耐磨性)。
第2课时 碳单质的化学性质
一、碳的化学性质
1.常温下,碳单质的化学性质________。因为碳原子最外层有4个电子,不易得失电子。
2.可燃性
(1)氧气充足:__________________(写出化学方程式)。
(2)氧气不充足:__________________(写出化学方程式)。
3.还原性
INCLUDEPICTURE"A+14.tif"
(1)木炭还原氧化铜
发生反应的化学方程式:C+2CuO2Cu+CO2↑
实验现象:________________________________________。
实验细节
①酒精灯加网罩的目的是________________________________。
②反应结束后,先__________________,再__________________,防止__________________________。
(2)木炭还原氧化铁的化学方程式:________________________________。
(3)木炭与二氧化碳反应的化学方程式:______________________________。
二、还原反应
含氧化合物里的氧被夺去的反应,叫做________反应。反应中提供氧的物质具有________性,夺取氧的物质具有________性。
课题2 二氧化碳制取的研究
一、实验室制取二氧化碳
1.药品:______________________________。
2.原理:______________________________。
注意:(1)不能用浓盐酸代替稀盐酸,因为_____________________________________________________。
(2)不能用碳酸钠代替石灰石(或大理石),因为_________________________________________________。
(3)不能用稀硫酸代替稀盐酸,因为__________________________________________________________。
3.装置
(1)发生装置:____________常温型。
INCLUDEPICTURE"A+15.tif"
装置优势:装置②中长颈漏斗可随时添加液体;装置③中分液漏斗可控制反应速率;装置④中多孔塑料隔板可控制反应的发生与停止。
(2)收集方法:____________________。
4.检验:__________________________________________,则该气体为二氧化碳。
5.验满:____________________________________________,则证明已集满。
注意:验满是验证已知成分的气体是否收集满;气体的检验是验证未知气体的成分,故不能用燃着的木条检验二氧化碳,因为能使燃着的木条熄灭的还有氮气等。
二、工业制取二氧化碳
高温煅烧石灰石:________________________________。
课题3 二氧化碳和一氧化碳
第1课时 二氧化碳
一、二氧化碳的性质
1.物理性质:通常状况下是一种____________的气体,密度比空气________,________溶于水。
固态二氧化碳称为________,易________。
2.化学性质
(1)一般情况下,二氧化碳不燃烧,也不________________。
(2)二氧化碳不能供给呼吸。
(3)二氧化碳能与水反应,反应的化学方程式为____________________________。
碳酸不稳定,容易分解,反应的化学方程式为______________________________。
(4)二氧化碳能与澄清石灰水反应,反应的化学方程式为______________________________
(现象:____________________),此反应用于检验二氧化碳。
(5)二氧化碳能与灼热的碳反应,反应的化学方程式为______________________________。
3.实验探究
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
操作
石蕊干花喷稀醋酸
石蕊干花喷水
石蕊干花直接放入二氧化碳中
石蕊干花喷水后放入二氧化碳中
烘干Ⅳ中的花
现象
变红
不变色
不变色
变红
变回紫色
分析
酸能使石蕊变红
______________________________
_____________________________
______________________________
碳酸分解
二、二氧化碳的用途
二氧化碳可用于________________________________________________________________________。
三、二氧化碳对环境的影响
1.二氧化碳不能供给呼吸,当空气中的二氧化碳超过正常量时,会对人体健康产生影响。因此在人群密集的地方应该注意通风换气。
2.引起温室效应
(1)温室气体有CO2、____________、____________、氟氯代烷(商品名为氟利昂)等。
(2)防止温室效应的措施:__________________________________。
第2课时 一氧化碳
一、一氧化碳
1.物理性质:通常状况下是一种______色______味的气体,密度比空气________,________溶于水。
2.化学性质
(1)可燃性
一氧化碳燃烧的化学方程式为________________________。
现象:燃烧产生蓝色火焰,放热,生成________________________气体。
(2)还原性
INCLUDEPICTURE"001.tif"
一氧化碳还原氧化铜的化学方程式为________________________________________________。
现象:____________________________________________。
注意:①先通气体再加热,目的是________________________。
②实验结束,先熄灭酒精灯A,继续通一氧化碳至冷却,目的是________________________________。
③一定要有尾气处理装置。
(3)毒性
一氧化碳极易与血液中的血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧中毒。
3.用途:(1)______________;(2)______________。
二、二氧化碳与一氧化碳
1.CO2和CO化学性质的比较:
CO2
CO
CO2不可燃
CO可燃
CO2无毒
CO有毒
能使澄清石灰水变浑浊
不能使澄清石灰水变浑浊
无还原性
有还原性
两者化学性质不同的原因:______________________________________________。
2.两种气体鉴别的方法:(1)___________________________________
________________________;
(2)______________________________________________________(写出两种即可)。
3.除去气体中的杂质:
(1)除去CO2中的CO:
_________________________________________________________(不能用点燃);
除去CO中的CO2:
___________________________________________________________;
除去CO2中的O2:
____________________________________________________________。
参考答案
第六单元 碳和碳的氧化物
课题1 金刚石、石墨和C60
第1课时 碳单质的物理性质
一、1.无色透明;正八面体;大;装饰品;钻头
2.深灰;细鳞片;小;导电性;滑腻感;铅笔芯;电极;润滑剂
3.碳原子排列方式不同;单质;混合物;化学
二、1.吸附
2.吸附
第2课时 碳单质的化学性质
一、1.不活泼
2.(1)C+O2CO2
(2)2C+O22CO
3.(1)黑色固体变为红色,澄清石灰水变浑浊
①集中火焰,提高加热温度
②将导管撤出;熄灭酒精灯;液体倒流,试管炸裂
(2)3C+2Fe2O34Fe+3CO2↑
(3)C+CO22CO
二、还原;氧化;还原
课题2 二氧化碳制取的研究
一、1.石灰石(或大理石)、稀盐酸
2.CaCO3+2HCl===CaCl2+H2O+CO2↑
(1)浓盐酸易挥发,使制得的二氧化碳不纯
(2)碳酸钠与稀盐酸反应速率太快,不利于收集
(3)稀硫酸与碳酸钙反应生成微溶的硫酸钙覆盖在石灰石(或大理石)表面,阻碍反应进一步进行
3.(1)固—液 (2)向上排空气法
4.将气体通入澄清石灰水中,若澄清石灰水变浑浊
5.将燃着的木条放在集气瓶口,若木条熄灭
二、CaCO3CaO+CO2↑
课题3 二氧化碳和一氧化碳
第1课时 二氧化碳
一、1.无色、无味;大;能;干冰;升华
2.(1)支持燃烧
(3)CO2+H2O===H2CO3;H2CO3===H2O+CO2↑
(4)CO2+Ca(OH)2===CaCO3↓+H2O;澄清石灰水变浑浊
(5)C+CO22CO
3.
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
操作
石蕊干花喷稀醋酸
石蕊干花喷水
石蕊干花直接放入二氧化碳中
石蕊干花喷水后放入二氧化碳中
烘干Ⅳ中的花
现象
变红
不变色
不变色
变红
变回紫色
分析
酸能使石蕊变红
水不能使石蕊变红
二氧化碳不能使石蕊变红
二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变成红色
碳酸分解
二、生产汽水等碳酸饮料、灭火、光合作用、人工降雨、化工原料等
三、2.(1)臭氧(O3);甲烷(CH4)
(2)减少化石燃料的使用、植树造林等
第2课时 一氧化碳
一、1.无;无;略小;难
2.(1)2CO+O22CO2;能使澄清石灰水变浑浊的
(2)CO+CuOCu+CO2;黑色固体变为红色,澄清石灰水变浑浊
①排尽空气,防止爆炸
②防止空气进入,铜再次被氧化
3.(1)作燃料
(2)冶炼金属
二、1.分子构成不同
2.(1)取样,伸入燃着的小木条,使木条熄灭的是CO2
(2)取样,加入适量的澄清石灰水,使澄清石灰水变浑浊的是CO2
3.(1)通过灼热的氧化铜
(2)通入氢氧化钠溶液(或通入澄清石灰水或通过灼热的碳)
(3)通过灼热的铜网
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
