第三节 海水“制碱“第2课时 盐的化学性质及复分解反应的实质(21张PPT)
文档属性
| 名称 | 第三节 海水“制碱“第2课时 盐的化学性质及复分解反应的实质(21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-07 09:38:36 | ||
图片预览





文档简介
第2课时 盐的化学性质及复分解反应的实质
鲁教版·九年级化学下册
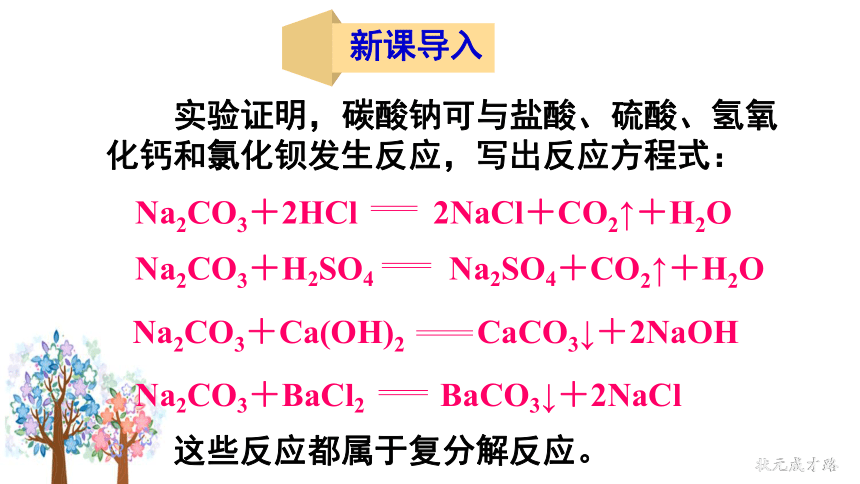
新课导入
实验证明,碳酸钠可与盐酸、硫酸、氢氧化钙和氯化钡发生反应,写出反应方程式:
Na2CO3+2HCl 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+BaCl2 BaCO3↓+2NaCl
这些反应都属于复分解反应。
探索新知
复分解反应
一、
复分解反应:两种化合物互相交换成分,生成两种新的化合物的反应。
酸、碱、盐之间发生的反应一般都属于复分解反应。
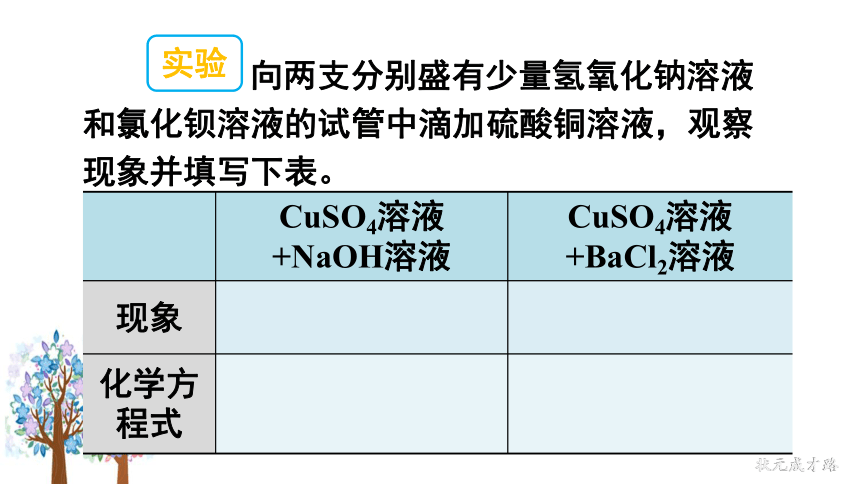
向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
实验
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
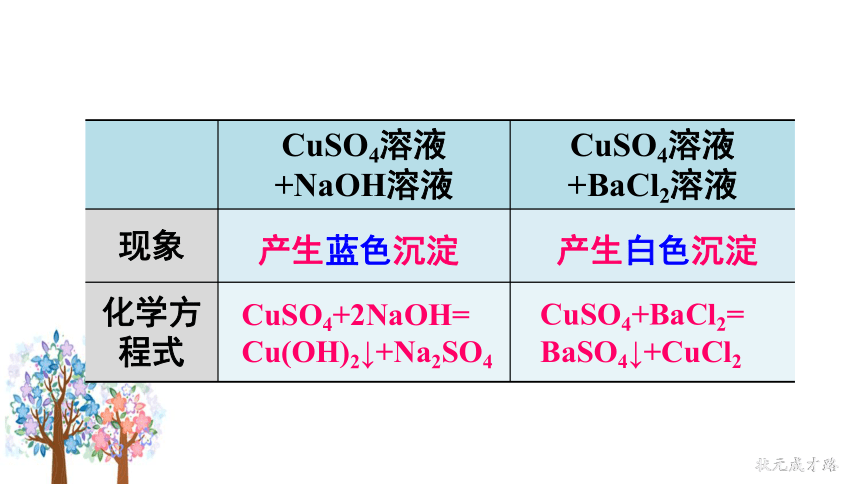
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=
Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=
BaSO4↓+CuCl2
酸碱盐之间是否一定能发生复分解反应呢?
并不是任何酸、碱、盐和金属氧化物之间都能发生复分解反应,只有当两种化合物相互交换成分,且有沉淀、气体或水生成时,复分解反应才能发生。
复分解反应发生的条件
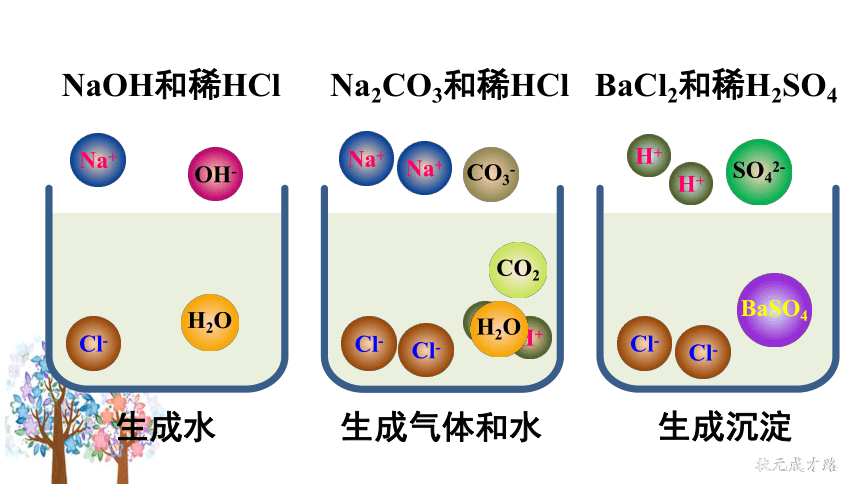
从微观角度看Na2CO3与HCl的反应:
NaOH和稀HCl
Cl-
H+
Na+
OH-
H2O
Cl-
H+
Na+
CO3-
Cl-
H+
Ba2+
SO42-
BaSO4
Na2CO3和稀HCl
Na+
CO2
BaCl2和稀H2SO4
Cl-
H+
生成水
生成气体和水
生成沉淀
Cl-
H+
H2O
总
结
因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
盐和碱的溶解性:
难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3
易溶记三碱:NaOH、KOH、Ba(OH)2
微溶记三物:Ca(OH)2、CaSO4、Ag2SO4
都溶记四类:钾、钠、铵盐、硝酸盐
下列各组物质,能共同存在于水溶液中的是( )
A. H2SO4 Na2CO3 KOH
B. MgCl2 CuSO4 NaNO3
C. AgNO3 BaCl2 K2SO4
D. HCl K2CO3 NaNO3
B
练习
盐的化学性质
一、
1. 盐 + 金属→盐 + 金属
如:Fe + CuSO4=Cu + FeSO4
Cu + 2AgNO3=2Ag + Cu(NO3)2
(前置后,盐溶液)
(湿法冶金)
2. 盐 + 酸→盐 + 酸
如:CaCO3 + 2HCl =CaCl2 + H2O + CO2↑(√)
HCl + AgNO3 = AgCl↓ + HNO3(√)
H2CO3 + CaCl2 = CaCO3↓ + 2HCl(×)
Na2SO4 + 2HCl = 2NaCl + H2SO4(×)
3. 盐 + 碱→盐 + 碱
如: CuSO4 + 2NaOH = Na2SO4 +Cu(OH)2↓(√)
Na2CO3 +Ca(OH)2= 2NaOH + CaCO3↓(√)
NaOH + KCl = NaCl + KOH(×)
条件:①满足复分解条件,即有沉淀或气体或水生成;②反应物均必须可溶。
如:AgNO3+NaCl==AgCl↓+NaNO3(√)
BaCl2 + Na2SO4=BaSO4↓+ 2NaCl(√)
BaCO3 + Na2SO4=BaSO4↓+ Na2CO3(×)
4. 盐 + 盐→盐 + 盐
条件:①满足复分解条件,②反应物均必须可溶。
随堂演练
1. 下列反应中不属于复分解反应的是( )
A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
B. H2SO4 + BaCl2 = BaSO4↓ + 2HC1
C. 2HC1 + Fe = FeCl2 + H2 ↑
D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2O
C
2. 下列各组物质中,加水充分溶解后过滤,滤纸上肯定有两种不溶物的是( )
A. Ca(NO3)2 CaCl2 Na2CO3
B. CuSO4 Cu(NO3)2 Ba(OH)2
C. NaOH KCl Ba(NO3)2
D. FeCl3 KOH BaCl2
B
3. 下列各组中的物质的溶液混合后没有反应现象发生的是( )
A. CuSO4 Na2CO3 稀硫酸
B. NaOH Ba(NO3)2 稀盐酸
C. MgSO4 NaCl Ca(OH)2
D. BaCl2 KNO3 AgNO3
B
4. 小明对某无色溶液所含溶质的记录合理的是( )
A. HCl、NaOH、Na2SO3
B. KNO3、ZnCl2、FeCl2
C. AgNO3、H2SO4、NaCl
D. NaOH、Na2CO3、NaCl
D
课堂小结
酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
1. 盐 + 金属→盐 + 金属
2. 盐 + 酸→盐 + 酸
3. 盐 + 碱→盐 + 碱
4. 盐 + 盐→盐 + 盐
盐的化学性质
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
鲁教版·九年级化学下册
新课导入
实验证明,碳酸钠可与盐酸、硫酸、氢氧化钙和氯化钡发生反应,写出反应方程式:
Na2CO3+2HCl 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+BaCl2 BaCO3↓+2NaCl
这些反应都属于复分解反应。
探索新知
复分解反应
一、
复分解反应:两种化合物互相交换成分,生成两种新的化合物的反应。
酸、碱、盐之间发生的反应一般都属于复分解反应。
向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
实验
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=
Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=
BaSO4↓+CuCl2
酸碱盐之间是否一定能发生复分解反应呢?
并不是任何酸、碱、盐和金属氧化物之间都能发生复分解反应,只有当两种化合物相互交换成分,且有沉淀、气体或水生成时,复分解反应才能发生。
复分解反应发生的条件
从微观角度看Na2CO3与HCl的反应:
NaOH和稀HCl
Cl-
H+
Na+
OH-
H2O
Cl-
H+
Na+
CO3-
Cl-
H+
Ba2+
SO42-
BaSO4
Na2CO3和稀HCl
Na+
CO2
BaCl2和稀H2SO4
Cl-
H+
生成水
生成气体和水
生成沉淀
Cl-
H+
H2O
总
结
因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
盐和碱的溶解性:
难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3
易溶记三碱:NaOH、KOH、Ba(OH)2
微溶记三物:Ca(OH)2、CaSO4、Ag2SO4
都溶记四类:钾、钠、铵盐、硝酸盐
下列各组物质,能共同存在于水溶液中的是( )
A. H2SO4 Na2CO3 KOH
B. MgCl2 CuSO4 NaNO3
C. AgNO3 BaCl2 K2SO4
D. HCl K2CO3 NaNO3
B
练习
盐的化学性质
一、
1. 盐 + 金属→盐 + 金属
如:Fe + CuSO4=Cu + FeSO4
Cu + 2AgNO3=2Ag + Cu(NO3)2
(前置后,盐溶液)
(湿法冶金)
2. 盐 + 酸→盐 + 酸
如:CaCO3 + 2HCl =CaCl2 + H2O + CO2↑(√)
HCl + AgNO3 = AgCl↓ + HNO3(√)
H2CO3 + CaCl2 = CaCO3↓ + 2HCl(×)
Na2SO4 + 2HCl = 2NaCl + H2SO4(×)
3. 盐 + 碱→盐 + 碱
如: CuSO4 + 2NaOH = Na2SO4 +Cu(OH)2↓(√)
Na2CO3 +Ca(OH)2= 2NaOH + CaCO3↓(√)
NaOH + KCl = NaCl + KOH(×)
条件:①满足复分解条件,即有沉淀或气体或水生成;②反应物均必须可溶。
如:AgNO3+NaCl==AgCl↓+NaNO3(√)
BaCl2 + Na2SO4=BaSO4↓+ 2NaCl(√)
BaCO3 + Na2SO4=BaSO4↓+ Na2CO3(×)
4. 盐 + 盐→盐 + 盐
条件:①满足复分解条件,②反应物均必须可溶。
随堂演练
1. 下列反应中不属于复分解反应的是( )
A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
B. H2SO4 + BaCl2 = BaSO4↓ + 2HC1
C. 2HC1 + Fe = FeCl2 + H2 ↑
D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2O
C
2. 下列各组物质中,加水充分溶解后过滤,滤纸上肯定有两种不溶物的是( )
A. Ca(NO3)2 CaCl2 Na2CO3
B. CuSO4 Cu(NO3)2 Ba(OH)2
C. NaOH KCl Ba(NO3)2
D. FeCl3 KOH BaCl2
B
3. 下列各组中的物质的溶液混合后没有反应现象发生的是( )
A. CuSO4 Na2CO3 稀硫酸
B. NaOH Ba(NO3)2 稀盐酸
C. MgSO4 NaCl Ca(OH)2
D. BaCl2 KNO3 AgNO3
B
4. 小明对某无色溶液所含溶质的记录合理的是( )
A. HCl、NaOH、Na2SO3
B. KNO3、ZnCl2、FeCl2
C. AgNO3、H2SO4、NaCl
D. NaOH、Na2CO3、NaCl
D
课堂小结
酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
1. 盐 + 金属→盐 + 金属
2. 盐 + 酸→盐 + 酸
3. 盐 + 碱→盐 + 碱
4. 盐 + 盐→盐 + 盐
盐的化学性质
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
同课章节目录
