第八单元 海水中的化学单元复习训练(29张幻灯片)
文档属性
| 名称 | 第八单元 海水中的化学单元复习训练(29张幻灯片) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-07 10:12:18 | ||
图片预览


文档简介
单元复习训练
九年级化学下册
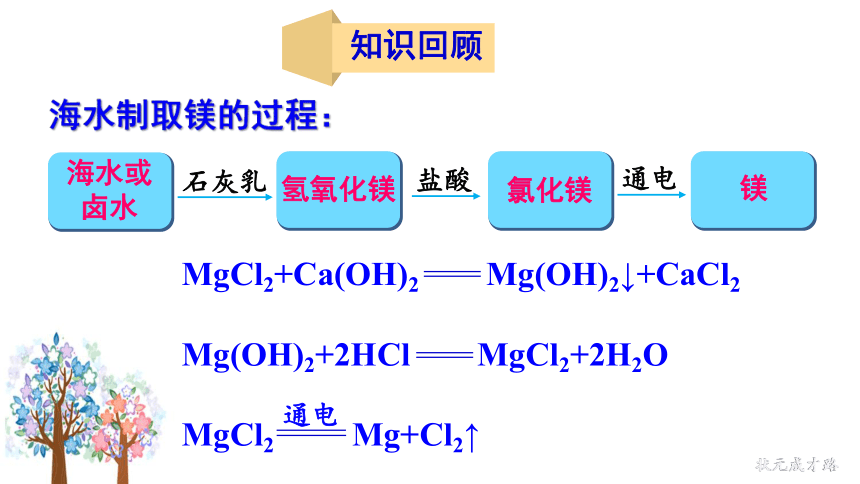
知识回顾
海水制取镁的过程:
海水或卤水
氢氧化镁
氯化镁
镁
石灰乳
盐酸
通电
MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl MgCl2+2H2O
MgCl2 Mg+Cl2↑
通电
海水淡化
蒸馏法
结晶法
膜法
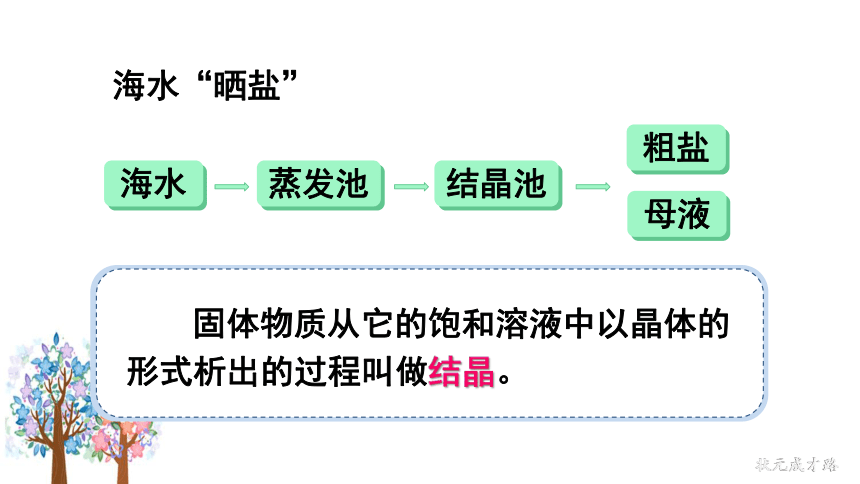
海水
蒸发池
结晶池
粗盐
母液
固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
海水“晒盐”
盐水
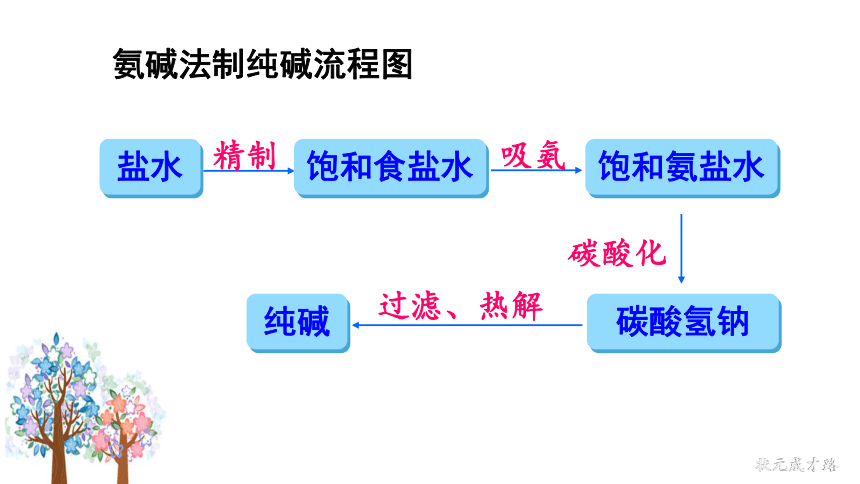
氨碱法制纯碱流程图
精制
饱和食盐水
饱和氨盐水
碳酸化
碳酸氢钠
吸氨
过滤、热解
纯碱
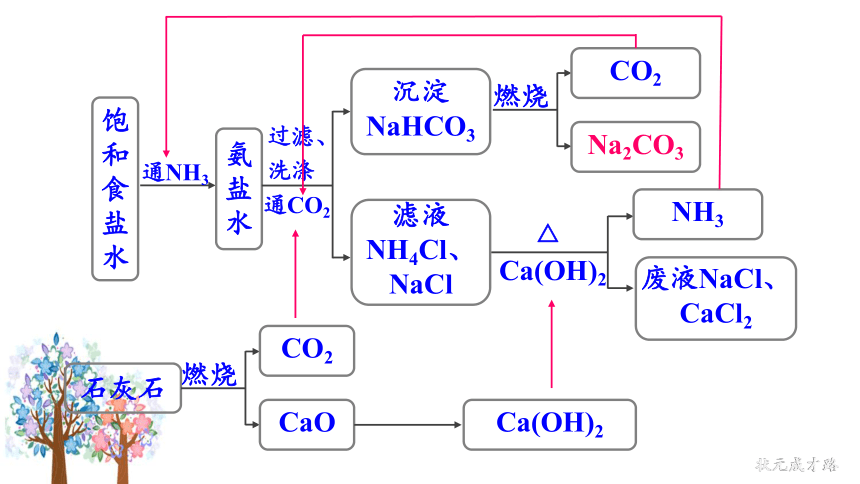
饱和食盐水
通NH3
氨盐水
燃烧
CO2
Na2CO3
Ca(OH)2
△
NH3
废液NaCl、CaCl2
石灰石
燃烧
CO2
CaO
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl、NaCl
Ca(OH)2
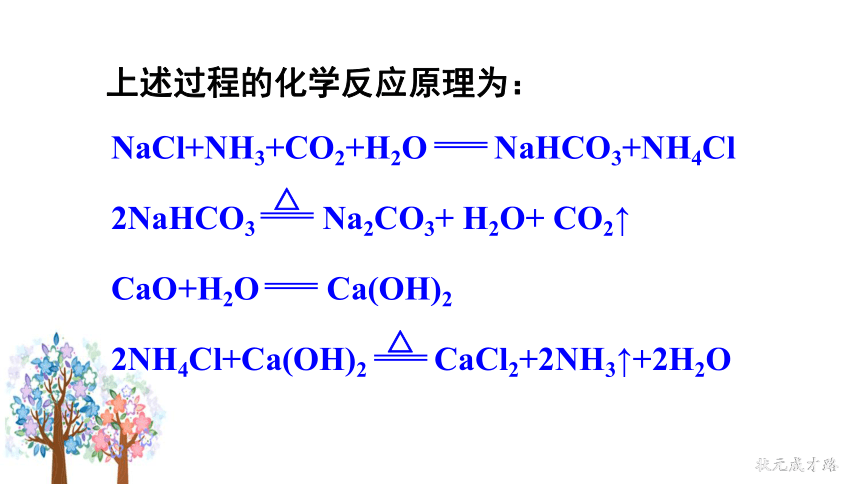
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
CaO+H2O Ca(OH)2
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
上述过程的化学反应原理为:
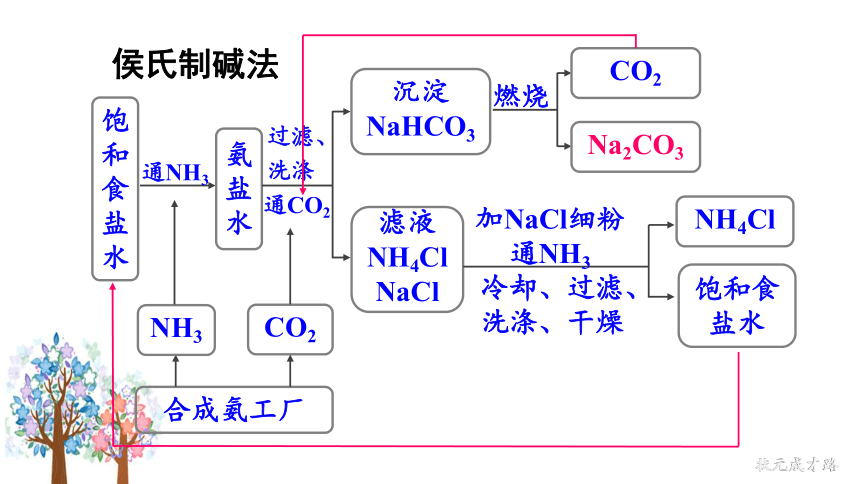
饱和食盐水
通NH3
氨盐水
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl
NaCl
燃烧
CO2
Na2CO3
合成氨工厂
NH3
CO2
NH4Cl
饱和食盐水
加NaCl细粉
通NH3
冷却、过滤、洗涤、干燥
侯氏制碱法
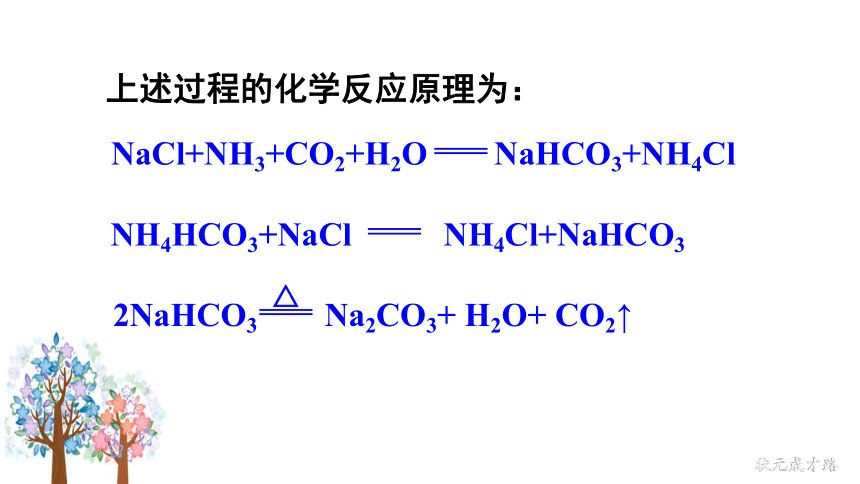
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
上述过程的化学反应原理为:
NH4HCO3+NaCl NH4Cl+NaHCO3
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易熔
显弱碱性
受热不易分解
受热易分解
溶解度
固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。
1
2
3
4
一定温度下;
100g溶剂里;
溶液为饱和状态;
溶质的质量。
描述溶解度时要注意以下几点:
温度对固体溶解度的影响
根据溶解度曲线可分为“三种类型”:
(1)“陡升型”——大多数固体物质的溶解度随温度升高而显著增大,如KNO3;
(2)“缓升型”——少数固体物质溶解度受温度的影响变化不大,如NaCl;
(3)“缓降型”——极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。
0
t /℃
40
80
120
160
200
g/100 g水
S
70
20
40
60
80
100
90
硝酸钾的溶解度曲线
A
B
A和B对应的溶液状态是什么?
1.曲线上任一点:表示某物质在某温度时的溶解度;溶液所处的状态是饱和溶液;
2.曲线上方的点:表示某温度下某物质的溶液中溶质有剩余;溶液所处的状态是饱和溶液 ;
3.曲线下方的点:表示某温度下某物质溶液中溶质的量不足;溶液所处的状态是不饱和溶液。
0
20
80
31.6
169
溶解度
/g
温度/℃
80 ℃时,100 g水中最多溶解169 g硝酸钾
由80 ℃冷却到20 ℃
20 ℃时,100 g水中只能溶解31.6 g硝酸钾,析出硝酸钾晶体的质量为:169 g-31.6 g=137.4 g
降温结晶
粗盐中难溶性杂质的去除
1. 溶解:用玻璃棒轻轻搅拌,加速溶解
2. 过滤:一贴、二低、三靠
3. 蒸发:用玻璃棒不断搅拌,当析出较多固体时停止加热,用余热使滤液蒸干
粗
盐
提
纯
粗盐中可溶性杂质的去除
溶解
过滤
蒸发结晶
Na2SO4+BaCl2 2NaCl+BaSO4↓
MgCl2+2NaOH 2NaCl+Mg(OH)2↓
CaCl2+Na2CO3 2NaCl+CaCO3↓
BaCl2+Na2CO3 2NaCl+BaCO3↓
Na2CO3 +2HCl 2NaCl+H2O+CO2↑
Na2CO3+2HCl 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+BaCl2 BaCO3↓+2NaCl
这些反应都属于复分解反应。
因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
盐和碱的溶解性:
难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3
易溶记三碱:NaOH、KOH、Ba(OH)2
微溶记三物:Ca(OH)2、CaSO4、Ag2SO4
都溶记四类:钾、钠、铵盐、硝酸盐
1. 盐 + 金属→盐 + 金属
2. 盐 + 酸→盐 + 酸
3. 盐 + 碱→盐 + 碱
4. 盐 + 盐→盐 + 盐
盐的化学性质
随堂演练
1.从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题。
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________________________。
CaO+H2O====Ca(OH)2
②过滤操作需用到的玻璃仪器除烧杯外,还_________
________________________________________________。
(2)制备氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作,盐酸不宜过量。
①反应的化学方程式是________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8 g Mg(OH)2需要36.5%HCl溶液________g。
漏斗、玻璃棒
2HCl+Mg(OH)2==MgCl2+2H2O
20
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,
___________________________________,直到Mg(OH)2完全溶解为止。
(3)制备氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶。
用胶头滴管逐滴加入稀盐酸溶液
2. 如图为硝酸钾的溶解度曲线,下列说法中,正确的是( )
A. 硝酸钾的溶解度受温度影响不大
B. 100 g水最多能溶解30 g硝酸钾
C. 降温能使接近饱和的硝酸钾溶液变成饱和溶液
D. 20 ℃时硝酸钾的溶解度比40 ℃时硝酸钾的溶解度大
C
3. 在无色溶液中,下列离子组能大量共存的是( )
A. Ca2+ Na+ CO32- Cl-
B. Na+ K+ OH- Cl-
C. Cu2+ K+ Cl- NO3-
D. H+ Na+ OH- SO42-
B
4. 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
A.水
B. 纯碱
C. 澄清石灰水
D. 稀盐酸
加入X的量
PH
7
B
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
九年级化学下册
知识回顾
海水制取镁的过程:
海水或卤水
氢氧化镁
氯化镁
镁
石灰乳
盐酸
通电
MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl MgCl2+2H2O
MgCl2 Mg+Cl2↑
通电
海水淡化
蒸馏法
结晶法
膜法
海水
蒸发池
结晶池
粗盐
母液
固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
海水“晒盐”
盐水
氨碱法制纯碱流程图
精制
饱和食盐水
饱和氨盐水
碳酸化
碳酸氢钠
吸氨
过滤、热解
纯碱
饱和食盐水
通NH3
氨盐水
燃烧
CO2
Na2CO3
Ca(OH)2
△
NH3
废液NaCl、CaCl2
石灰石
燃烧
CO2
CaO
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl、NaCl
Ca(OH)2
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
CaO+H2O Ca(OH)2
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
上述过程的化学反应原理为:
饱和食盐水
通NH3
氨盐水
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl
NaCl
燃烧
CO2
Na2CO3
合成氨工厂
NH3
CO2
NH4Cl
饱和食盐水
加NaCl细粉
通NH3
冷却、过滤、洗涤、干燥
侯氏制碱法
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
上述过程的化学反应原理为:
NH4HCO3+NaCl NH4Cl+NaHCO3
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易熔
显弱碱性
受热不易分解
受热易分解
溶解度
固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。
1
2
3
4
一定温度下;
100g溶剂里;
溶液为饱和状态;
溶质的质量。
描述溶解度时要注意以下几点:
温度对固体溶解度的影响
根据溶解度曲线可分为“三种类型”:
(1)“陡升型”——大多数固体物质的溶解度随温度升高而显著增大,如KNO3;
(2)“缓升型”——少数固体物质溶解度受温度的影响变化不大,如NaCl;
(3)“缓降型”——极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。
0
t /℃
40
80
120
160
200
g/100 g水
S
70
20
40
60
80
100
90
硝酸钾的溶解度曲线
A
B
A和B对应的溶液状态是什么?
1.曲线上任一点:表示某物质在某温度时的溶解度;溶液所处的状态是饱和溶液;
2.曲线上方的点:表示某温度下某物质的溶液中溶质有剩余;溶液所处的状态是饱和溶液 ;
3.曲线下方的点:表示某温度下某物质溶液中溶质的量不足;溶液所处的状态是不饱和溶液。
0
20
80
31.6
169
溶解度
/g
温度/℃
80 ℃时,100 g水中最多溶解169 g硝酸钾
由80 ℃冷却到20 ℃
20 ℃时,100 g水中只能溶解31.6 g硝酸钾,析出硝酸钾晶体的质量为:169 g-31.6 g=137.4 g
降温结晶
粗盐中难溶性杂质的去除
1. 溶解:用玻璃棒轻轻搅拌,加速溶解
2. 过滤:一贴、二低、三靠
3. 蒸发:用玻璃棒不断搅拌,当析出较多固体时停止加热,用余热使滤液蒸干
粗
盐
提
纯
粗盐中可溶性杂质的去除
溶解
过滤
蒸发结晶
Na2SO4+BaCl2 2NaCl+BaSO4↓
MgCl2+2NaOH 2NaCl+Mg(OH)2↓
CaCl2+Na2CO3 2NaCl+CaCO3↓
BaCl2+Na2CO3 2NaCl+BaCO3↓
Na2CO3 +2HCl 2NaCl+H2O+CO2↑
Na2CO3+2HCl 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+BaCl2 BaCO3↓+2NaCl
这些反应都属于复分解反应。
因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
盐和碱的溶解性:
难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3
易溶记三碱:NaOH、KOH、Ba(OH)2
微溶记三物:Ca(OH)2、CaSO4、Ag2SO4
都溶记四类:钾、钠、铵盐、硝酸盐
1. 盐 + 金属→盐 + 金属
2. 盐 + 酸→盐 + 酸
3. 盐 + 碱→盐 + 碱
4. 盐 + 盐→盐 + 盐
盐的化学性质
随堂演练
1.从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题。
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________________________。
CaO+H2O====Ca(OH)2
②过滤操作需用到的玻璃仪器除烧杯外,还_________
________________________________________________。
(2)制备氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作,盐酸不宜过量。
①反应的化学方程式是________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8 g Mg(OH)2需要36.5%HCl溶液________g。
漏斗、玻璃棒
2HCl+Mg(OH)2==MgCl2+2H2O
20
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,
___________________________________,直到Mg(OH)2完全溶解为止。
(3)制备氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶。
用胶头滴管逐滴加入稀盐酸溶液
2. 如图为硝酸钾的溶解度曲线,下列说法中,正确的是( )
A. 硝酸钾的溶解度受温度影响不大
B. 100 g水最多能溶解30 g硝酸钾
C. 降温能使接近饱和的硝酸钾溶液变成饱和溶液
D. 20 ℃时硝酸钾的溶解度比40 ℃时硝酸钾的溶解度大
C
3. 在无色溶液中,下列离子组能大量共存的是( )
A. Ca2+ Na+ CO32- Cl-
B. Na+ K+ OH- Cl-
C. Cu2+ K+ Cl- NO3-
D. H+ Na+ OH- SO42-
B
4. 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
A.水
B. 纯碱
C. 澄清石灰水
D. 稀盐酸
加入X的量
PH
7
B
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
