第三节 海水“制碱“第1课时 氨碱法制纯碱 纯碱的性质(36张PPT)
文档属性
| 名称 | 第三节 海水“制碱“第1课时 氨碱法制纯碱 纯碱的性质(36张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-07 09:58:54 | ||
图片预览








文档简介
第1课时 氨碱法制纯碱 纯碱的性质
第三节 海水制碱
九年级化学下册
新课导入
纯碱或苏打(主要成分为碳酸钠)是以食盐、石灰石为原料,以氨为媒介,采用氨碱法制得的。
探索新知
氨碱法制纯碱
一、
由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?用NaCl制Na2CO3,还需要什么原料?
想一想
制取物质时要遵循的几条原则
原料来源是否丰富、易得?价格是否低廉?
工艺流程及设备是否简单?
生产过程是否安全?
是否会造成环境污染?
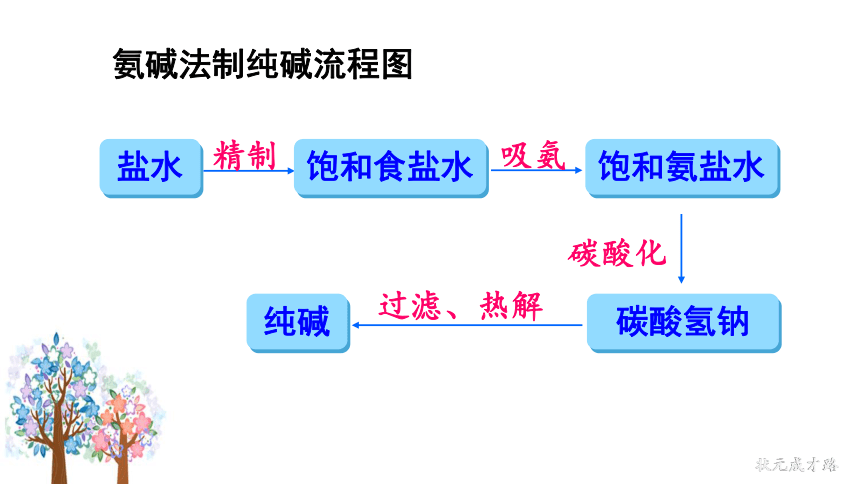
工业上采用氨碱法生产纯碱,是先向饱和食盐水中通入氨气,制成饱和氨盐水,在加压并不断通入二氧化碳的条件下使碳酸氢钠(NaHCO3)结晶析出,过滤后,将碳酸氢钠加热分解即得纯碱。
盐水
氨碱法制纯碱流程图
精制
饱和食盐水
饱和氨盐水
碳酸化
碳酸氢钠
吸氨
过滤、热解
纯碱
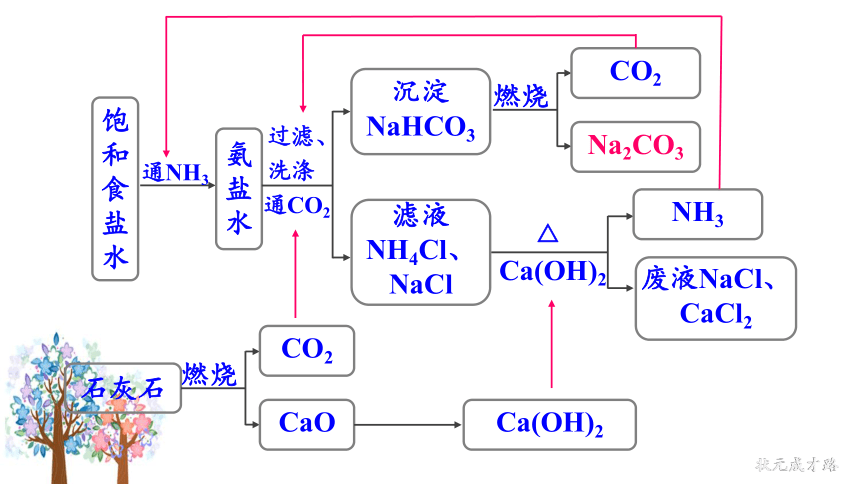
饱和食盐水
通NH3
氨盐水
燃烧
CO2
Na2CO3
Ca(OH)2
△
NH3
废液NaCl、CaCl2
石灰石
燃烧
CO2
CaO
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl、NaCl
Ca(OH)2
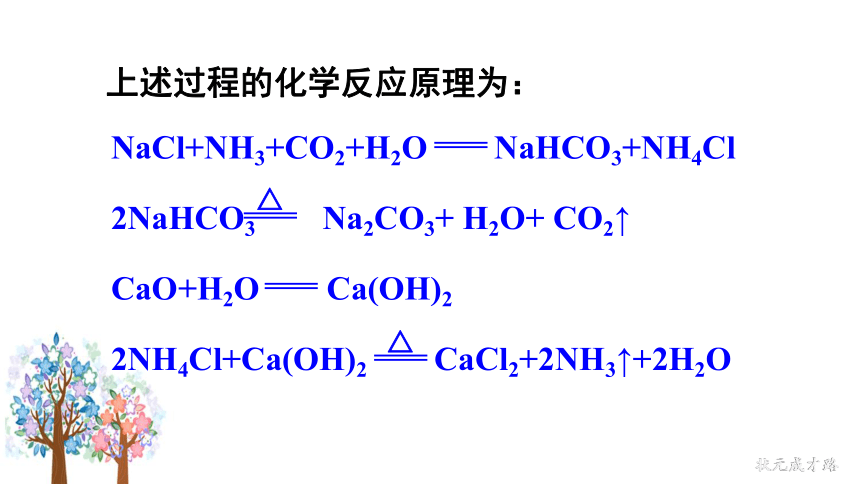
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
CaO+H2O Ca(OH)2
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
上述过程的化学反应原理为:
1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
交
流
氨溶于水后生成氨水显碱性,促进CO2的吸收。
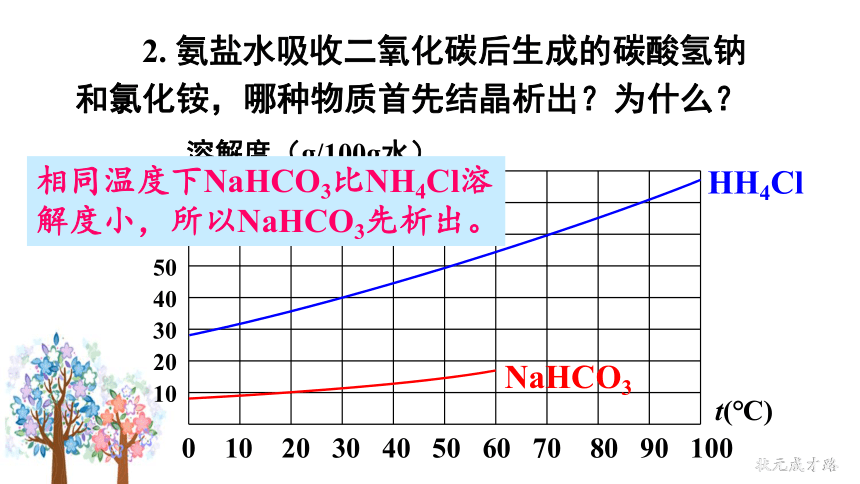
2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
0 10 20 30 40 50 60 70 80 90 100
t(℃)
80
70
60
50
40
30
20
10
溶解度(g/100g水)
相同温度下NaHCO3比NH4Cl溶解度小,所以NaHCO3先析出。
NaHCO3
HH4Cl
分析氨碱法的优点和不足之处
优点:
原料经济易得
CO2和NH3可回收利用
能连续生产
缺点:
回收氨时产生的大量CaCl2用处不大,且污染环境
1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法)。
侯德榜(1890-1974)
向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥, NaCl溶液则可循环使用。
饱和食盐水
通NH3
氨盐水
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl
NaCl
燃烧
CO2
Na2CO3
合成氨工厂
NH3
CO2
NH4Cl
饱和食盐水
加NaCl细粉
通NH3
冷却、过滤、洗涤、干燥
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
上述过程的化学反应原理为:
NH4HCO3+NaCl NH4Cl+NaHCO3
侯氏制碱法保留了氨碱法的优点,克服了其缺点,打破了当时西方国家对制碱技术的垄断,促进了世界制碱技术的发展。
纯碱在通常情况下为______粉末,____溶于水,水溶液显____性。
白色
易
碱
纯碱在工业生产中用途极广,如石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产等均需大量的纯碱。纯碱还广泛应用于冶金、造纸、纺织印染和洗涤剂生产等领域。
纯碱
玻璃生产
造纸
纺织印染
洗涤
粗盐精制
纯碱的应用
石油精炼
碳酸氢钠
碳酸氢钠俗称________,又称酸式碳酸钠,通常是______粉末状晶体,____溶于水,受热____分解。
小苏打
白色
能
易
在灭火器里,它是二氧化碳发生剂;在食品工业上,它是发酵粉的主要成分;在制造饮料时,它是一种常用原料;在医疗上,它是治疗胃酸过多的药剂之一 。
食品
碳酸氢钠的应用
灭火器
碳酸饮料
胃药
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
纯碱的性质
二、
实
验
探
究
实验 1
与酸碱指示剂作用
取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,观察其溶解情况。再滴入2~3滴酚酞试液,观察现象。
现象:_____________________
结论:碳酸钠______溶于水,溶液显______性。
溶液变红色
易
碱
实验 2
与酸反应
取少量碳酸钠固体,加入试管中,然后滴加稀盐酸,观察现象。迅速将燃着的木条伸进试管口,观察现象 。
现象:_____________________
有气泡生成
化学方程式:__________________________
Na2CO3+2HCl 2NaCl+CO2↑+H2O
思考:
若用稀硫酸代替稀盐酸进行实验,现象是否相同?
现象:_____________________
有气泡生成
化学方程式:__________________________
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
实验 3
与氢氧化钙反应
向盛有少量碳酸钠溶液的试管中滴加澄清石灰水,观察现象。
现象:_____________________
化学方程式:__________________________
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
有白色沉淀生成
实验 4
与氯化钡反应
向盛有少量碳酸钠溶液的试管中滴加氯化钡溶液,观察现象。
现象:_____________________
化学方程式:__________________________
有白色沉淀生成
Na2CO3+BaCl2 BaCO3↓+2NaCl
随堂演练
1.“侯氏制碱法”的生产过程涉及的主要化学反应如下:
NaCl+NH3+CO2+X NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
NH4HCO3+NaCl NH4Cl+NaHCO3
①
②
③
请回答:
(1)反应①中X的化学式为________。
(2)NH4Cl中N元素的化合价为________。
(3)除去混在Na2CO3粉末中少量的NaHCO3
的方法是______________________________。
H2O
-3
加热Na2CO3和NaHCO3的混合物
2.工业上采用氨碱法生产纯碱的工艺是先向饱和食盐水中通入较多NH3(溶液显碱性),再通入足量的CO2的原因是( )
A.使CO2更易被吸收
B.NH3比CO2更易制取
C.CO2的密度比NH3大
D.为了增大NaHCO3的溶解度
A
3.下列说法正确的是( )
A.制纯碱需要的原料有食盐和石灰石
B.海水晒得的粗盐可以直接吸氨制成氨盐水
C.向氨盐水中通入CO2可得到纯碱,溶液经结晶后得到纯碱固体
D.因为氯化钠水溶液呈中性,所以氨盐水也呈中性
A
4.图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
△△牌发酵粉
【主要成分】NaHCO3、酒石酸
【用途】面粉发酵,焙制糕点
【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热
图 1
图 2
【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO3受热不分解。
【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?
【假设猜想】甲:……
乙:酒石酸与NaHCO3在溶液中反应产生 CO2。
丙:NaHCO3加热产生CO2。
【实验探究】
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是________________________________。
小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是______________________。
(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,
NaHCO3和水反应产生二氧化碳
NaHCO3能与酸反应
加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为___________________________________________。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是______。
【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为__________________________________。
Ca(OH)2+CO2=CaCO3↓+H2O
Na2CO3
加热
2NaHCO3 = Na2CO3+H2O+CO2↑
△
课堂小结
氨碱法制纯碱
改进
侯氏制碱法
碳酸钠能与大多数酸及某些碱、盐发生反应。
纯碱和小苏打在生产和生活中都具有重要的用途。
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
第三节 海水制碱
九年级化学下册
新课导入
纯碱或苏打(主要成分为碳酸钠)是以食盐、石灰石为原料,以氨为媒介,采用氨碱法制得的。
探索新知
氨碱法制纯碱
一、
由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?用NaCl制Na2CO3,还需要什么原料?
想一想
制取物质时要遵循的几条原则
原料来源是否丰富、易得?价格是否低廉?
工艺流程及设备是否简单?
生产过程是否安全?
是否会造成环境污染?
工业上采用氨碱法生产纯碱,是先向饱和食盐水中通入氨气,制成饱和氨盐水,在加压并不断通入二氧化碳的条件下使碳酸氢钠(NaHCO3)结晶析出,过滤后,将碳酸氢钠加热分解即得纯碱。
盐水
氨碱法制纯碱流程图
精制
饱和食盐水
饱和氨盐水
碳酸化
碳酸氢钠
吸氨
过滤、热解
纯碱
饱和食盐水
通NH3
氨盐水
燃烧
CO2
Na2CO3
Ca(OH)2
△
NH3
废液NaCl、CaCl2
石灰石
燃烧
CO2
CaO
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl、NaCl
Ca(OH)2
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
CaO+H2O Ca(OH)2
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
上述过程的化学反应原理为:
1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
交
流
氨溶于水后生成氨水显碱性,促进CO2的吸收。
2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
0 10 20 30 40 50 60 70 80 90 100
t(℃)
80
70
60
50
40
30
20
10
溶解度(g/100g水)
相同温度下NaHCO3比NH4Cl溶解度小,所以NaHCO3先析出。
NaHCO3
HH4Cl
分析氨碱法的优点和不足之处
优点:
原料经济易得
CO2和NH3可回收利用
能连续生产
缺点:
回收氨时产生的大量CaCl2用处不大,且污染环境
1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法)。
侯德榜(1890-1974)
向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥, NaCl溶液则可循环使用。
饱和食盐水
通NH3
氨盐水
过滤、洗涤
通CO2
沉淀NaHCO3
滤液NH4Cl
NaCl
燃烧
CO2
Na2CO3
合成氨工厂
NH3
CO2
NH4Cl
饱和食盐水
加NaCl细粉
通NH3
冷却、过滤、洗涤、干燥
NaCl+NH3+CO2+H2O NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
上述过程的化学反应原理为:
NH4HCO3+NaCl NH4Cl+NaHCO3
侯氏制碱法保留了氨碱法的优点,克服了其缺点,打破了当时西方国家对制碱技术的垄断,促进了世界制碱技术的发展。
纯碱在通常情况下为______粉末,____溶于水,水溶液显____性。
白色
易
碱
纯碱在工业生产中用途极广,如石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产等均需大量的纯碱。纯碱还广泛应用于冶金、造纸、纺织印染和洗涤剂生产等领域。
纯碱
玻璃生产
造纸
纺织印染
洗涤
粗盐精制
纯碱的应用
石油精炼
碳酸氢钠
碳酸氢钠俗称________,又称酸式碳酸钠,通常是______粉末状晶体,____溶于水,受热____分解。
小苏打
白色
能
易
在灭火器里,它是二氧化碳发生剂;在食品工业上,它是发酵粉的主要成分;在制造饮料时,它是一种常用原料;在医疗上,它是治疗胃酸过多的药剂之一 。
食品
碳酸氢钠的应用
灭火器
碳酸饮料
胃药
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
纯碱的性质
二、
实
验
探
究
实验 1
与酸碱指示剂作用
取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,观察其溶解情况。再滴入2~3滴酚酞试液,观察现象。
现象:_____________________
结论:碳酸钠______溶于水,溶液显______性。
溶液变红色
易
碱
实验 2
与酸反应
取少量碳酸钠固体,加入试管中,然后滴加稀盐酸,观察现象。迅速将燃着的木条伸进试管口,观察现象 。
现象:_____________________
有气泡生成
化学方程式:__________________________
Na2CO3+2HCl 2NaCl+CO2↑+H2O
思考:
若用稀硫酸代替稀盐酸进行实验,现象是否相同?
现象:_____________________
有气泡生成
化学方程式:__________________________
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
实验 3
与氢氧化钙反应
向盛有少量碳酸钠溶液的试管中滴加澄清石灰水,观察现象。
现象:_____________________
化学方程式:__________________________
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
有白色沉淀生成
实验 4
与氯化钡反应
向盛有少量碳酸钠溶液的试管中滴加氯化钡溶液,观察现象。
现象:_____________________
化学方程式:__________________________
有白色沉淀生成
Na2CO3+BaCl2 BaCO3↓+2NaCl
随堂演练
1.“侯氏制碱法”的生产过程涉及的主要化学反应如下:
NaCl+NH3+CO2+X NaHCO3+NH4Cl
2NaHCO3 Na2CO3+ H2O+ CO2↑
△
NH4HCO3+NaCl NH4Cl+NaHCO3
①
②
③
请回答:
(1)反应①中X的化学式为________。
(2)NH4Cl中N元素的化合价为________。
(3)除去混在Na2CO3粉末中少量的NaHCO3
的方法是______________________________。
H2O
-3
加热Na2CO3和NaHCO3的混合物
2.工业上采用氨碱法生产纯碱的工艺是先向饱和食盐水中通入较多NH3(溶液显碱性),再通入足量的CO2的原因是( )
A.使CO2更易被吸收
B.NH3比CO2更易制取
C.CO2的密度比NH3大
D.为了增大NaHCO3的溶解度
A
3.下列说法正确的是( )
A.制纯碱需要的原料有食盐和石灰石
B.海水晒得的粗盐可以直接吸氨制成氨盐水
C.向氨盐水中通入CO2可得到纯碱,溶液经结晶后得到纯碱固体
D.因为氯化钠水溶液呈中性,所以氨盐水也呈中性
A
4.图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
△△牌发酵粉
【主要成分】NaHCO3、酒石酸
【用途】面粉发酵,焙制糕点
【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热
图 1
图 2
【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO3受热不分解。
【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?
【假设猜想】甲:……
乙:酒石酸与NaHCO3在溶液中反应产生 CO2。
丙:NaHCO3加热产生CO2。
【实验探究】
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是________________________________。
小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是______________________。
(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,
NaHCO3和水反应产生二氧化碳
NaHCO3能与酸反应
加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为___________________________________________。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是______。
【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为__________________________________。
Ca(OH)2+CO2=CaCO3↓+H2O
Na2CO3
加热
2NaHCO3 = Na2CO3+H2O+CO2↑
△
课堂小结
氨碱法制纯碱
改进
侯氏制碱法
碳酸钠能与大多数酸及某些碱、盐发生反应。
纯碱和小苏打在生产和生活中都具有重要的用途。
1.从教材习题中选取,
2.完成练习册本课时的习题.
课后作业
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
