福建南平市2019—2020学年第二学期高一年级期末质量检测化学试题 pdf版
文档属性
| 名称 | 福建南平市2019—2020学年第二学期高一年级期末质量检测化学试题 pdf版 |  | |
| 格式 | |||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-08 15:29:55 | ||
图片预览




文档简介
南平市 2019-2020 学年第二学期高一期末质量检测
化 学 试 题
(考试时间:90分钟 满分:100分)
注意事项:
1.答卷前,考生务必在试题卷、答题卡规定的地方填写自己的准考证号、姓名、班级和座
号。考生要认真核对答题卡上粘贴条形码的“准考证号、姓名”。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 K-39 Mn-55
第 I卷 选择题
本卷共 16 小题,每小题 3 分,共 48 分。在每小题给出的四个选项中,只有一个
选项符合题目要求。
1.“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
1A.大量生产一次性超薄塑料袋方便日常生活
1B.对所有垃圾以直接露天焚烧的方式进行处理
1C.加大农药和化肥的生产和使用量,以提高粮食的产量
1D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
2.下列关于 说法正确的是( )
1A.中子数为60 B.质量数为87
1C.核电荷数为27 D.核外电子数为33
3.下列表示正确的是( )
1A.N2的结构式:N≡N 1 B.甲烷分子的球棍模型是:
1C.乙烯的结构简式:CH2CH2 D.NaCl的电子式:
4.下列物质属于同分异构体的是( )
1A. 和 B.O2与O3
1C.正丁烷与异丁烷 D.乙烷与丙烷
5.不断进步的材料逐渐构筑了现代文明社会,下列说法不正确的是( )
1A.“唐三彩”和景德镇陶瓷均属于无机非金属材料
1B.以高纯硅制成的光导纤维内窥镜可以用于医疗
1C.钛制人造关节可以和人骨密切结合,钛被人们称为“亲生物金属”
1D.用于制作N95口罩的“熔喷布”主要原料是聚丙烯,聚丙烯属于有机高分子材料
高一化学试题 第1页(共6页)
6. 下列变化过程需破坏离子键的是( )
11A.干冰升华 B.电解水 C.食盐熔化 D.氯化氢溶于水
7. 对于化学反应:CaCO3+2HCl CaCl2+CO2↑+H2O,下列措施(其他条件一定)不
能增大反应速率的是( )
A.增大HCl溶液的浓度 B.粉碎CaCO3固体
C.升高反应体系的温度 D.减小反应体系的压强
8. 下列现象因发生取代反应而产生的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.将苯加入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.乙烯使酸性高锰酸钾溶液褪色
9. 同一短周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性:HZO4>H2YO4>H3XO4,
则下列判断正确的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:XH3>H2Y>HZ
- 2- 3-
C.非金属性:X>Y>Z D.阴离子的还原性:Z>Y >X
10.某小组设计的化学电池使LED灯发光的装置如图所示,
下列叙述正确的是( )
A.锌片为正极,铜片为负极
B.锌片质量减轻,发生还原反应
C.电子由铜片通过稀硫酸流向锌片
D.装置中存在“化学能→电能→光能”的转换
11.反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,
下列说法不正确的是( )
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.2molS(g)、6molO(g) 生成2molSO3(g),共放出ykJ能量
12.苹果酸分子的结构简式为 ,下列说法正确的是( )
A.苹果酸属于烃
B.苹果酸能发生取代反应
C.苹果酸分子式为C4H8O5
D.1mol苹果酸可与3molNaOH发生反应
13.短周期元素X、Y、Z在周期表中的位置关系如图所示,
则下列叙述正确的是( )
A.X一定是活泼的非金属元素
B.Y元素的最高正价为+7价
C.Z单质比Y单质更易与氢气化合
D.Z的最高价氧化物化学式为ZO3
高一化学试题 第2页(共6页)
14.下列物质转化在给定条件下能实现的是( )
①. Cu CuO Cu(NO3)2
②. Si SiO2 H2SiO3
③. Al2O3 Na[Al(OH)4] AlCl3
④. Fe FeCl2 FeCl3
A.①③ B.②③ C.②④ D.①④
15.下列实验操作能达到预期目的是( )
A.配制500mL0.1mol·L-1的硫酸溶液 B. 处理氨气
C. 利用排空气法收集氯气 D. 分离乙醇和水
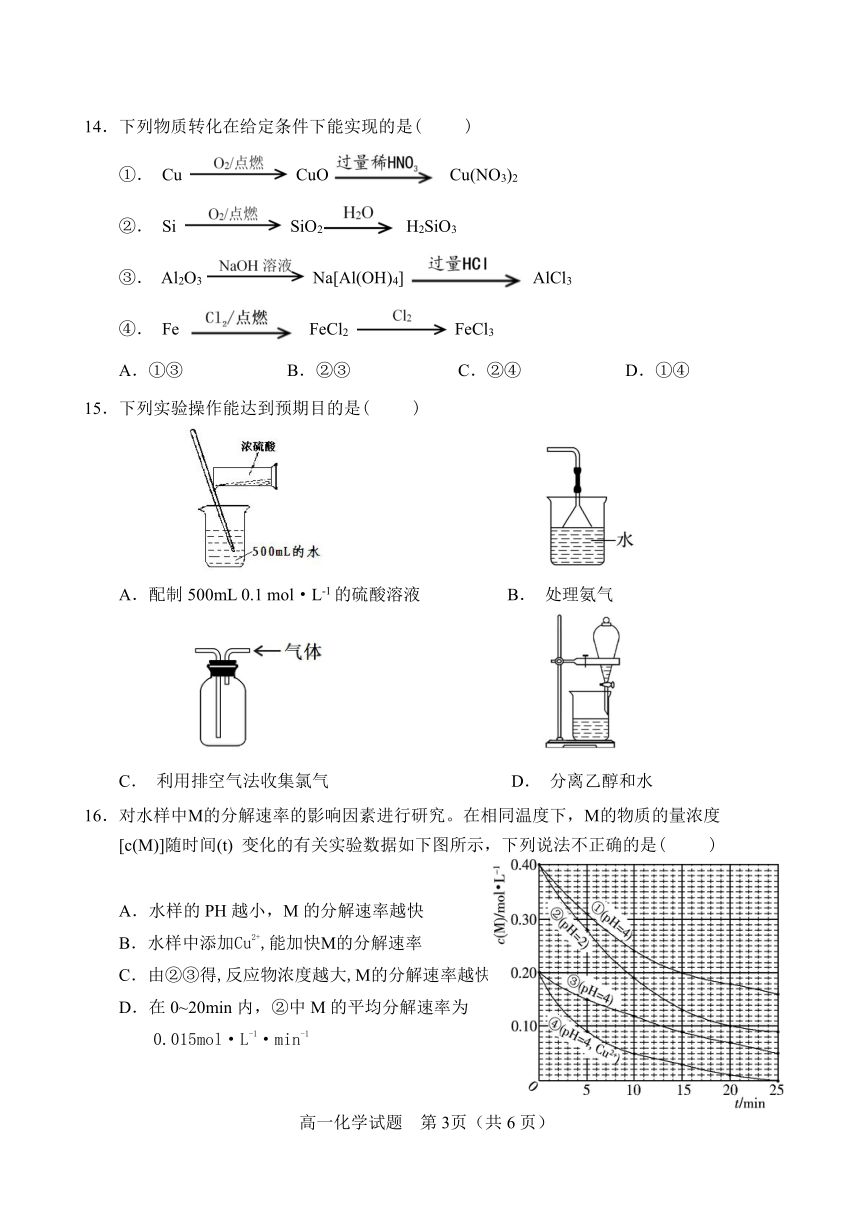
16.对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度
[c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不.正.确.的是( )
1 A.水样的PH越小,M的分解速率越快
2+
1 B.水样中添加Cu ,能加快M的分解速率
1 C.由②③得,反应物浓度越大,M的分解速率越快
1 D.在0~20min内,②中M的平均分解速率为
-1 -1
1 0.015mol·L ·min
高一化学试题 第3页(共6页)
第 II卷 非选择题 (52分)
17.(10分)下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)②的原子结构示意图是 。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)③和④原子中,原子半径较大的是 (填元素符号)。
(4)常用作半导体材料的是 (填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是 (填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是 (填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是 (填化学式)。
(8)结构简式为 的有机物分子式是 ,其中碳元素与氢元素的质量比
1m(C)∶m(H)= 。
18.(10分)一定温度下,在容积为2L的密闭容器内, 某一反应中气体M和气体N的物质的量
随反应时间变化的曲线如图所示, 请根据图示回答下列问题。
(1)写出该反应的化学方程式: 。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率
1 为 (用含t1、t3的式子表示)。
(3)比较a点与b点反应速率大小,Va Vb
1 (填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中, (填t1、t2、
1 或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是 。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成1 mol M
D.容器内压强不随时间变化
高一化学试题 第4页(共6页)
19.(10分)工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶
炼铝的原料,其工艺流程如下图所示:
请回答下列问题。
1 (1)操作1、2、3的名称均为 。
111(2)滤液1中所含的阴离子除OH-外,还有 、 (填离子符号),
1 滤渣2 的成份为 (填化学式)。
1 (3)滤液2中加入过量氨水生成固体1的离子反应方程式为 。
111(4)滤液3中溶质的主要成份属于盐类的物质是 、 (填化学式)。
1 (5)固体1灼烧发生反应的化学方程式为 。
20.(10分)
1(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,
将其标号填在横线上。
①蚕丝的主要成分是 。
②我国“西气东输”的气体主要成分是 。
③酒驾是指驾驶员呼出的气体中 含量超标。
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是 。
1 (2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
①E物质的名称为 ,A B的化学方程式为 。
②实验室利用A和C制取D,反应的化学方程式为 ,收集装置可选用
下图 装置(填标号)。
高一化学试题 第5页(共6页)
21.(12分)氯化铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,
用还原铜粉和氯气来制备氯化铜。
已知:氯化铜容易潮解。
1 (1)配平A装置中发生化学反应的方程式:
KMnO4+ HCl(浓) KCl+ MnCl2+ Cl2↑+ H2O
装浓盐酸的仪器名称是 。
1 (2)B装置的作用是 ,C装置中的试剂是 ,
E装置的作用是 。
1 (3)F中发生的化学反应的离子方程式为 。
1 (4)当Cl2排尽空气后,加热D,装置D中的现象是 。
1 (5)某同学用不纯的铜粉(含少量铁粉)进行实验。铜粉和铁粉完全反应后,取少量产
物于一洁净的试管中,加水溶解,再加入 (填试剂),出现
1(填现象),则证明产物中含有 FeCl3。
1 (6)用15.8g KMnO4固体与足量的浓盐酸反应,被氧化的HCl是 mol。
1
高一化学试题 第6页(共6页)
南平市 2019-2020 学年第二学期高一年级期末质量检测
化学试题参考答案及评分说明
评分说明:
1.只要考生的答案合理,就可参照评分说明给分。
2.化学方程式中,化学式错误不给分,没配平、没注明反应条件或没有气体符号(或没沉
淀符号)扣1分;化学专用名词写错别字或元素符号出现错误不给分。
3.试题中未明确要求写化学式或名称的,正确写出其一即可得分。
第 I 卷(共 16 小题,每小题 3 分,共 48 分)
咨询专家组长:钟晓英(浦城二中)18805992117
咨询专家老师:蔡映霞(南平一中)13559841594
题
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
号
答
D C A C B C D A A D C B D A B C
案
第Ⅱ卷(合 52 分)
17.(10分)咨询专家组长:钟晓英(浦城二中)18805992117
(1) (1分) (2)Ar (1分) (3)O (1分)
(4)硅(1分) (5)HClO4 (1分) (6)Na (1分)
(7)Al(OH)3(1分) (8)C6H6 (1分) 12:1 (2分)
18.(10分)咨询专家老师:蔡映霞(南平一中)13559841594
(1)2N M(2分) (未写可逆符号扣1分)
— —
(2)1/(t3-t1) mol 1 1
· L ·min (2分) (答案合理即可;单位写错或漏写扣1分)
(3)> (2分)
(4)t3 (2分)
(5)BD (2分) (错选不给分,漏选给1分)
19.(10分)咨询专家老师:雷建榕(建阳一中)18350920878
(1)过滤 (1分)
—
(2)SiO32- 、 [Al(OH)4] - (或AlO2 ); H2SiO3(每空各1分)
高一化学参考答案 第1页(共2页)
(3)3NH3 3+
·H2O + Al Al(OH)3↓+3NH4+(2分)
(4)NH4Cl NaCl (每空1分)
(5) 2Al(OH)3 Al2O3+3H2O(2分)
20.(10分)咨询专家老师:夏顺生(浦城一中)13850989450
(1)①D ②A ③C ④B (每空1分)
Cu
(2)① 聚乙烯(1分) 2C2H5OH+O2 2CH3CHO+2H2O (2分)
②CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O(2分)
(未写可逆符号扣1分)
乙(1分)
21.(12分)咨询专家老师:夏顺生(浦城一中)13850989450
(1) 2 KMnO4+ 16 HCl(浓) 2 KCl+ 2 MnCl2+ 5 Cl2↑+ 8 H2O
(1分)
分液漏斗 (1分)
(2)除去氯气中混有的氯化氢气体 (1分) 浓硫酸 (1分)
防止氯化铜潮解 (1分)
- -
(3)Cl2 + 2OH Cl- + ClO + H2O(2分)
(4)产生棕黄色的烟 (1分)
(5)KSCN溶液 (1分) 血红色 (1分)
(该小题其它合理答案也可以给分)
(6)5.6 (2分)
高一化学参考答案 第2页(共2页)
2020 年南平市高一年级下期末质量检查测试
化学学科考试命题说明
撰写:高一化学命题组
本次试题编制以《普通高中课程标准(化学)》为指导,践行“一核、四层、四翼”考试
评价体系,命题以立德树人为价值取向,以服务期末考试为评价标准,兼顾“诊断教学”的
目标,突出学科育人,彰显核心价值。考点设置基本覆盖课程标准对必修一第四章、必修二
模块要求的化学核心知识。本次考试注重对基础核心知识及其迁移应用的考查,旨在引导高
一教学回归学科本源,注重夯实双基,试题难度不大。具体各题分析如下:
第Ⅰ卷 选择题
1.“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
1A.大量生产一次性超薄塑料袋方便日常生活
1B.对所有垃圾以直接露天焚烧的方式进行处理
1C.加大农药和化肥的生产和使用量,以提高粮食的产量
1D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
【命题立意】“环境保护和可持续发展”是当今世界的重要主题。绿色化学在21世纪中负有
重要使命,这就是在把化学这门基础学科推向更高层次的同时,也要为解决人类社会面面临
的粮食、能源和环境污染问题作出重要贡献。因此把大力开展以生物质为导向的绿色化学研
究作为国家目标无疑是明智之举,在教学中渗透并落实绿色化学理念无疑是重中之措。
2.下列关于 说法正确的是( )
1A.中子数为60 B.质量数为87
C.核电荷数为27 D.核外电子数为33
【命题立意】让学生进行原子结构中质子、中子、核电荷数、同位素表达等的计算与分析,
知道元素、核素的含义,以掌握物质结构中的基本内容,形成进行微观分析的学科方法。
3.下列表示正确的是( )
A.N2的结构式:N≡N 1 B.甲烷分子的球棍模型是:
1C.乙烯的结构简式:CH2CH2 D.NaCl的电子式:
【命题立意】本题以考查化学用语中结构式、球棍模型、有机结构简式、电子式的表达方式,
让学生掌握化学用语,认识到化学用语在学习化学中的重要性。
4.下列物质属于同分异构体的是( )
1A. 和 B.O2与O3
1C.正丁烷与异丁烷 D.乙烷与丙烷
【命题立意】本题以考查化学用语中同分异构体、同位素和同素异形体的区别,让学生掌握
这三个重要概念,认识到概念在学习化学中的重要性。
5.不断进步的材料逐渐构筑了现代文明社会,下列说法不正确的是( )
1A.“唐三彩”和景德镇陶瓷均属于无机非金属材料
B.以高纯硅制成的光导纤维内窥镜可以用于医疗
1C.钛制人造关节可以和人骨密切结合,钛被人们称为“亲生物金属”
1D.用于制作N95口罩的“熔喷布”主要原料是聚丙烯,聚丙烯属于有机高分子材料
【命题立意】高中必修一教材要求学生了解无机非金属材料、金属材料、有机高分子材料三
大类单一材料和简单的复合材料。本题命题意在考查学生对生活中常见物质其组成材料分类
的认识。
6. 下列变化过程需破坏离子键的是( )
11A.干冰升华 B.电解水 C.食盐熔化 D.氯化氢溶于水
【命题立意】本题以物质在不同状态条件下为背景信息主要考查学生对化学键的认识。
7. 对于化学反应:CaCO3+2HCl CaCl2+CO2↑+H2O,下列措施(其他条件一定)不
能增大反应速率的是( )
A.增大HCl溶液的浓度 B.粉碎CaCO3固体
C.升高反应体系的温度 D.减小反应体系的压强
【命题立意】本题以CaCO3+2HCl CaCl2+CO2↑+H2O,为信息,考查了浓度、温度、
压强,反应物的接触面积对反应速率的影响。
8. 下列现象因发生取代反应而产生的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.将苯加入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.乙烯使酸性高锰酸钾溶液褪色
【命题立意】本题以四个重要有机小实验为内容,检验基础知识储备,考查学生分析问题、
解决问题的能力。
9.同一短周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性:HZO4>H2YO4>H3XO4,
则下列判断正确的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:XH3>H2Y>HZ
- 2- 3-
C.非金属性:X>Y>Z D.阴离子的还原性:Z>Y >X
【命题立意】本题结合有关数据和实验事实,检测学生利用原子结构解释元素性质及其递变
规律知识,考查学生对元素周期表(律)、原子半径、非金属性、离子还原性、气态氢化物的
热稳定性等知识的理解与运用。
10.某小组设计的化学电池使LED灯发光的装置如图所示,
下列叙述正确的是( )
A.锌片为正极,铜片为负极
B.锌片质量减轻,发生还原反应
C.电子由铜片通过稀硫酸流向锌片
D.装置中存在“化学能→电能→光能”的转换
【命题立意】本题以原电池的原理为素材,考查对氧化还原反应与电池关系的全面分析:电
极的判断、电极反应与氧化还原反应的关系、电子流动的方向分析、能量的转化,具有一定
的综合性。
11.反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,
下列说法不正确的是( )
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.2molS(g)、6molO(g) 生成2molSO3(g),共放出ykJ能量
【命题立意】本题以坐标曲线为素材,考查学生对反应与能量的关系理解,重在检测学生对
坐标数据的分析与判断,帮助学生理解物质在化学变化过程中的能量变化。
12.苹果酸分子的结构简式为 ,下列说法正确的是( )
A.苹果酸属于烃
B.苹果酸能发生取代反应
C.苹果酸分子式为C4H8O5
D.1mol苹果酸可与3molNaOH发生反应
【命题立意】本题以有机化合物“苹果酸”的结构分析,考查基础有机化学的“有机物的基
本分类”、“反应类型分析”、“分子式书写”、“反应的可行性与实验现象分析”等的能力。
13.短周期元素X、Y、Z在周期表中的位置关系如图所示,
则下列叙述正确的是( )
A.X一定是活泼的非金属元素
B.Y元素的最高正价为+7价
C.Z单质比Y单质更易与氢气化合
D.Z的最高价氧化物化学式为ZO3
【命题立意】本题考查学生能否利用元素在元素周期表中的位置和原子结构,分析、预测、
比较元素及其化合物的性质。考查学生对已学知识融会贯通及分析、推理解决问题的能力。
14.下列物质转化在给定条件下能实现的是( )
①. Cu CuO Cu(NO3)2
②. Si SiO2 H2SiO3
③. Al2O3 Na[Al(OH)4] AlCl3
④. Fe FeCl2 FeCl3
A.①③ B.②③ C.②④ D.①④
【命题立意】要求学生掌握元素化合物性质以及之间的转化关系,熟记相关化学反应,并能
够应用与解决实际问题。
15.下列实验操作能达到预期目的是( )
A.配制500mL0.1mol·L-1的硫酸溶液 B. 处理氨气
C. 利用排空气法收集氯气 D. 分离乙醇和水
【命题立意】本题以基础实验装置图的分析为内容,考查“一定浓度溶液的配置”、“氨气的
尾气处理”、“密度比空气大的气体的收集装置”、“两种相溶液体的分离”,培养学生的实验
分析能力、实验观察能力、实验设计能力等。
16.对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度
[c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不.正.确.的是( )
1 A.水样的PH越小,M的分解速率越快
2+
1 B.水样中添加Cu ,能加快M的分解速率
1 C.由②③得,反应物浓度越大,M的分解速率越快
1 D.在0~20min内,②中M的平均分解速率为
-1 -1
1 0.015mol·L ·min
【命题立意】本题以相同温度下.对水样中M 的分解速率的影响因素进行研究,考查学生
用控制变量法研究影响因素,同时考查学生分析图表,从图表中获取有效信息的能力。
第 II 卷 非选择题
17.(10分)下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)②的原子结构示意图是 。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)③和④原子中,原子半径较大的是 (填元素符号)。
(4)常用作半导体材料的是 (填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是 (填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是 (填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是 (填化学式)。
(8)结构简式为 的有机物分子式是 ,其中碳元素与氢元素的质量比
1m(C)∶m(H)= 。
【命题意图】
本题考查的是必修2的第一章内容。主要考查元素周期表的结构、元素的位置、元素性
质三者之间关系。考查了原子结构示意图、元素的金属性、非金属性,原子半径大小判断,
最高价氧化物对应的水化物的酸性、两性氢氧化物、简单有机物分子式、简单计算等知识。
本题模仿会考试题结构,按《高中化学课程标准》中学业水平考试2的要求考查学生用正确
的化学用语表达分析解决问题的过程和结果,考查学生分析具体问题能力,获取应用信息的
能力。
[参考答案]
(1) (2)Ar (3)O (4)硅
(5)HClO4 (6)Na (7)Al(OH)3 (8)C6H6 12:1
18.(10分)一定温度下,在容积为2L的密闭容器内, 某一反
应中气体M和气体N的物质的量随反应时间变化的曲线如图
所示, 请根据图示回答下列问题。
(1)写出该反应的化学方程式: 。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率
1 为 。(用含t1、t3的式子表示)
(3)比较a点与b点反应速率大小,Va Vb
1 (填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中, (填t1、t2、
1 或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是 。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成1 mol M
D.容器内压强不随时间变化
【命题意图】
本题考查的知识点涉及必修2第二章内容。主要考查学生对基础原理中可逆反应的认识,
学会计算简单的化学反应的速率,学会从图中判断两点反应速率的大小以及如何判断一个可
逆反应到达平衡状态等课本必备的基础知识。考点的呈现注重关键能力的考查,关注知识的
应用性,体现在要求学生具备通过从图中获取有效信息并进行加工处理的能力,同时问题的
设置符合课程标准对这一模块的要求。
[参考答案]
— —
(1)2N M (2)1/(t3-t1) mol 1 1
·L · min
(3)> (4)t3 (5)BD
19.(10分)工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶
炼铝的原料,其工艺流程如下图所示:
请回答下列问题。
1 (1)操作1、2、3的名称均为 。
111(2)滤液1中所含的阴离子除OH-外,还有 、 (填离子符号),
1 滤渣2 的成份为 (填化学式)。
1 (3)滤液2中加入过量氨水生成固体1的离子反应方程式为 。
111(4)滤液3中溶质的主要成份属于盐类的物质是 、 (填化学式)。
1 (5)固体1灼烧发生反应的化学方程式为 。
【命题意图】
本题测试学生对铝土矿提取氧化铝工艺过程的分析,意在考察学生对氧化铝、氢氧化铝、
四羟基合铝酸盐、铝盐等性质的综合应用能力,以及能够正确运用化学用语来分析问题解决
问题。在该工艺过程中还涉及物质分离的方法考察,学生能够分析固液不互溶的分离方法。
[参考答案]
(1)过滤
—
(2)SiO32- 、 [Al(OH)4] - (或AlO2 ); H2SiO3
(3)3NH3· H2O + Al3+ Al(OH)3↓+3NH4+
(4)NH4Cl NaCl
(5) 2Al(OH)3 Al2O3+3H2O
20.(10分)
1(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将
其标号填在横线上。
①蚕丝的主要成分是 。
②我国“西气东输”的气体主要成分是 。
③酒驾是指驾驶员呼出的气体中 含量超标
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是 。
1 (2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
①E物质的名称为 。A→B的化学方程式为
②实验室利用A和C制取D,反应的化学方程式 ,收集装置可选用
下图 装置(填标号)。
【命题立意】
第一小题以四种重要有机化合物在生产生活中的重要作用为内容,认识甲烷 、乙酸、
乙醇 、蛋白质有机化合物在生产、生活中的重要应用,考查学生分析判断能力。第二小题
以常见有机物的转化为内容,考查“重要物质的名称”、“乙烯加成反应”“实验室制备乙酸
乙酯”,考查学生对有机基础知识的掌握程度,学生分析具体问题解决问题的能力,以及对
图像的观察思维的能力。化学学科思想上考查学生是否具备转化观,守恒观。
[参考答案]
(1)①D ②A ③C ④B Cu
(2)①聚乙烯(1分) 2C2H5OH+O2 2CH3CHO+2H2O
②CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
乙
21.(12分)氯化铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,
用还原铜粉和氯气来制备氯化铜。
已知:氯化铜容易潮解。
1 (1)配平A装置中发生反应的化学方程式:
2 KMnO4+ HCl(浓) KCl+ MnCl2+ Cl2↑+ H2O
3 装浓盐酸的仪器名称是 。
1 (2)B装置的作用是 ,C装置中的试剂是 ,
E装置的作用是 。
1 (3)F中发生的化学反应的离子方程式为 。
1 (4)当Cl2排尽空气后,加热D,装置D中的现象是 。
1 (5)某同学用不纯的铜粉(含少量铁粉)进行实验。铜粉和铁粉完全反应后,取少量产
物于一洁净的试管中,加水溶解,再加入 (填试剂),出现
1(填现象),则证明产物中含有 FeCl3。
1 (6)用15.8g KMnO4固体与足量的浓盐酸反应,被氧化的HCl是 mol。
【命题意图】
本题以氯气并对其性质进行实验探究为内容,考查化学方程式的配平,氧化还原反应离
子方程式的书写,以及仪器名称和装置的作用等。考查了学生接受,吸收,整合化学信息的能
力,分析推理能力、实验计算能力,实验探究能力。
[参考答案]
(1) 2 KMnO4+ 16 HCl(浓) 2 KCl+ 2 MnCl2+ 5 Cl2↑+ 8 H2O
(2)除去氯气中混有的氯化氢气体 浓硫酸 防止氯化铜潮解
- -
(3)Cl2 + 2OH Cl- + ClO + H2O
(4)产生棕黄色的烟
(5)KSCN溶液 血红色
(6)5.6
化 学 试 题
(考试时间:90分钟 满分:100分)
注意事项:
1.答卷前,考生务必在试题卷、答题卡规定的地方填写自己的准考证号、姓名、班级和座
号。考生要认真核对答题卡上粘贴条形码的“准考证号、姓名”。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 K-39 Mn-55
第 I卷 选择题
本卷共 16 小题,每小题 3 分,共 48 分。在每小题给出的四个选项中,只有一个
选项符合题目要求。
1.“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
1A.大量生产一次性超薄塑料袋方便日常生活
1B.对所有垃圾以直接露天焚烧的方式进行处理
1C.加大农药和化肥的生产和使用量,以提高粮食的产量
1D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
2.下列关于 说法正确的是( )
1A.中子数为60 B.质量数为87
1C.核电荷数为27 D.核外电子数为33
3.下列表示正确的是( )
1A.N2的结构式:N≡N 1 B.甲烷分子的球棍模型是:
1C.乙烯的结构简式:CH2CH2 D.NaCl的电子式:
4.下列物质属于同分异构体的是( )
1A. 和 B.O2与O3
1C.正丁烷与异丁烷 D.乙烷与丙烷
5.不断进步的材料逐渐构筑了现代文明社会,下列说法不正确的是( )
1A.“唐三彩”和景德镇陶瓷均属于无机非金属材料
1B.以高纯硅制成的光导纤维内窥镜可以用于医疗
1C.钛制人造关节可以和人骨密切结合,钛被人们称为“亲生物金属”
1D.用于制作N95口罩的“熔喷布”主要原料是聚丙烯,聚丙烯属于有机高分子材料
高一化学试题 第1页(共6页)
6. 下列变化过程需破坏离子键的是( )
11A.干冰升华 B.电解水 C.食盐熔化 D.氯化氢溶于水
7. 对于化学反应:CaCO3+2HCl CaCl2+CO2↑+H2O,下列措施(其他条件一定)不
能增大反应速率的是( )
A.增大HCl溶液的浓度 B.粉碎CaCO3固体
C.升高反应体系的温度 D.减小反应体系的压强
8. 下列现象因发生取代反应而产生的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.将苯加入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.乙烯使酸性高锰酸钾溶液褪色
9. 同一短周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性:HZO4>H2YO4>H3XO4,
则下列判断正确的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:XH3>H2Y>HZ
- 2- 3-
C.非金属性:X>Y>Z D.阴离子的还原性:Z>Y >X
10.某小组设计的化学电池使LED灯发光的装置如图所示,
下列叙述正确的是( )
A.锌片为正极,铜片为负极
B.锌片质量减轻,发生还原反应
C.电子由铜片通过稀硫酸流向锌片
D.装置中存在“化学能→电能→光能”的转换
11.反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,
下列说法不正确的是( )
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.2molS(g)、6molO(g) 生成2molSO3(g),共放出ykJ能量
12.苹果酸分子的结构简式为 ,下列说法正确的是( )
A.苹果酸属于烃
B.苹果酸能发生取代反应
C.苹果酸分子式为C4H8O5
D.1mol苹果酸可与3molNaOH发生反应
13.短周期元素X、Y、Z在周期表中的位置关系如图所示,
则下列叙述正确的是( )
A.X一定是活泼的非金属元素
B.Y元素的最高正价为+7价
C.Z单质比Y单质更易与氢气化合
D.Z的最高价氧化物化学式为ZO3
高一化学试题 第2页(共6页)
14.下列物质转化在给定条件下能实现的是( )
①. Cu CuO Cu(NO3)2
②. Si SiO2 H2SiO3
③. Al2O3 Na[Al(OH)4] AlCl3
④. Fe FeCl2 FeCl3
A.①③ B.②③ C.②④ D.①④
15.下列实验操作能达到预期目的是( )
A.配制500mL0.1mol·L-1的硫酸溶液 B. 处理氨气
C. 利用排空气法收集氯气 D. 分离乙醇和水
16.对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度
[c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不.正.确.的是( )
1 A.水样的PH越小,M的分解速率越快
2+
1 B.水样中添加Cu ,能加快M的分解速率
1 C.由②③得,反应物浓度越大,M的分解速率越快
1 D.在0~20min内,②中M的平均分解速率为
-1 -1
1 0.015mol·L ·min
高一化学试题 第3页(共6页)
第 II卷 非选择题 (52分)
17.(10分)下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)②的原子结构示意图是 。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)③和④原子中,原子半径较大的是 (填元素符号)。
(4)常用作半导体材料的是 (填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是 (填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是 (填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是 (填化学式)。
(8)结构简式为 的有机物分子式是 ,其中碳元素与氢元素的质量比
1m(C)∶m(H)= 。
18.(10分)一定温度下,在容积为2L的密闭容器内, 某一反应中气体M和气体N的物质的量
随反应时间变化的曲线如图所示, 请根据图示回答下列问题。
(1)写出该反应的化学方程式: 。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率
1 为 (用含t1、t3的式子表示)。
(3)比较a点与b点反应速率大小,Va Vb
1 (填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中, (填t1、t2、
1 或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是 。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成1 mol M
D.容器内压强不随时间变化
高一化学试题 第4页(共6页)
19.(10分)工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶
炼铝的原料,其工艺流程如下图所示:
请回答下列问题。
1 (1)操作1、2、3的名称均为 。
111(2)滤液1中所含的阴离子除OH-外,还有 、 (填离子符号),
1 滤渣2 的成份为 (填化学式)。
1 (3)滤液2中加入过量氨水生成固体1的离子反应方程式为 。
111(4)滤液3中溶质的主要成份属于盐类的物质是 、 (填化学式)。
1 (5)固体1灼烧发生反应的化学方程式为 。
20.(10分)
1(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,
将其标号填在横线上。
①蚕丝的主要成分是 。
②我国“西气东输”的气体主要成分是 。
③酒驾是指驾驶员呼出的气体中 含量超标。
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是 。
1 (2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
①E物质的名称为 ,A B的化学方程式为 。
②实验室利用A和C制取D,反应的化学方程式为 ,收集装置可选用
下图 装置(填标号)。
高一化学试题 第5页(共6页)
21.(12分)氯化铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,
用还原铜粉和氯气来制备氯化铜。
已知:氯化铜容易潮解。
1 (1)配平A装置中发生化学反应的方程式:
KMnO4+ HCl(浓) KCl+ MnCl2+ Cl2↑+ H2O
装浓盐酸的仪器名称是 。
1 (2)B装置的作用是 ,C装置中的试剂是 ,
E装置的作用是 。
1 (3)F中发生的化学反应的离子方程式为 。
1 (4)当Cl2排尽空气后,加热D,装置D中的现象是 。
1 (5)某同学用不纯的铜粉(含少量铁粉)进行实验。铜粉和铁粉完全反应后,取少量产
物于一洁净的试管中,加水溶解,再加入 (填试剂),出现
1(填现象),则证明产物中含有 FeCl3。
1 (6)用15.8g KMnO4固体与足量的浓盐酸反应,被氧化的HCl是 mol。
1
高一化学试题 第6页(共6页)
南平市 2019-2020 学年第二学期高一年级期末质量检测
化学试题参考答案及评分说明
评分说明:
1.只要考生的答案合理,就可参照评分说明给分。
2.化学方程式中,化学式错误不给分,没配平、没注明反应条件或没有气体符号(或没沉
淀符号)扣1分;化学专用名词写错别字或元素符号出现错误不给分。
3.试题中未明确要求写化学式或名称的,正确写出其一即可得分。
第 I 卷(共 16 小题,每小题 3 分,共 48 分)
咨询专家组长:钟晓英(浦城二中)18805992117
咨询专家老师:蔡映霞(南平一中)13559841594
题
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
号
答
D C A C B C D A A D C B D A B C
案
第Ⅱ卷(合 52 分)
17.(10分)咨询专家组长:钟晓英(浦城二中)18805992117
(1) (1分) (2)Ar (1分) (3)O (1分)
(4)硅(1分) (5)HClO4 (1分) (6)Na (1分)
(7)Al(OH)3(1分) (8)C6H6 (1分) 12:1 (2分)
18.(10分)咨询专家老师:蔡映霞(南平一中)13559841594
(1)2N M(2分) (未写可逆符号扣1分)
— —
(2)1/(t3-t1) mol 1 1
· L ·min (2分) (答案合理即可;单位写错或漏写扣1分)
(3)> (2分)
(4)t3 (2分)
(5)BD (2分) (错选不给分,漏选给1分)
19.(10分)咨询专家老师:雷建榕(建阳一中)18350920878
(1)过滤 (1分)
—
(2)SiO32- 、 [Al(OH)4] - (或AlO2 ); H2SiO3(每空各1分)
高一化学参考答案 第1页(共2页)
(3)3NH3 3+
·H2O + Al Al(OH)3↓+3NH4+(2分)
(4)NH4Cl NaCl (每空1分)
(5) 2Al(OH)3 Al2O3+3H2O(2分)
20.(10分)咨询专家老师:夏顺生(浦城一中)13850989450
(1)①D ②A ③C ④B (每空1分)
Cu
(2)① 聚乙烯(1分) 2C2H5OH+O2 2CH3CHO+2H2O (2分)
②CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O(2分)
(未写可逆符号扣1分)
乙(1分)
21.(12分)咨询专家老师:夏顺生(浦城一中)13850989450
(1) 2 KMnO4+ 16 HCl(浓) 2 KCl+ 2 MnCl2+ 5 Cl2↑+ 8 H2O
(1分)
分液漏斗 (1分)
(2)除去氯气中混有的氯化氢气体 (1分) 浓硫酸 (1分)
防止氯化铜潮解 (1分)
- -
(3)Cl2 + 2OH Cl- + ClO + H2O(2分)
(4)产生棕黄色的烟 (1分)
(5)KSCN溶液 (1分) 血红色 (1分)
(该小题其它合理答案也可以给分)
(6)5.6 (2分)
高一化学参考答案 第2页(共2页)
2020 年南平市高一年级下期末质量检查测试
化学学科考试命题说明
撰写:高一化学命题组
本次试题编制以《普通高中课程标准(化学)》为指导,践行“一核、四层、四翼”考试
评价体系,命题以立德树人为价值取向,以服务期末考试为评价标准,兼顾“诊断教学”的
目标,突出学科育人,彰显核心价值。考点设置基本覆盖课程标准对必修一第四章、必修二
模块要求的化学核心知识。本次考试注重对基础核心知识及其迁移应用的考查,旨在引导高
一教学回归学科本源,注重夯实双基,试题难度不大。具体各题分析如下:
第Ⅰ卷 选择题
1.“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
1A.大量生产一次性超薄塑料袋方便日常生活
1B.对所有垃圾以直接露天焚烧的方式进行处理
1C.加大农药和化肥的生产和使用量,以提高粮食的产量
1D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
【命题立意】“环境保护和可持续发展”是当今世界的重要主题。绿色化学在21世纪中负有
重要使命,这就是在把化学这门基础学科推向更高层次的同时,也要为解决人类社会面面临
的粮食、能源和环境污染问题作出重要贡献。因此把大力开展以生物质为导向的绿色化学研
究作为国家目标无疑是明智之举,在教学中渗透并落实绿色化学理念无疑是重中之措。
2.下列关于 说法正确的是( )
1A.中子数为60 B.质量数为87
C.核电荷数为27 D.核外电子数为33
【命题立意】让学生进行原子结构中质子、中子、核电荷数、同位素表达等的计算与分析,
知道元素、核素的含义,以掌握物质结构中的基本内容,形成进行微观分析的学科方法。
3.下列表示正确的是( )
A.N2的结构式:N≡N 1 B.甲烷分子的球棍模型是:
1C.乙烯的结构简式:CH2CH2 D.NaCl的电子式:
【命题立意】本题以考查化学用语中结构式、球棍模型、有机结构简式、电子式的表达方式,
让学生掌握化学用语,认识到化学用语在学习化学中的重要性。
4.下列物质属于同分异构体的是( )
1A. 和 B.O2与O3
1C.正丁烷与异丁烷 D.乙烷与丙烷
【命题立意】本题以考查化学用语中同分异构体、同位素和同素异形体的区别,让学生掌握
这三个重要概念,认识到概念在学习化学中的重要性。
5.不断进步的材料逐渐构筑了现代文明社会,下列说法不正确的是( )
1A.“唐三彩”和景德镇陶瓷均属于无机非金属材料
B.以高纯硅制成的光导纤维内窥镜可以用于医疗
1C.钛制人造关节可以和人骨密切结合,钛被人们称为“亲生物金属”
1D.用于制作N95口罩的“熔喷布”主要原料是聚丙烯,聚丙烯属于有机高分子材料
【命题立意】高中必修一教材要求学生了解无机非金属材料、金属材料、有机高分子材料三
大类单一材料和简单的复合材料。本题命题意在考查学生对生活中常见物质其组成材料分类
的认识。
6. 下列变化过程需破坏离子键的是( )
11A.干冰升华 B.电解水 C.食盐熔化 D.氯化氢溶于水
【命题立意】本题以物质在不同状态条件下为背景信息主要考查学生对化学键的认识。
7. 对于化学反应:CaCO3+2HCl CaCl2+CO2↑+H2O,下列措施(其他条件一定)不
能增大反应速率的是( )
A.增大HCl溶液的浓度 B.粉碎CaCO3固体
C.升高反应体系的温度 D.减小反应体系的压强
【命题立意】本题以CaCO3+2HCl CaCl2+CO2↑+H2O,为信息,考查了浓度、温度、
压强,反应物的接触面积对反应速率的影响。
8. 下列现象因发生取代反应而产生的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.将苯加入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.乙烯使酸性高锰酸钾溶液褪色
【命题立意】本题以四个重要有机小实验为内容,检验基础知识储备,考查学生分析问题、
解决问题的能力。
9.同一短周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性:HZO4>H2YO4>H3XO4,
则下列判断正确的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:XH3>H2Y>HZ
- 2- 3-
C.非金属性:X>Y>Z D.阴离子的还原性:Z>Y >X
【命题立意】本题结合有关数据和实验事实,检测学生利用原子结构解释元素性质及其递变
规律知识,考查学生对元素周期表(律)、原子半径、非金属性、离子还原性、气态氢化物的
热稳定性等知识的理解与运用。
10.某小组设计的化学电池使LED灯发光的装置如图所示,
下列叙述正确的是( )
A.锌片为正极,铜片为负极
B.锌片质量减轻,发生还原反应
C.电子由铜片通过稀硫酸流向锌片
D.装置中存在“化学能→电能→光能”的转换
【命题立意】本题以原电池的原理为素材,考查对氧化还原反应与电池关系的全面分析:电
极的判断、电极反应与氧化还原反应的关系、电子流动的方向分析、能量的转化,具有一定
的综合性。
11.反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,
下列说法不正确的是( )
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.2molS(g)、6molO(g) 生成2molSO3(g),共放出ykJ能量
【命题立意】本题以坐标曲线为素材,考查学生对反应与能量的关系理解,重在检测学生对
坐标数据的分析与判断,帮助学生理解物质在化学变化过程中的能量变化。
12.苹果酸分子的结构简式为 ,下列说法正确的是( )
A.苹果酸属于烃
B.苹果酸能发生取代反应
C.苹果酸分子式为C4H8O5
D.1mol苹果酸可与3molNaOH发生反应
【命题立意】本题以有机化合物“苹果酸”的结构分析,考查基础有机化学的“有机物的基
本分类”、“反应类型分析”、“分子式书写”、“反应的可行性与实验现象分析”等的能力。
13.短周期元素X、Y、Z在周期表中的位置关系如图所示,
则下列叙述正确的是( )
A.X一定是活泼的非金属元素
B.Y元素的最高正价为+7价
C.Z单质比Y单质更易与氢气化合
D.Z的最高价氧化物化学式为ZO3
【命题立意】本题考查学生能否利用元素在元素周期表中的位置和原子结构,分析、预测、
比较元素及其化合物的性质。考查学生对已学知识融会贯通及分析、推理解决问题的能力。
14.下列物质转化在给定条件下能实现的是( )
①. Cu CuO Cu(NO3)2
②. Si SiO2 H2SiO3
③. Al2O3 Na[Al(OH)4] AlCl3
④. Fe FeCl2 FeCl3
A.①③ B.②③ C.②④ D.①④
【命题立意】要求学生掌握元素化合物性质以及之间的转化关系,熟记相关化学反应,并能
够应用与解决实际问题。
15.下列实验操作能达到预期目的是( )
A.配制500mL0.1mol·L-1的硫酸溶液 B. 处理氨气
C. 利用排空气法收集氯气 D. 分离乙醇和水
【命题立意】本题以基础实验装置图的分析为内容,考查“一定浓度溶液的配置”、“氨气的
尾气处理”、“密度比空气大的气体的收集装置”、“两种相溶液体的分离”,培养学生的实验
分析能力、实验观察能力、实验设计能力等。
16.对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度
[c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不.正.确.的是( )
1 A.水样的PH越小,M的分解速率越快
2+
1 B.水样中添加Cu ,能加快M的分解速率
1 C.由②③得,反应物浓度越大,M的分解速率越快
1 D.在0~20min内,②中M的平均分解速率为
-1 -1
1 0.015mol·L ·min
【命题立意】本题以相同温度下.对水样中M 的分解速率的影响因素进行研究,考查学生
用控制变量法研究影响因素,同时考查学生分析图表,从图表中获取有效信息的能力。
第 II 卷 非选择题
17.(10分)下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
周期
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)②的原子结构示意图是 。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)③和④原子中,原子半径较大的是 (填元素符号)。
(4)常用作半导体材料的是 (填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是 (填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是 (填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是 (填化学式)。
(8)结构简式为 的有机物分子式是 ,其中碳元素与氢元素的质量比
1m(C)∶m(H)= 。
【命题意图】
本题考查的是必修2的第一章内容。主要考查元素周期表的结构、元素的位置、元素性
质三者之间关系。考查了原子结构示意图、元素的金属性、非金属性,原子半径大小判断,
最高价氧化物对应的水化物的酸性、两性氢氧化物、简单有机物分子式、简单计算等知识。
本题模仿会考试题结构,按《高中化学课程标准》中学业水平考试2的要求考查学生用正确
的化学用语表达分析解决问题的过程和结果,考查学生分析具体问题能力,获取应用信息的
能力。
[参考答案]
(1) (2)Ar (3)O (4)硅
(5)HClO4 (6)Na (7)Al(OH)3 (8)C6H6 12:1
18.(10分)一定温度下,在容积为2L的密闭容器内, 某一反
应中气体M和气体N的物质的量随反应时间变化的曲线如图
所示, 请根据图示回答下列问题。
(1)写出该反应的化学方程式: 。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率
1 为 。(用含t1、t3的式子表示)
(3)比较a点与b点反应速率大小,Va Vb
1 (填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中, (填t1、t2、
1 或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是 。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成1 mol M
D.容器内压强不随时间变化
【命题意图】
本题考查的知识点涉及必修2第二章内容。主要考查学生对基础原理中可逆反应的认识,
学会计算简单的化学反应的速率,学会从图中判断两点反应速率的大小以及如何判断一个可
逆反应到达平衡状态等课本必备的基础知识。考点的呈现注重关键能力的考查,关注知识的
应用性,体现在要求学生具备通过从图中获取有效信息并进行加工处理的能力,同时问题的
设置符合课程标准对这一模块的要求。
[参考答案]
— —
(1)2N M (2)1/(t3-t1) mol 1 1
·L · min
(3)> (4)t3 (5)BD
19.(10分)工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶
炼铝的原料,其工艺流程如下图所示:
请回答下列问题。
1 (1)操作1、2、3的名称均为 。
111(2)滤液1中所含的阴离子除OH-外,还有 、 (填离子符号),
1 滤渣2 的成份为 (填化学式)。
1 (3)滤液2中加入过量氨水生成固体1的离子反应方程式为 。
111(4)滤液3中溶质的主要成份属于盐类的物质是 、 (填化学式)。
1 (5)固体1灼烧发生反应的化学方程式为 。
【命题意图】
本题测试学生对铝土矿提取氧化铝工艺过程的分析,意在考察学生对氧化铝、氢氧化铝、
四羟基合铝酸盐、铝盐等性质的综合应用能力,以及能够正确运用化学用语来分析问题解决
问题。在该工艺过程中还涉及物质分离的方法考察,学生能够分析固液不互溶的分离方法。
[参考答案]
(1)过滤
—
(2)SiO32- 、 [Al(OH)4] - (或AlO2 ); H2SiO3
(3)3NH3· H2O + Al3+ Al(OH)3↓+3NH4+
(4)NH4Cl NaCl
(5) 2Al(OH)3 Al2O3+3H2O
20.(10分)
1(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将
其标号填在横线上。
①蚕丝的主要成分是 。
②我国“西气东输”的气体主要成分是 。
③酒驾是指驾驶员呼出的气体中 含量超标
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是 。
1 (2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
①E物质的名称为 。A→B的化学方程式为
②实验室利用A和C制取D,反应的化学方程式 ,收集装置可选用
下图 装置(填标号)。
【命题立意】
第一小题以四种重要有机化合物在生产生活中的重要作用为内容,认识甲烷 、乙酸、
乙醇 、蛋白质有机化合物在生产、生活中的重要应用,考查学生分析判断能力。第二小题
以常见有机物的转化为内容,考查“重要物质的名称”、“乙烯加成反应”“实验室制备乙酸
乙酯”,考查学生对有机基础知识的掌握程度,学生分析具体问题解决问题的能力,以及对
图像的观察思维的能力。化学学科思想上考查学生是否具备转化观,守恒观。
[参考答案]
(1)①D ②A ③C ④B Cu
(2)①聚乙烯(1分) 2C2H5OH+O2 2CH3CHO+2H2O
②CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
乙
21.(12分)氯化铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,
用还原铜粉和氯气来制备氯化铜。
已知:氯化铜容易潮解。
1 (1)配平A装置中发生反应的化学方程式:
2 KMnO4+ HCl(浓) KCl+ MnCl2+ Cl2↑+ H2O
3 装浓盐酸的仪器名称是 。
1 (2)B装置的作用是 ,C装置中的试剂是 ,
E装置的作用是 。
1 (3)F中发生的化学反应的离子方程式为 。
1 (4)当Cl2排尽空气后,加热D,装置D中的现象是 。
1 (5)某同学用不纯的铜粉(含少量铁粉)进行实验。铜粉和铁粉完全反应后,取少量产
物于一洁净的试管中,加水溶解,再加入 (填试剂),出现
1(填现象),则证明产物中含有 FeCl3。
1 (6)用15.8g KMnO4固体与足量的浓盐酸反应,被氧化的HCl是 mol。
【命题意图】
本题以氯气并对其性质进行实验探究为内容,考查化学方程式的配平,氧化还原反应离
子方程式的书写,以及仪器名称和装置的作用等。考查了学生接受,吸收,整合化学信息的能
力,分析推理能力、实验计算能力,实验探究能力。
[参考答案]
(1) 2 KMnO4+ 16 HCl(浓) 2 KCl+ 2 MnCl2+ 5 Cl2↑+ 8 H2O
(2)除去氯气中混有的氯化氢气体 浓硫酸 防止氯化铜潮解
- -
(3)Cl2 + 2OH Cl- + ClO + H2O
(4)产生棕黄色的烟
(5)KSCN溶液 血红色
(6)5.6
同课章节目录
