第四节 酸碱中和反应 教案
图片预览



文档简介
第四节 酸碱中和反应
1.新版教材在编排上主要是以三个版块来实现课标要求的。第一、二板块中,教材通过中和反应实验及微观分析、酸碱中和反应过程中溶液pH的变化,第三板块中讲了中和反应应用的事实,使学生对中和反应有了一个较为完整的认识,让学生体会到中和反应在实际中的应用,感受化学在社会发展中的重要作用。
2.促进学生进一步形成“学有用的化学”的观念。本节中,无论是中和反应实验,还是中和反应的应用,都有着非常丰富的实际背景。通过本节的学习,学生进一步认识到化学在日常生活、工业生产和科学实验方面发挥重要的作用。
3.让学生再次尝试从微观角度认识化学反应。本节中,教材从离子角度对中和反应进行了分析,让学生初步接触“从离子角度分析化学反应”的方法,为后续复分解反应的学习奠定基础。
【教学目标】
1.知识与技能
(1)知道酸和碱之间发生中和反应,初步领会中和反应的实质。
(2)了解中和反应在实际中的应用。
2.过程与方法
(1)通过验证酸碱之间的反应,认识科学探究的基本过程,进行初步的探究活动。
(2)通过展示中和反应实质的微观图片,建立宏观现象与微观实质的联系。3.情感、态度与价值观
(1)通过“白酒变红酒,红酒变白酒”实验,增强学生对化学的好奇心和探究欲。
(2)在制定方案,探究实验和交流讨论中,发展勤于思考,善于合作,严谨求实,勇于实践的科学精神。
【教学重点】
(1)对“白酒变红酒,红酒变白酒”实验进行分析与猜想,并设计实验验证酸和碱发生反应。
(2)初步领会中和反应的实质。
【教学难点】
在坐标系中表示酸碱度的变化情况。
【教学准备】
教学设备(投影仪,计算机,多媒体);盐酸、氢氧化钠溶液、稀硫酸、石蕊、酚酞、碳酸钙、氧化铜、锌粒、硫酸铜、0.4%氢氧化钠溶液,0.4%稀盐酸
试管、试管架、烧杯、玻璃棒、胶头滴管、玻璃片、温度计、蒸发皿、酒精灯、火柴
导入新课
演示实验:《白酒变红酒,红酒变白酒》
提出问题:利用我们课题1学过的知识进行大胆猜测,实验中可能用到了哪些试剂。你能得到什么信息?
老师揭秘实验原理。(“白酒”是酚酞试液,向酚酞试液中加入氢氧化钠溶液,溶液变成红色,然后再向溶液中加入盐酸,溶液变为无色。原来氢氧化钠和盐酸发生反应,生成氯化钠溶液,不能使酚酞变色,溶液变为无色。)二、推进新课
活动1 复习引入
【引入】完成下列两组反应。(提示:根据化合价判断。)
组(横线为学生填写)
【问】上面生成物有什么共同特点?
答:都生成了水和盐。
【过渡】反应之后,酸没有了,碱没有了,生成了中性的盐和水。这一类型的反应与我们上面的“魔术”原理相同,化学上称为中和反应。
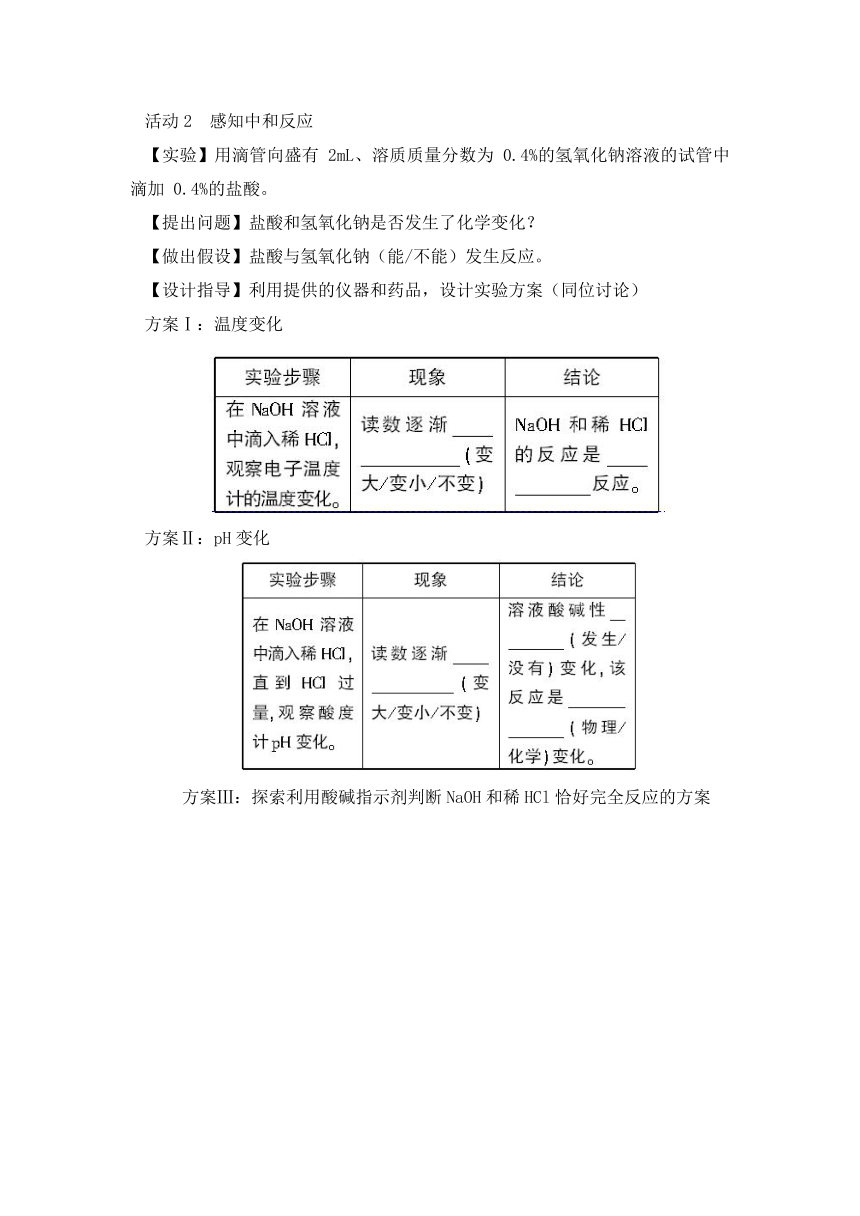
活动2 感知中和反应
【实验】用滴管向盛有 2mL、溶质质量分数为 0.4%的氢氧化钠溶液的试管中滴加 0.4%的盐酸。
【提出问题】盐酸和氢氧化钠是否发生了化学变化?
【做出假设】盐酸与氢氧化钠(能/不能)发生反应。
【设计指导】利用提供的仪器和药品,设计实验方案(同位讨论)
方案Ⅰ:温度变化
方案Ⅱ:pH变化
方案Ⅲ:探索利用酸碱指示剂判断NaOH和稀HCl恰好完全反应的方案
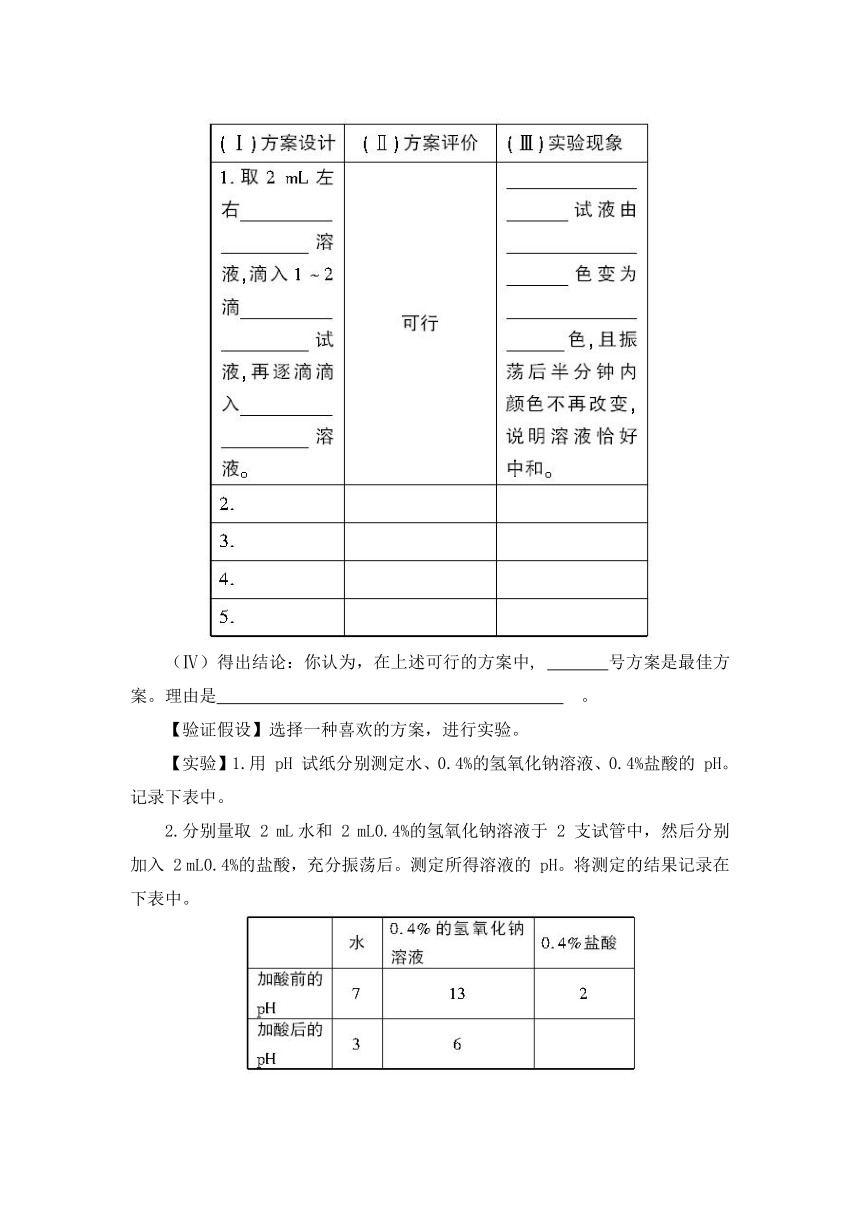
(Ⅳ)得出结论:你认为,在上述可行的方案中, 号方案是最佳方案。理由是 。
【验证假设】选择一种喜欢的方案,进行实验。
【实验】1.用 pH 试纸分别测定水、0.4%的氢氧化钠溶液、0.4%盐酸的 pH。记录下表中。
2.分别量取 2 mL水和 2 mL0.4%的氢氧化钠溶液于 2 支试管中,然后分别加入 2 mL0.4%的盐酸,充分振荡后。测定所得溶液的 pH。将测定的结果记录在下表中。
【讨论】解释与结论:
你认为2 mL0.4%的氢氧化钠溶液中加入2 mL0.4%的盐酸后,溶液pH的变化原因是什么?能否说明酸和碱之间发生了化学反应?
【讲解】在这个实验中,盐酸和水这组的反应是作为对照实验,排除了溶液混合后pH的变化是由于相互稀释造成的。通过实验可以发现,氢氧化钠溶液和盐酸混合后,溶液的 pH 发生了明显变化,说明酸碱两溶液发生了化学反应。
活动3 感悟中和反应的实质
【投影】下图是盐酸和氢氧化钠溶液反应的微观示意图。(可设计flash动画)
【讨论】(1)反应前,盐酸(H+和Cl-)和氢氧化钠溶液(Na+和OH-)中分别存在哪些粒子?反应后,生成物溶液中存在哪些微粒?(Na+和Cl-)(2)对比反应前后粒子种类的变化,你认为上述变化中参与反应的粒子有哪些(H+和OH-)?把你的想法与同伴交流。
【演板】(1)写出上述过程发生变化的化学方程式。
试着写出下列反应的化学方程式。
【思考】以上反应均为中和反应,你能从反应物和生成物的种类归纳中和反应的概念吗?
【投影】酸与碱作用,生成盐和水的反应,叫中和反应。
【思考】有盐和水生成的反应一定是中和反应吗?试举例说明。
【讲解】有盐和水生成的反应不一定是中和反应。可
【实践】练习P19“在线测试”。
中和反应的应用
活动4 感悟酸碱中和反应过程中溶液pH的变化
【flash展示】向盛有10 mL稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH,得到的数据如下表所示:
请你分析表中的实验数据,并绘出烧杯中溶液的pH与加入氢氧化钠溶液体积(V)之间的变化关系
实验结果表明:
当滴入的氢氧化钠溶液量较少时,盐酸有剩余,溶液显( )性;
当滴入的氢氧化钠溶液与盐酸恰好完全反应时,溶液显( )性;
当滴入的氢氧化钠溶液过量时,氢氧化钠有剩余,溶液显( )性。
【投影】课本P20“活动天地”
溶液颜色变化:红色→浅红色→无色
溶液酸碱性变化:碱性→弱碱性→中性→酸性
溶液pH变化:>7→靠近7→=7→<7
溶液中的溶质:NaOH→NaOH、NaCl→NaCl
【感悟】挑战自我——体验成功。
活动5 了解中和反应在生产、生活中的应用
【阅读】阅读下列生活实例,并解释相关问题:
(4)皮蛋味涩(呈碱性),食用时如何除去涩味?
用食醋中和。
(5)治疗昆虫的刺
黄蜂刺是碱性的,在刺伤了的地方涂上一些弱酸便可把碱性中和。
蜜蜂刺却是酸性的,根据同样的道理你会怎样治疗了吧。
典例剖析
例 向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液显 色;当加入稀盐酸的体积为14 mL时,溶液显 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有: 。
【解析】氢氧化钠溶液和稀盐酸反应没有明显现象,为了证明反应发生需要借助指示剂或者pH的测定。当pH=7时溶液为中性也就是恰好中和时,pH<7溶液呈酸性,也就是酸过量,此时溶质应该有生成物氯化钠和过量的氯化氢,当pH>7时溶液呈碱性,也就是碱过量。
【答案】(1)10 (2)红 无(3)NaCl、HCl
课堂小结
【我的收获】
1.中和反应:酸碱作用生成盐和水的反应。
2.探究中和反应是否发生,利用反应物消失或者验证有新物质生成。
3.利用中和反应可以改良酸性土壤,处理硫酸厂的废水,治疗胃酸过多等。
五、布置作业
1.完成本课时对应练习。
2.课本P22“挑战自我”1、2、3、4题。
教材习题解答
在线测试(P19)
挑战自我(P22)
1.C【解析】由于氢氧化钠溶液呈碱性使酚酞试液变红,滴加的稀硫酸与氢氧化钠反应,其碱性逐渐减弱,颜色逐渐变浅至无色,pH也会随之减小。
2.硫酸 氢氧化钠 是 2NaOH+H2SO4=Na2SO4+2H2O
3.(1)酸性 (2)取河水样品加入紫色石蕊试液,若变红则显酸性。(或用pH试纸、pH计)(3)首先把已污染的河水进行治理,再增加植被;其次对化工厂排放入此河的污水要治理,使其达标排放。【解析】试题提供pH在1~4之间的信息,说明河水显酸性.测定酸碱度应用pH试纸,提供的其他方法都只能判断溶液的酸碱性。河水污染根治不是简单的化学反应和污水转移,应考虑从源头进行根治方法的合理性。
4.撒适量氢氧化钙(熟石灰) Ca(OH)2+H2SO4=CaSO4+2H2O
第四节 酸碱中和反应
一、中和反应
1.定义:酸和碱作用生成盐和水
2.盐:在水溶液中能解离出金属离子和酸根离子的化合物
二、中和反应在实际中的应用
1.改变土壤的酸碱性;
2.处理工厂的废水;
3.应用医药。
1.本节课抓住了科学探究中最为重要的因素:精心设计和选材,趣味实验“魔术”引入课题,创设了真实的问题情景,激发了学生强烈的求知欲和探究兴趣,为后面的一系列探究营造了良好的氛围。提供的“探究实验”和背景资料,为学生的探究过程起了较好的引导作用,使学生能在轻松、有趣的探究学习气氛中研究有关酸碱中和的化学知识,体验发现的乐趣,发展获取信息、交流表达及与他人合作的能力。教师较好地转变了自己的角色,遵循学生的认知心理,巧妙处理“有用”与“有趣”的关系。
2.利用多种手段促进学生对中和反应实质的理解。如果学生不能很好从离子角度认识中和反应,后续复分解反应的学习就会产生障碍。因此,“从离子角度认识中和反应”在很大程度上影响了学生的化学学习。为更好解决这一问题,教学中出应尽可能安排学生通过实验从宏观上认识中和反应,然后借助一些多媒体课件如flash动画使学生认识到宏观现象的发生实际上是微观粒子间反应的表现。
1.新版教材在编排上主要是以三个版块来实现课标要求的。第一、二板块中,教材通过中和反应实验及微观分析、酸碱中和反应过程中溶液pH的变化,第三板块中讲了中和反应应用的事实,使学生对中和反应有了一个较为完整的认识,让学生体会到中和反应在实际中的应用,感受化学在社会发展中的重要作用。
2.促进学生进一步形成“学有用的化学”的观念。本节中,无论是中和反应实验,还是中和反应的应用,都有着非常丰富的实际背景。通过本节的学习,学生进一步认识到化学在日常生活、工业生产和科学实验方面发挥重要的作用。
3.让学生再次尝试从微观角度认识化学反应。本节中,教材从离子角度对中和反应进行了分析,让学生初步接触“从离子角度分析化学反应”的方法,为后续复分解反应的学习奠定基础。
【教学目标】
1.知识与技能
(1)知道酸和碱之间发生中和反应,初步领会中和反应的实质。
(2)了解中和反应在实际中的应用。
2.过程与方法
(1)通过验证酸碱之间的反应,认识科学探究的基本过程,进行初步的探究活动。
(2)通过展示中和反应实质的微观图片,建立宏观现象与微观实质的联系。3.情感、态度与价值观
(1)通过“白酒变红酒,红酒变白酒”实验,增强学生对化学的好奇心和探究欲。
(2)在制定方案,探究实验和交流讨论中,发展勤于思考,善于合作,严谨求实,勇于实践的科学精神。
【教学重点】
(1)对“白酒变红酒,红酒变白酒”实验进行分析与猜想,并设计实验验证酸和碱发生反应。
(2)初步领会中和反应的实质。
【教学难点】
在坐标系中表示酸碱度的变化情况。
【教学准备】
教学设备(投影仪,计算机,多媒体);盐酸、氢氧化钠溶液、稀硫酸、石蕊、酚酞、碳酸钙、氧化铜、锌粒、硫酸铜、0.4%氢氧化钠溶液,0.4%稀盐酸
试管、试管架、烧杯、玻璃棒、胶头滴管、玻璃片、温度计、蒸发皿、酒精灯、火柴
导入新课
演示实验:《白酒变红酒,红酒变白酒》
提出问题:利用我们课题1学过的知识进行大胆猜测,实验中可能用到了哪些试剂。你能得到什么信息?
老师揭秘实验原理。(“白酒”是酚酞试液,向酚酞试液中加入氢氧化钠溶液,溶液变成红色,然后再向溶液中加入盐酸,溶液变为无色。原来氢氧化钠和盐酸发生反应,生成氯化钠溶液,不能使酚酞变色,溶液变为无色。)二、推进新课
活动1 复习引入
【引入】完成下列两组反应。(提示:根据化合价判断。)
组(横线为学生填写)
【问】上面生成物有什么共同特点?
答:都生成了水和盐。
【过渡】反应之后,酸没有了,碱没有了,生成了中性的盐和水。这一类型的反应与我们上面的“魔术”原理相同,化学上称为中和反应。
活动2 感知中和反应
【实验】用滴管向盛有 2mL、溶质质量分数为 0.4%的氢氧化钠溶液的试管中滴加 0.4%的盐酸。
【提出问题】盐酸和氢氧化钠是否发生了化学变化?
【做出假设】盐酸与氢氧化钠(能/不能)发生反应。
【设计指导】利用提供的仪器和药品,设计实验方案(同位讨论)
方案Ⅰ:温度变化
方案Ⅱ:pH变化
方案Ⅲ:探索利用酸碱指示剂判断NaOH和稀HCl恰好完全反应的方案
(Ⅳ)得出结论:你认为,在上述可行的方案中, 号方案是最佳方案。理由是 。
【验证假设】选择一种喜欢的方案,进行实验。
【实验】1.用 pH 试纸分别测定水、0.4%的氢氧化钠溶液、0.4%盐酸的 pH。记录下表中。
2.分别量取 2 mL水和 2 mL0.4%的氢氧化钠溶液于 2 支试管中,然后分别加入 2 mL0.4%的盐酸,充分振荡后。测定所得溶液的 pH。将测定的结果记录在下表中。
【讨论】解释与结论:
你认为2 mL0.4%的氢氧化钠溶液中加入2 mL0.4%的盐酸后,溶液pH的变化原因是什么?能否说明酸和碱之间发生了化学反应?
【讲解】在这个实验中,盐酸和水这组的反应是作为对照实验,排除了溶液混合后pH的变化是由于相互稀释造成的。通过实验可以发现,氢氧化钠溶液和盐酸混合后,溶液的 pH 发生了明显变化,说明酸碱两溶液发生了化学反应。
活动3 感悟中和反应的实质
【投影】下图是盐酸和氢氧化钠溶液反应的微观示意图。(可设计flash动画)
【讨论】(1)反应前,盐酸(H+和Cl-)和氢氧化钠溶液(Na+和OH-)中分别存在哪些粒子?反应后,生成物溶液中存在哪些微粒?(Na+和Cl-)(2)对比反应前后粒子种类的变化,你认为上述变化中参与反应的粒子有哪些(H+和OH-)?把你的想法与同伴交流。
【演板】(1)写出上述过程发生变化的化学方程式。
试着写出下列反应的化学方程式。
【思考】以上反应均为中和反应,你能从反应物和生成物的种类归纳中和反应的概念吗?
【投影】酸与碱作用,生成盐和水的反应,叫中和反应。
【思考】有盐和水生成的反应一定是中和反应吗?试举例说明。
【讲解】有盐和水生成的反应不一定是中和反应。可
【实践】练习P19“在线测试”。
中和反应的应用
活动4 感悟酸碱中和反应过程中溶液pH的变化
【flash展示】向盛有10 mL稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH,得到的数据如下表所示:
请你分析表中的实验数据,并绘出烧杯中溶液的pH与加入氢氧化钠溶液体积(V)之间的变化关系
实验结果表明:
当滴入的氢氧化钠溶液量较少时,盐酸有剩余,溶液显( )性;
当滴入的氢氧化钠溶液与盐酸恰好完全反应时,溶液显( )性;
当滴入的氢氧化钠溶液过量时,氢氧化钠有剩余,溶液显( )性。
【投影】课本P20“活动天地”
溶液颜色变化:红色→浅红色→无色
溶液酸碱性变化:碱性→弱碱性→中性→酸性
溶液pH变化:>7→靠近7→=7→<7
溶液中的溶质:NaOH→NaOH、NaCl→NaCl
【感悟】挑战自我——体验成功。
活动5 了解中和反应在生产、生活中的应用
【阅读】阅读下列生活实例,并解释相关问题:
(4)皮蛋味涩(呈碱性),食用时如何除去涩味?
用食醋中和。
(5)治疗昆虫的刺
黄蜂刺是碱性的,在刺伤了的地方涂上一些弱酸便可把碱性中和。
蜜蜂刺却是酸性的,根据同样的道理你会怎样治疗了吧。
典例剖析
例 向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液显 色;当加入稀盐酸的体积为14 mL时,溶液显 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有: 。
【解析】氢氧化钠溶液和稀盐酸反应没有明显现象,为了证明反应发生需要借助指示剂或者pH的测定。当pH=7时溶液为中性也就是恰好中和时,pH<7溶液呈酸性,也就是酸过量,此时溶质应该有生成物氯化钠和过量的氯化氢,当pH>7时溶液呈碱性,也就是碱过量。
【答案】(1)10 (2)红 无(3)NaCl、HCl
课堂小结
【我的收获】
1.中和反应:酸碱作用生成盐和水的反应。
2.探究中和反应是否发生,利用反应物消失或者验证有新物质生成。
3.利用中和反应可以改良酸性土壤,处理硫酸厂的废水,治疗胃酸过多等。
五、布置作业
1.完成本课时对应练习。
2.课本P22“挑战自我”1、2、3、4题。
教材习题解答
在线测试(P19)
挑战自我(P22)
1.C【解析】由于氢氧化钠溶液呈碱性使酚酞试液变红,滴加的稀硫酸与氢氧化钠反应,其碱性逐渐减弱,颜色逐渐变浅至无色,pH也会随之减小。
2.硫酸 氢氧化钠 是 2NaOH+H2SO4=Na2SO4+2H2O
3.(1)酸性 (2)取河水样品加入紫色石蕊试液,若变红则显酸性。(或用pH试纸、pH计)(3)首先把已污染的河水进行治理,再增加植被;其次对化工厂排放入此河的污水要治理,使其达标排放。【解析】试题提供pH在1~4之间的信息,说明河水显酸性.测定酸碱度应用pH试纸,提供的其他方法都只能判断溶液的酸碱性。河水污染根治不是简单的化学反应和污水转移,应考虑从源头进行根治方法的合理性。
4.撒适量氢氧化钙(熟石灰) Ca(OH)2+H2SO4=CaSO4+2H2O
第四节 酸碱中和反应
一、中和反应
1.定义:酸和碱作用生成盐和水
2.盐:在水溶液中能解离出金属离子和酸根离子的化合物
二、中和反应在实际中的应用
1.改变土壤的酸碱性;
2.处理工厂的废水;
3.应用医药。
1.本节课抓住了科学探究中最为重要的因素:精心设计和选材,趣味实验“魔术”引入课题,创设了真实的问题情景,激发了学生强烈的求知欲和探究兴趣,为后面的一系列探究营造了良好的氛围。提供的“探究实验”和背景资料,为学生的探究过程起了较好的引导作用,使学生能在轻松、有趣的探究学习气氛中研究有关酸碱中和的化学知识,体验发现的乐趣,发展获取信息、交流表达及与他人合作的能力。教师较好地转变了自己的角色,遵循学生的认知心理,巧妙处理“有用”与“有趣”的关系。
2.利用多种手段促进学生对中和反应实质的理解。如果学生不能很好从离子角度认识中和反应,后续复分解反应的学习就会产生障碍。因此,“从离子角度认识中和反应”在很大程度上影响了学生的化学学习。为更好解决这一问题,教学中出应尽可能安排学生通过实验从宏观上认识中和反应,然后借助一些多媒体课件如flash动画使学生认识到宏观现象的发生实际上是微观粒子间反应的表现。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
