第三节 大自然中的二氧化碳(30张PPT)
文档属性
| 名称 | 第三节 大自然中的二氧化碳(30张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-08 09:59:11 | ||
图片预览











文档简介
第三节 大自然中的二氧化碳
鲁教版·九年级化学上册
新课导入
化石燃料作为一种优质能源,在人类社会的发展过程中发挥了巨大作用。可以说,没有化石燃料,就不可能有现代化的生产和生活。
然而,近一百多年来,人类对化石燃料持续进行的大规模开采和利用,使其储量急剧减少,同时导致地球大气中二氧化碳含量持续升高。如此一来,二氧化碳在大自然中的循环还能够保持平衡吗?二氧化碳在大气中的含量升高会对自然环境产生怎样的影响?
进行新课
一、二氧化碳的循环
科学家在一个固定的位置设置了高精度的气体分析仪器,对空气中二氧化碳的含量进行了连续测量。下图描述的是1958—2011年间的测量结果。
活动天地 6-6
寻找图像中的信息
1.认真观察上页图中曲线的形状和走势,想一想:
(1)图中红色曲线反映出的同一年度内空气中二氧化碳含量是如何变化的?是不是每一年都在重复同样的变化规律?原因是什么?
(2)在不同年度,空气中二氧化碳含量的变化呈现了怎样的趋势?
(3)你还能从这幅图中获得哪些信息?
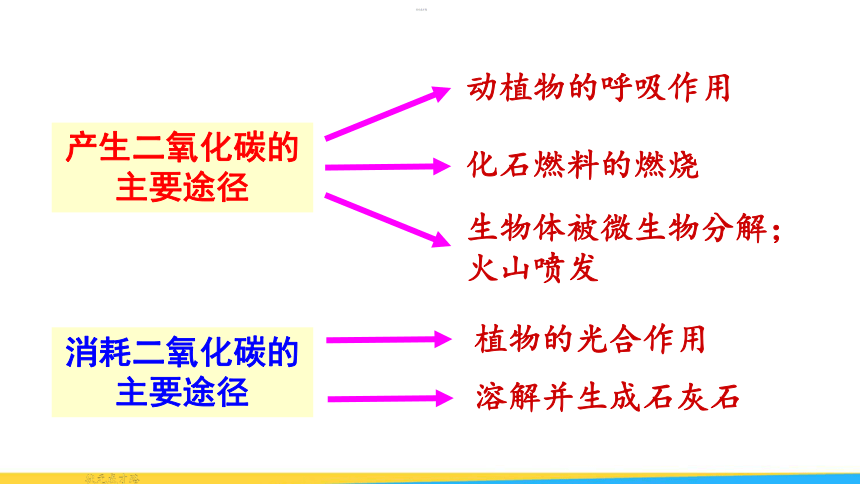
2. 观察下图,分析二氧化碳产生和消耗的途径,
试讨论:
(1)二氧化碳是怎样循环的?
(2)二氧化碳的循环对自然界和人类社会有什么意义?
(3)导致大气中二氧化碳含量逐年升高的可能原因是什么?(图中数字表示通过不同途径产生或消耗碳量的相对值)
产生二氧化碳的主要途径
动植物的呼吸作用
化石燃料的燃烧
生物体被微生物分解;火山喷发
消耗二氧化碳的主要途径
植物的光合作用
溶解并生成石灰石
大气中二氧化碳的产生和消耗
阅读教材P133相关内容,了解科学家的三种不同观点。如何减少二氧化碳的排放量?
(1)节能减排:节约能源、降低能源消耗、减少污染物排放。
(2)低碳生活:把生活作息时所耗用的能量要尽量减少,从而减低二氧化碳的排放量。
多识一点
低碳生活
如果你乘飞机旅行2000 km,那么就相当于你排放了280 kg的二氧化碳;如果你用了100度电,那么就相当于你排放了100 kg二氧化碳;如果你自驾车消耗了100 L汽油,那么就相当于你排放了270 kg二氧化碳??面对全球变暖等气候问题,人类意识到生产和消费过程中出现的过量碳排放,是导致气候变化的重要因素之一。要减少碳排放,就要优化和约束某些消费和生产活动。
为了更好地保护地球,使人类免受全球气候变暖的威胁,一种新的生活方式——“低碳生活”逐渐受到了人们的重视。低碳生活意味着在日常生活中尽可能直接或间接减少化石能源消耗,从而降低二氧化碳排放量。例如:每节约1度电,就可以减排1 kg二氧化碳;少用10双一次性筷子,减排0.2 kg二氧化碳。身为“地球村”的一员,我们每个人都要为节能减排做出自己的贡献。
二、二氧化碳的性质
1.实验室制取二氧化碳
(1)药品:稀盐酸和大理石或石灰石
(2)反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)制取装置
2
实验步骤
①检验气密性——②加入药品——③收集气体——④进行验满——⑤检验气体。
思考:如何检查装置的气密性?
如图所示,组装好仪器后,先把导气管的一端浸入水里,然后用手掌紧贴容器外壁,如果导气管口有气泡冒出,或者松开手,导气管口浸水的一端形成一段高于水面的水柱,则表明装置气密性良好。
检验:将气体通入澄清石灰水(或往气体中滴加澄清石灰水,振荡),石灰水变浑浊,说明该气体是CO2。
验满:将燃着的木条平放在集气瓶口,木条熄灭,说明CO2已满。
澄清石灰水
变浑浊
CO2+Ca(OH)2=CaCO3↓+H2O
注意事项:
长颈漏斗下端应浸入液面以下
防止气体从长颈漏斗逸出
导管应刚露出橡皮塞即可
以利于气体的导出
导管应伸入集气瓶底部
有利于排尽集气瓶内的空气
2.二氧化碳的性质
在通常状况下,二氧化碳是一种无色、能溶于水的气体,密度约为空气的1.5倍。
二氧化碳气体在一定压强和低温条件下能够形成白色块状或片状固体,俗称“干冰”,是一种常用的制冷剂。
二氧化碳和水反应生成的碳酸能使紫色石蕊变红,化学方程式为H2O+CO2=H2CO3。
二氧化碳的化学性质稳定且没有毒性,可用作科学实验和工业生产的保护气。在农业生产上,二氧化碳是最好的气体肥料。二氧化碳还是生产尿素、甲醇、碳酸氢铵和碳酸氢钠(俗称“小苏打”)等的重要原料。
二氧化碳不仅能与水反应生成碳酸,还能参与绿色植物的光合作用,合成葡萄糖:
H2O+CO2=C6H12O6+6O2
光照
思考:同样是二氧化碳跟水的反应,产物却完全不同,这是为什么呢?
多识一点
溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙〔Ca(HCO3)2〕:
CaCO3+H2O+CO2= Ca(HCO3)2
当受热或压强突然变小时,水中的碳酸氢钙会分解,重新变成碳酸钙沉积下来:
Ca(HCO3)2= CaCO3↓ + CO2↑ + H2O
在自然界里不断发生着上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
思考:二氧化碳通入澄清石灰水,能看到澄清石灰水变浑浊,但继续通入二氧化碳后,石灰水又由浑浊变为澄清,这是为什么?
随堂练习
1.自然界存在如图所示的循环过程,图中A处不包括下列哪项( )
A.人和动物的呼吸
B.植物的呼吸作用
C.用氢气做燃料驱动火箭
D.煤的燃烧
C
2. 为了减缓大气中二氧化碳含量的增加,以下建议可行的是( )
①开发太阳能、风能、水能、地热能等新能源
②禁止使用煤、石油、天然气等矿物燃料
③大量植树造林,禁止乱砍乱伐
A.①②③ B.①③ C.②③ D.①②
B
3.鉴定二氧化碳气体常用( ),检验集气瓶中的二氧化碳气体是否集满可用( )
A.倒入紫色石蕊试液并振荡
B.燃着的木条放在集气瓶口
C.带火星的木条放在集气瓶口
D.倒入澄清石灰水并振荡
D
B
4.鉴别氢气、氧气和二氧化碳三种气体最简便的方法是( )
A.分别通入澄清石灰水
B.测定三种气体的密度
C.用燃着的木条放在集气瓶内
D.做三种气体的溶解性实验
C
课堂小结
谈谈你在这节课中,有什么收获?
课后作业
完成练习册本课时的习题
鲁教版·九年级化学上册
新课导入
化石燃料作为一种优质能源,在人类社会的发展过程中发挥了巨大作用。可以说,没有化石燃料,就不可能有现代化的生产和生活。
然而,近一百多年来,人类对化石燃料持续进行的大规模开采和利用,使其储量急剧减少,同时导致地球大气中二氧化碳含量持续升高。如此一来,二氧化碳在大自然中的循环还能够保持平衡吗?二氧化碳在大气中的含量升高会对自然环境产生怎样的影响?
进行新课
一、二氧化碳的循环
科学家在一个固定的位置设置了高精度的气体分析仪器,对空气中二氧化碳的含量进行了连续测量。下图描述的是1958—2011年间的测量结果。
活动天地 6-6
寻找图像中的信息
1.认真观察上页图中曲线的形状和走势,想一想:
(1)图中红色曲线反映出的同一年度内空气中二氧化碳含量是如何变化的?是不是每一年都在重复同样的变化规律?原因是什么?
(2)在不同年度,空气中二氧化碳含量的变化呈现了怎样的趋势?
(3)你还能从这幅图中获得哪些信息?
2. 观察下图,分析二氧化碳产生和消耗的途径,
试讨论:
(1)二氧化碳是怎样循环的?
(2)二氧化碳的循环对自然界和人类社会有什么意义?
(3)导致大气中二氧化碳含量逐年升高的可能原因是什么?(图中数字表示通过不同途径产生或消耗碳量的相对值)
产生二氧化碳的主要途径
动植物的呼吸作用
化石燃料的燃烧
生物体被微生物分解;火山喷发
消耗二氧化碳的主要途径
植物的光合作用
溶解并生成石灰石
大气中二氧化碳的产生和消耗
阅读教材P133相关内容,了解科学家的三种不同观点。如何减少二氧化碳的排放量?
(1)节能减排:节约能源、降低能源消耗、减少污染物排放。
(2)低碳生活:把生活作息时所耗用的能量要尽量减少,从而减低二氧化碳的排放量。
多识一点
低碳生活
如果你乘飞机旅行2000 km,那么就相当于你排放了280 kg的二氧化碳;如果你用了100度电,那么就相当于你排放了100 kg二氧化碳;如果你自驾车消耗了100 L汽油,那么就相当于你排放了270 kg二氧化碳??面对全球变暖等气候问题,人类意识到生产和消费过程中出现的过量碳排放,是导致气候变化的重要因素之一。要减少碳排放,就要优化和约束某些消费和生产活动。
为了更好地保护地球,使人类免受全球气候变暖的威胁,一种新的生活方式——“低碳生活”逐渐受到了人们的重视。低碳生活意味着在日常生活中尽可能直接或间接减少化石能源消耗,从而降低二氧化碳排放量。例如:每节约1度电,就可以减排1 kg二氧化碳;少用10双一次性筷子,减排0.2 kg二氧化碳。身为“地球村”的一员,我们每个人都要为节能减排做出自己的贡献。
二、二氧化碳的性质
1.实验室制取二氧化碳
(1)药品:稀盐酸和大理石或石灰石
(2)反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)制取装置
2
实验步骤
①检验气密性——②加入药品——③收集气体——④进行验满——⑤检验气体。
思考:如何检查装置的气密性?
如图所示,组装好仪器后,先把导气管的一端浸入水里,然后用手掌紧贴容器外壁,如果导气管口有气泡冒出,或者松开手,导气管口浸水的一端形成一段高于水面的水柱,则表明装置气密性良好。
检验:将气体通入澄清石灰水(或往气体中滴加澄清石灰水,振荡),石灰水变浑浊,说明该气体是CO2。
验满:将燃着的木条平放在集气瓶口,木条熄灭,说明CO2已满。
澄清石灰水
变浑浊
CO2+Ca(OH)2=CaCO3↓+H2O
注意事项:
长颈漏斗下端应浸入液面以下
防止气体从长颈漏斗逸出
导管应刚露出橡皮塞即可
以利于气体的导出
导管应伸入集气瓶底部
有利于排尽集气瓶内的空气
2.二氧化碳的性质
在通常状况下,二氧化碳是一种无色、能溶于水的气体,密度约为空气的1.5倍。
二氧化碳气体在一定压强和低温条件下能够形成白色块状或片状固体,俗称“干冰”,是一种常用的制冷剂。
二氧化碳和水反应生成的碳酸能使紫色石蕊变红,化学方程式为H2O+CO2=H2CO3。
二氧化碳的化学性质稳定且没有毒性,可用作科学实验和工业生产的保护气。在农业生产上,二氧化碳是最好的气体肥料。二氧化碳还是生产尿素、甲醇、碳酸氢铵和碳酸氢钠(俗称“小苏打”)等的重要原料。
二氧化碳不仅能与水反应生成碳酸,还能参与绿色植物的光合作用,合成葡萄糖:
H2O+CO2=C6H12O6+6O2
光照
思考:同样是二氧化碳跟水的反应,产物却完全不同,这是为什么呢?
多识一点
溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙〔Ca(HCO3)2〕:
CaCO3+H2O+CO2= Ca(HCO3)2
当受热或压强突然变小时,水中的碳酸氢钙会分解,重新变成碳酸钙沉积下来:
Ca(HCO3)2= CaCO3↓ + CO2↑ + H2O
在自然界里不断发生着上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
思考:二氧化碳通入澄清石灰水,能看到澄清石灰水变浑浊,但继续通入二氧化碳后,石灰水又由浑浊变为澄清,这是为什么?
随堂练习
1.自然界存在如图所示的循环过程,图中A处不包括下列哪项( )
A.人和动物的呼吸
B.植物的呼吸作用
C.用氢气做燃料驱动火箭
D.煤的燃烧
C
2. 为了减缓大气中二氧化碳含量的增加,以下建议可行的是( )
①开发太阳能、风能、水能、地热能等新能源
②禁止使用煤、石油、天然气等矿物燃料
③大量植树造林,禁止乱砍乱伐
A.①②③ B.①③ C.②③ D.①②
B
3.鉴定二氧化碳气体常用( ),检验集气瓶中的二氧化碳气体是否集满可用( )
A.倒入紫色石蕊试液并振荡
B.燃着的木条放在集气瓶口
C.带火星的木条放在集气瓶口
D.倒入澄清石灰水并振荡
D
B
4.鉴别氢气、氧气和二氧化碳三种气体最简便的方法是( )
A.分别通入澄清石灰水
B.测定三种气体的密度
C.用燃着的木条放在集气瓶内
D.做三种气体的溶解性实验
C
课堂小结
谈谈你在这节课中,有什么收获?
课后作业
完成练习册本课时的习题
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
