2020年湖南省普通高中学业水平合格性考试模拟试卷三 化学(长郡版)
文档属性
| 名称 | 2020年湖南省普通高中学业水平合格性考试模拟试卷三 化学(长郡版) |  | |
| 格式 | doc | ||
| 文件大小 | 785.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-09 16:01:55 | ||
图片预览


文档简介
机密★启用前
2020年湖南省普通高中学业水平合格性考试模拟试卷三(长郡版)
化学
本卷包括选择题、填空题和实验题三个部分,共4页。时量60分钟,满分100分。
可能用到的相对原子质:H~1 C~12 O~16 Na~23
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1.我国大型运载火箭“长征5号”的主发动机中所用的液氧(O2)属于
A.单质 B.氧化物 C.化合物 D.有机物
2.下列物质的保存方法正确的是
A.金属钠保存在煤油中 B.氢氧化钠保存在带玻璃塞的试剂瓶中
C.漂白粉长期放置在烧杯中 D.氯水保存在无色细口瓶中
3.下列反应属于吸热反应的是
A.铝跟盐酸反应 B.石灰石高温分解反应
C.盐酸与氢氧化钠溶液反应 D.酒精的燃烧
4.在用CCl4萃取碘水中的碘单质时,必须使用到的玻璃仪器是
5.下列属于电解质的是
A.葡萄糖 B.NaCl C.盐酸 D.碱石灰
6.Co是γ放射源,可用于农作物诱变育种。Co原子的核内质子数为
A.60 B.27 C.87 D.33
7.下列化学用语表述不正确的是
A.HCl的电子式: B.CH的球棍模型:
C.S2-的结构示意图: D.乙烯的结构简式:CH2=CH2
8.用下列试剂或方法不能鉴别NaOH溶液和KCl溶液的是
A.紫色石蕊试液 B.Ba(NO3)2溶液 C.CuCl2溶液 D.焰色反应
9.下列关于物质的量、摩尔质量的叙述正确的是
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 mol H2O中含有2 mol氢和1 mol氧
C.氢氧化钠的摩尔质量是40 g
D.2 mol水的摩尔质量是1 mol水摩尔质量的2倍
10.下列实验可以证明SO2具有漂白性的是
A.SO2通入酸性高锰酸钾溶液中 B.SO2通入品红溶液中
C.SO2通入紫色石蕊试液中 D.SO2通入氢氧化钠与酚酞的混合溶液中
11.下列反应属于氧化还原反应的是
A.2KBr+Cl2=2KCl+Br2 B.CaCO3CaO+CO2↑
C.SO3+H2O=H2SO4 D.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
12.下列物质中,能使溴的四氯化碳溶液褪色的是
A.甲烷 B.乙烯 C.乙醇 D.乙酸
13.下列说法正确的是
A.O表示中子数为10的氧元素的一种核素
B.C5H12的同分异构体有4种,其熔点各不相同
C.金刚石和石墨互为同素异形体,两者之间不能相互转化
D.CH3COOH和CH3COOCH3互为同系物
14.用0.1 mol的氯化钠固体配成溶液500 mL,所得溶液的物质的量浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
15.下列叙述正确的是
A.石油煤、天然气、氢气都属于化石燃料
B.煤干馏是复杂的物理化学变化,可得到焦炭、煤焦油焦炉煤气和汽油等
C.生物质包括农业废弃物、水生植物、有机废弃物、动物粪便等
D.吸热反应必须要加热才能发生
16.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉 B.镁粉 C.铁粉 D.铝粉
17.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是
A.正反应速率等于逆反应速率 B.反应物和生成物浓度不再发生变化
C.反应体系中混合物的组成保持不变 D.正、逆反应速率都为零
18.下列解释实验事实的离子方程式正确的是
A.用氢氧化钠溶液吸收氯气;Cl2+2OH-=ClO-+Cl-+H2O
B用大理石与稀盐酸制备二氧化碳;CO32-+2H+=CO2↑+H2O
C.稀硫酸与氯氧化钡溶液混合产生沉淀;Ba2++SO42-=BaSO4↓
D.铜片放入稀硝酸中产生气体:Cu+2H++NO3-=Cu2++NO2↑+H2O
二填空题(本题包括5小题,每空2分,共36分。)
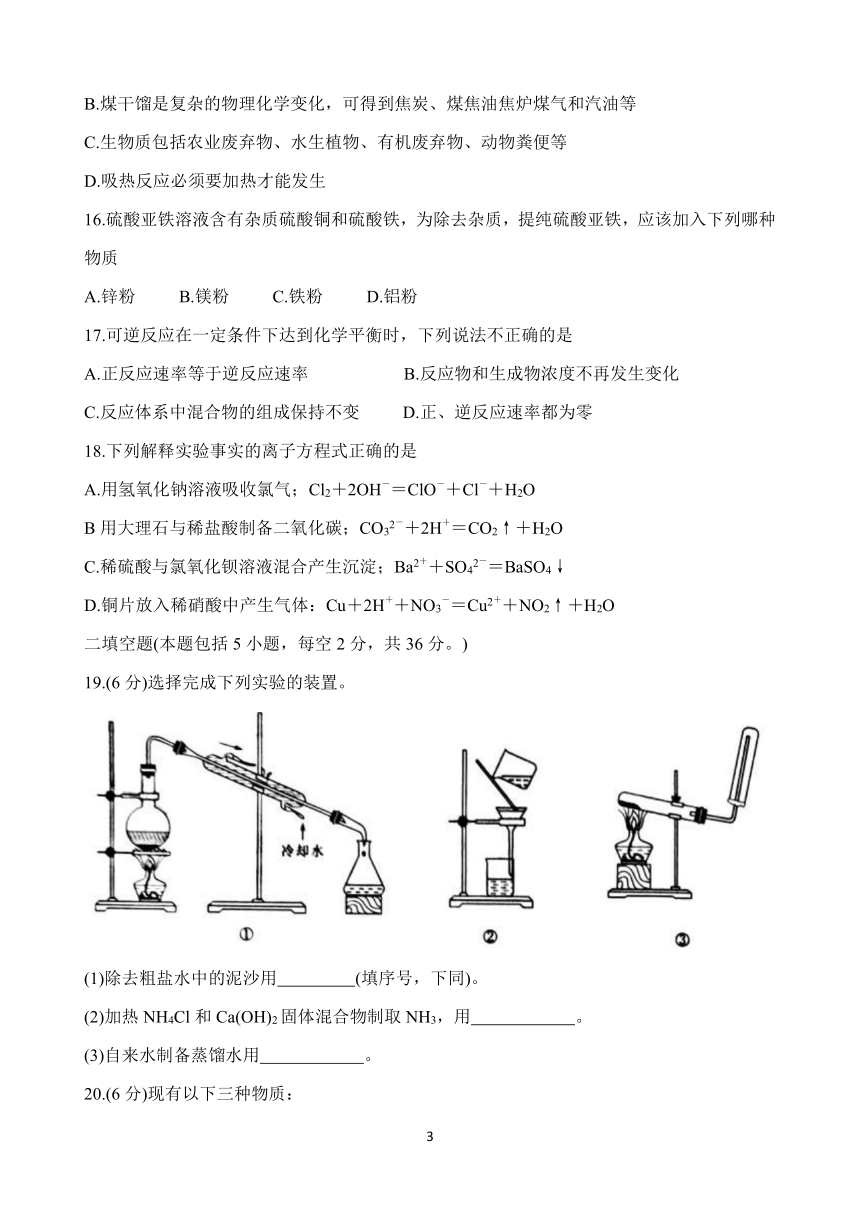
19.(6分)选择完成下列实验的装置。
(1)除去粗盐水中的泥沙用 (填序号,下同)。
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用 。
(3)自来水制备蒸馏水用 。
20.(6分)现有以下三种物质:
A.新制的氢氧化铜[Cu(OH)2]悬浊液 B.晶体硅(Si) C明矾[KAl(SO4)2·12H2O]
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验物质中是否含有醛基,可使用 ;
(2)用于制造太阳能电池的材料,可使用 ;
(3)要使含少量泥沙的浑浊水变澄清,可使用 。
21.(6分)原电池是化学电源的雏形。
(1)如图连接好装置后,负极材料是 (填“Zn”或“Cu”)。
(2)相应原电池的总反应方程式为 。
(3)下列化学反应可通过原电池装置,实现化学能直接转化为电能的是 (填序号)。
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O22CO3+3H2O
22.(8分)下表是现行中学化学教科书中元素周期表的一郁分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
(1)④表示的元素是 (填元素符号);
(2)②③两种元素相比较,原子半径较大的是 (填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式 ;
(4)③和⑤两种元素的非金属性强弱顺序是③ ⑤(填“<”或“>”)。
23.(10分)化工厂用浓氨水检验氯气管道是否漏气,利用的反应如下:8NH3+3Cl2=N2+xNH4Cl。
(1)上述方程式中x= 。
(2)作还原剂的物质是 (写化学式),氯元素的化合价 (填“升高”或“降低”)。
(3)反应中每生成6 mol NH4Cl,则消耗Cl2的物质的量至少为 mol,转移电子的物质的量为 mol。
三、实验题(本题包括1小题,每空2分,共10分。)
24.(10分)俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制收乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式 。
(2)浓硫酸的作用是作 剂和吸水剂。
(3)饱和Na2CO3溶液的主要作用之一是能除去乙酸乙酯中的乙酸,当乙酸含量较多时,该反应能产生一种气体,这种气体是 (填化学式)。
(4)装置中通蒸汽的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是为了防止 。
(5)若要把制得的乙酸乙酯分离出来,应采取的实验操作是 (填“分液”或“过滤”)。
1
2020年湖南省普通高中学业水平合格性考试模拟试卷三(长郡版)
化学
本卷包括选择题、填空题和实验题三个部分,共4页。时量60分钟,满分100分。
可能用到的相对原子质:H~1 C~12 O~16 Na~23
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1.我国大型运载火箭“长征5号”的主发动机中所用的液氧(O2)属于
A.单质 B.氧化物 C.化合物 D.有机物
2.下列物质的保存方法正确的是
A.金属钠保存在煤油中 B.氢氧化钠保存在带玻璃塞的试剂瓶中
C.漂白粉长期放置在烧杯中 D.氯水保存在无色细口瓶中
3.下列反应属于吸热反应的是
A.铝跟盐酸反应 B.石灰石高温分解反应
C.盐酸与氢氧化钠溶液反应 D.酒精的燃烧
4.在用CCl4萃取碘水中的碘单质时,必须使用到的玻璃仪器是
5.下列属于电解质的是
A.葡萄糖 B.NaCl C.盐酸 D.碱石灰
6.Co是γ放射源,可用于农作物诱变育种。Co原子的核内质子数为
A.60 B.27 C.87 D.33
7.下列化学用语表述不正确的是
A.HCl的电子式: B.CH的球棍模型:
C.S2-的结构示意图: D.乙烯的结构简式:CH2=CH2
8.用下列试剂或方法不能鉴别NaOH溶液和KCl溶液的是
A.紫色石蕊试液 B.Ba(NO3)2溶液 C.CuCl2溶液 D.焰色反应
9.下列关于物质的量、摩尔质量的叙述正确的是
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 mol H2O中含有2 mol氢和1 mol氧
C.氢氧化钠的摩尔质量是40 g
D.2 mol水的摩尔质量是1 mol水摩尔质量的2倍
10.下列实验可以证明SO2具有漂白性的是
A.SO2通入酸性高锰酸钾溶液中 B.SO2通入品红溶液中
C.SO2通入紫色石蕊试液中 D.SO2通入氢氧化钠与酚酞的混合溶液中
11.下列反应属于氧化还原反应的是
A.2KBr+Cl2=2KCl+Br2 B.CaCO3CaO+CO2↑
C.SO3+H2O=H2SO4 D.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
12.下列物质中,能使溴的四氯化碳溶液褪色的是
A.甲烷 B.乙烯 C.乙醇 D.乙酸
13.下列说法正确的是
A.O表示中子数为10的氧元素的一种核素
B.C5H12的同分异构体有4种,其熔点各不相同
C.金刚石和石墨互为同素异形体,两者之间不能相互转化
D.CH3COOH和CH3COOCH3互为同系物
14.用0.1 mol的氯化钠固体配成溶液500 mL,所得溶液的物质的量浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
15.下列叙述正确的是
A.石油煤、天然气、氢气都属于化石燃料
B.煤干馏是复杂的物理化学变化,可得到焦炭、煤焦油焦炉煤气和汽油等
C.生物质包括农业废弃物、水生植物、有机废弃物、动物粪便等
D.吸热反应必须要加热才能发生
16.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉 B.镁粉 C.铁粉 D.铝粉
17.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是
A.正反应速率等于逆反应速率 B.反应物和生成物浓度不再发生变化
C.反应体系中混合物的组成保持不变 D.正、逆反应速率都为零
18.下列解释实验事实的离子方程式正确的是
A.用氢氧化钠溶液吸收氯气;Cl2+2OH-=ClO-+Cl-+H2O
B用大理石与稀盐酸制备二氧化碳;CO32-+2H+=CO2↑+H2O
C.稀硫酸与氯氧化钡溶液混合产生沉淀;Ba2++SO42-=BaSO4↓
D.铜片放入稀硝酸中产生气体:Cu+2H++NO3-=Cu2++NO2↑+H2O
二填空题(本题包括5小题,每空2分,共36分。)
19.(6分)选择完成下列实验的装置。
(1)除去粗盐水中的泥沙用 (填序号,下同)。
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用 。
(3)自来水制备蒸馏水用 。
20.(6分)现有以下三种物质:
A.新制的氢氧化铜[Cu(OH)2]悬浊液 B.晶体硅(Si) C明矾[KAl(SO4)2·12H2O]
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验物质中是否含有醛基,可使用 ;
(2)用于制造太阳能电池的材料,可使用 ;
(3)要使含少量泥沙的浑浊水变澄清,可使用 。
21.(6分)原电池是化学电源的雏形。
(1)如图连接好装置后,负极材料是 (填“Zn”或“Cu”)。
(2)相应原电池的总反应方程式为 。
(3)下列化学反应可通过原电池装置,实现化学能直接转化为电能的是 (填序号)。
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O22CO3+3H2O
22.(8分)下表是现行中学化学教科书中元素周期表的一郁分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
(1)④表示的元素是 (填元素符号);
(2)②③两种元素相比较,原子半径较大的是 (填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式 ;
(4)③和⑤两种元素的非金属性强弱顺序是③ ⑤(填“<”或“>”)。
23.(10分)化工厂用浓氨水检验氯气管道是否漏气,利用的反应如下:8NH3+3Cl2=N2+xNH4Cl。
(1)上述方程式中x= 。
(2)作还原剂的物质是 (写化学式),氯元素的化合价 (填“升高”或“降低”)。
(3)反应中每生成6 mol NH4Cl,则消耗Cl2的物质的量至少为 mol,转移电子的物质的量为 mol。
三、实验题(本题包括1小题,每空2分,共10分。)
24.(10分)俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制收乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式 。
(2)浓硫酸的作用是作 剂和吸水剂。
(3)饱和Na2CO3溶液的主要作用之一是能除去乙酸乙酯中的乙酸,当乙酸含量较多时,该反应能产生一种气体,这种气体是 (填化学式)。
(4)装置中通蒸汽的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是为了防止 。
(5)若要把制得的乙酸乙酯分离出来,应采取的实验操作是 (填“分液”或“过滤”)。
1
同课章节目录
