人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
文档属性
| 名称 | 人教版九年级下册化学《 9.2 溶解度》课件(43张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-10 23:10:05 | ||
图片预览








文档简介
(共43张PPT)
课题2
溶解度
(第一课时)
学习目标
1.理解饱和溶液和不饱和溶液。
2.掌握饱和溶液与不饱和溶液的相互转化关系。
3.了解溶液结晶的方法。
自学指导一:
阅读课本P33-35
,5分钟后回答下列问题:
1.什么是饱和溶液?什么是不饱和溶液?
2.饱和溶液与不饱和溶液怎样相互转化?
3.溶液中可通过哪些方法得到晶体?
操作
加入5克氯化钠,搅拌
再加入5克氯化钠,搅拌
再加入5ml水,搅拌
现象
结论
全部溶解
部分溶解
剩余的氯化
钠全部溶解
物质溶解受溶剂的量的影响
一.饱和溶液、不饱和溶液
物质能不能无限制地溶解在水中呢?
【实验9-5】室温下,20mL水最多能溶解多少氯化钠?
操作
现象
结论
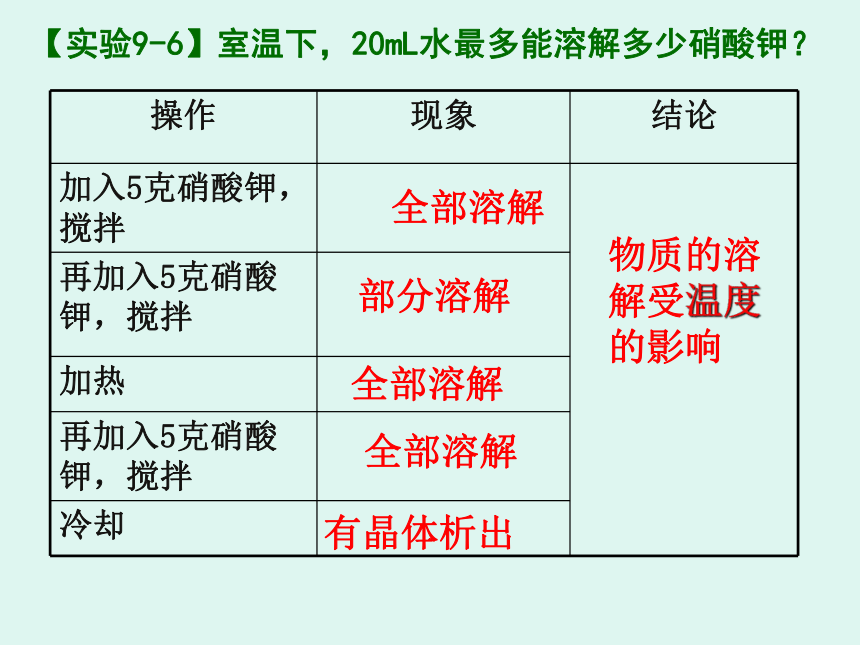
加入5克硝酸钾,搅拌
再加入5克硝酸钾,搅拌
加热
再加入5克硝酸钾,搅拌
冷却
全部溶解
部分溶解
全部溶解
全部溶解
有晶体析出
物质的溶解受温度
的影响
【实验9-6】室温下,20mL水最多能溶解多少硝酸钾?
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液叫做某种溶质饱和溶液。
1、什么叫饱和溶液?
在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时所得到的溶液叫做某种溶质不饱和溶液。
2.什么叫不饱和溶液?
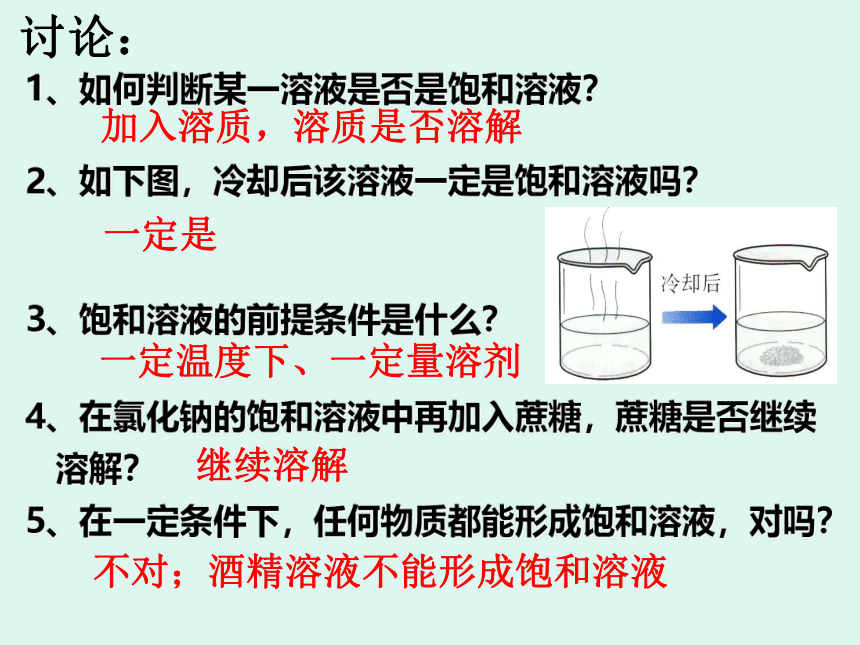
1、如何判断某一溶液是否是饱和溶液?
2、如下图,冷却后该溶液一定是饱和溶液吗?
3、饱和溶液的前提条件是什么?
4、在氯化钠的饱和溶液中再加入蔗糖,蔗糖是否继续
溶解?
5、在一定条件下,任何物质都能形成饱和溶液,对吗?
讨论:
加入溶质,溶质是否溶解
一定是
一定温度下、一定量溶剂
继续溶解
不对;酒精溶液不能形成饱和溶液
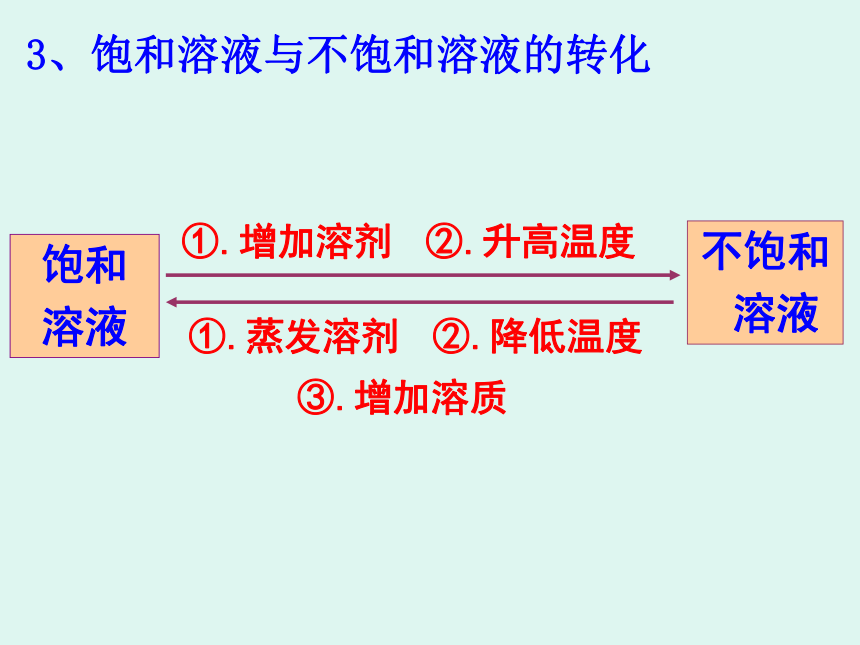
3、饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.升高温度
③.增加溶质
①.蒸发溶剂
②.降低温度
已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
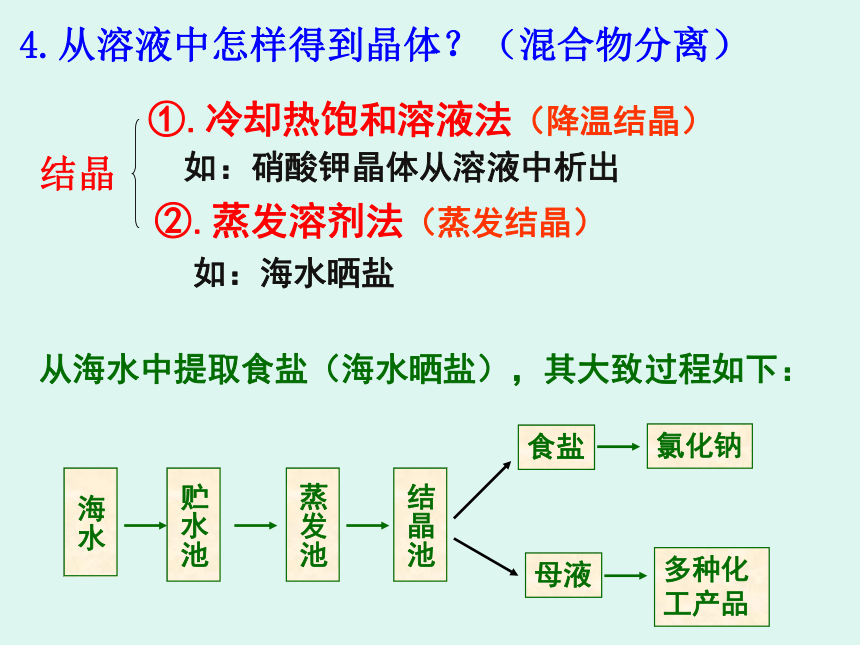
4.从溶液中怎样得到晶体?(混合物分离)
结晶
①.冷却热饱和溶液法(降温结晶)
如:硝酸钾晶体从溶液中析出
②.蒸发溶剂法(蒸发结晶)
如:海水晒盐
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
从海水中提取食盐(海水晒盐),其大致过程如下:
1.在一定
______下,一定量的_______里
_______再继
续溶解某种溶质的溶液叫饱和溶液。
2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施
有:(1)____________;(2)_____________。
温度
溶剂
不能
增加水分
升高温度
当堂练习1
3.要使接近饱和溶液的硝酸钾溶液达到饱和溶液,可采取的措施是:(1)____________;(2)_____________;
(3)______________。
蒸发水分
降低温度
增加硝酸钾
5、20度时,将33克食盐放入100克水中,食盐全部溶解,此时溶液质量为_____克,再向此溶液加入3克食盐又恰好全部溶解,则溶质为______克,现在溶液恰好饱和,此时溶液的质量为_____克,再向此溶液加入3克食盐,溶液的质量是______克。
4、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是(
)
A.溶剂质量减少;
B.溶液质量增大;
C.溶质质量不变;
D.溶质质量增加.
C
133
36
136
136
6、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)___________中盛的一定是饱和溶液;
(2)___________中盛的可能是饱和溶液;
(3)___________中盛的一定是不饱和溶液;
A
B
C
D
A
B
C
D
···
···
···
···
···
·
·
·
……..
……..
……..
1.欲将100g不饱和的KNO3溶液变为饱和溶液.可采用的方法是(
)
①升温
②降温
③蒸发水分
④增加溶质
A
①③
B
②④
C
②③④
D
①②③④
2.某学生在一定的温度下,进行溶解硝酸钾实验,记录的数据如下:
(1)根据上述数据分析,实验1得到的溶液是_________;
(填“饱和”或“不饱和”)溶液。实验3得到的溶液
是
_
溶液。
(2)该温度下100克水中最多溶解硝酸钾的质量是_____。
(3)X的值是
。
所用水的质量
实验序号
加入硝酸钾的质量
所得溶液的质量
1
2
3
4
100g
80g
180g
100g
100g
200g
100g
100g
120g
210g
140g
x
课题2
溶解度
(第二课时)
学习目标
1.理解固体溶解度的涵义。
2.了解溶解度与溶解性的关系。
3.初步学会绘制和查阅溶解度曲线。
自学指导一:
阅读课本P35-36的第一段,2分钟后回答下列问题:
1.什么是溶解度?
溶解度的四要素是什么?
2.溶解性与溶解度的关系怎样?
二、固体溶解度(符合:S)
表示在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
条件:一定温度
标准:100克溶剂
状态:饱和状态
单位:克
3),涵义:20℃时,NaCl的溶解度为36克.
________________________________________________
4)关系:(
m溶质:
m溶剂:
m溶液=
____:
___:____
)
注意:
对于固体物质来说改变溶剂的量不会改变溶解度
1).定义:
2).四要素:
20℃时,100克水溶解36克NaCl,溶液就达到饱和状态
36
100
136
a、
NaCl在10?C和20?C溶解度的是否相同?说明溶解度大小与什么因素有关?
b、
20?C时,NaCl在水中的溶解度和在汽油中的溶解度是否相同?说明溶解度大小与什么因素有关?
c、
20?C时,NaCl和KCl在水中的溶解度是否相同?说明溶解度大小与什么因素有关?
d、在20?C时,
NaCl在100克水和在200克水中的溶解度是否相同?
讨论
5),固体溶解度大小的影响因素:______、_________和_________。与_________无关。
温度
溶剂性质
溶质性质
溶剂的量
判断下列说法是否正确
a、在20?C时,100克水中溶解了23克食盐,则食
盐在20?C时的溶解度为23克。
b、在20?C时,100克饱和溶液中含有溶质23克,
则该物质的溶解度为23克。
c、在100克水中最多能溶解NaCl36克,则氯化钠
的溶解度为36克。
d、在20?C时,在100克水中最多能溶解NaCl36
克,则氯化钠的溶解度为36克。
思考
×
×
×
√
溶解性
易溶
可溶
微溶
难(不)溶
溶解度(20℃/g)
6),溶解度与溶解性的关系:
0.01-1
>10
1-10
<0.01
当堂训练:
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时氢氧化钙的溶解度是0.017g,所以氢氧化钙是______溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于(
)
A.易溶物质
B.可溶物质
C.微溶物质
D.难溶物质
0.01g
10g
1g
难溶
易溶
可溶
微溶
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g
36
2、在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是______g。
13.3
3、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
温度
溶质的质量
溶剂的质量
溶液的质量
20℃
31.6g
100g
131.6g
当堂训练:
自学指导二:
阅读课本P36-38的表9-1和探究:溶解度曲线,5分钟后回答下列问题:
1.根据表格中几种固体物质在不同温度时的
溶解度,你能获取的信息有哪些?
2.学会绘制和查阅溶解度曲线
从表中你能获取的信息有哪些?
1.几种固体物质在不同温度时的溶解度(克)
温度
(°C)
0
10
20
30
40
50
60
70
80
90
100
氯化钠
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
氯化钾
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
56.7
氯化铵
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
71.3
77.3
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
①某一温度时,某一物质的溶解度
②同一温度时,不同物质的溶解度大小比较
③不同温度时,同一物质的溶解度大小比较
④某一物质的溶解度随温度的变化情况
.
.
.
.
0
60
70
808
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(1)列表法:
(2)溶解度曲线:
五、溶解度的表示方法
以温度为横坐标,
溶解度为纵坐标
几种固体物质的溶解度曲线
氢氧化钙的溶解度曲线
观察下列物质的溶解度曲线,仔细分析,回答下列问题:
思考:
固体物质的溶解度随温度的变化有什么规律?
①大部分固体物质的溶解度随温度的升高而增大
例如:硝酸钾(KNO3)
②少数的溶解度受温度的影响很少
例如:氯化钠(NaCl)
③极少数物质的溶解度随温度的升高而减少
例如:熟石灰(Ca(OH)2)
规律:
练习:
根据溶解度曲线比较大小:
①
40℃时KNO3的溶解度_________NaNO3的溶解度
②
40℃时KNO3的溶解度_________50℃时KNO3的溶解度
③
40℃时KNO3的溶解度_________50℃时NaNO3的溶解度
a
同一温度,不同物质的溶解度可比较大小。
b
同一物质,不同温度的溶解度可比较大小。
c
不同温度,不同物质的溶解度不可比较大小。
小于
小于
无法比较
1、将80℃的硝酸钾饱和溶液降温至20℃时,下
列说法不正确的是
(
)
A.溶液中溶质质量不变
B.溶液质量减少
C.溶液中溶质的溶解度减少
D.溶液仍为饱和溶液
2.25℃时50g水最多溶解5gA;60℃时,100g水最多溶解10gB,则比较A,B溶解度大小为(
)
A.不能比较
B.
A=B
C.
A>B
D.
A3、60℃时,硝酸钾的溶解度为110g,则60℃时,将70g硝酸钾放入50g水中充分溶解后所得溶液
质量为(
)
A.105g
B.120g
C.65g
D.110g
A
A
A
当堂训练:
堂堂清:
1.
如图所示,A、B、C三种固体物质的溶解度曲
线示意图,试回答下列问题:
①
a点表示的意义是_____________________。
②
A和C两物质在___℃时溶解度相等为___克。
③
t3℃时,A、B、C三种
固体物质的溶解度由小
到大的顺序为______。
④
溶解度随温度升高而
减小的物质是______。
25
20
15
a
课题2
溶解度
(第三课时)
学习目标
1.根据溶解度曲线理解饱和溶液与不饱和溶
液相互转化的关系。
2.根据溶解度曲线理解降温结晶和蒸发结晶
适合范围。
3.了解气体溶解度与温度、压强的关系。
思考:1.回忆饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.升高温度
③.增加溶质
①.蒸发溶剂
②.降低温度
2.氢氧化钙的饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.降低温度
①.蒸发溶剂
②.升高温度
③.增加溶质
[适用于:溶解度随温度升高而增大的物质]
[适用于:溶解度随温度升高而减小的物质]
3.从溶液中怎样得到晶体?(混合物分离)
结晶
①.冷却热饱和溶液法(降温结晶)
②.蒸发溶剂法(蒸发结晶)
适用:溶解度随温度升高而增大的物质
如
KNO3
适用:溶解度随温度升高变化不大的物质
如
NaCl
如图所示,A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题:
①
a点表示的意义是________________________。
②
A和C两物质在____℃时溶解度相等为____克。
③
t3℃时,A、B、C三种
固体物质的溶解度由小
到大的顺序为_________。
④
溶解度随温度升高而减小
的物质是_______。
⑤
采用降温结晶从溶液中分
离出的物质是_________。
⑥
将C物质的不饱和溶液转化
为饱和溶液应_________。
(升高温度或降低温度)
25
20
15
a
练习:
思考:
怎样分离含有NaCl和KNO3的混合物?
操作步骤:
1.溶解,配成高温下的饱和溶液
2.冷却,析出的晶体主要是KNO3
3.过滤,主要得到KNO3晶体
4.蒸发,主要得到NaCl晶体
方法:冷却热饱和溶液法
自学指导:
阅读课本P38的最后一段,1分钟后回答下列问题:
1.气体的溶解度与什么因素有关系?
2.什么是气体的溶解度?
气体的溶解度与什么有关系呢?回答以下问题找出答案:
(1)打开汽水盖时,汽水会自动喷出来。这说明气体
在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。
这说明气体的溶解度还与什
么有关?
气体的溶解度与温度、压强的关系:
⑴气体溶解度一般随压强增大而增大,压强减小而减小
⑵气体溶解度一般随温度升高而减小,温度降低而增大
压强减小,气体的溶解度减小
温度升高,气体的溶解度减小
三.气体溶解度
气体在压强为101KPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
1.定义:
如:在0℃时,氮气的溶解度为0.024。
(在101KPa和温度为00C时,1体积水里最多能溶解
0.024体积氮气)
2.四要素:
条件:101KPa和一定温度
标准:1体积水
状态:饱和状态
单位:1(省略)
思考:
1.天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
2.深海中CO2气体的溶解度为什么比海面要大?
天气闷热,温度升高,氧气的溶解度减小;
因为深海中的压强比海面大。
1、增大二氧化碳在水中的溶解度的方法(
)
A.
升温增压;
B.
升温减压
C.
降温增压;
D.
降温减压。
当堂训练:
3、将氯化钠和硝酸钾混合物用结晶法分离,对
于滤液来说,下列说法能够成立的是( )
A.滤液中不含硝酸钾
B.滤液中不含氯化钠
C.滤液是硝酸钾不饱和溶液
D.滤液是硝酸钾饱和溶液
C
D
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧
化碳,溶解度随温度的升高而增大的是(
)
A.①②
B.③④
C.①③④
D.只有①
D
4、下图是甲、乙、丙三种物质的溶解度曲线.下列说
法正确的是(
)
A.在t1℃时,三种物质的溶解度由大到小的顺序是甲>
乙>丙
B.在t2℃时,甲、乙两物质的溶解度相等
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不
饱和溶液
D.当乙的饱和溶液中混有少量丙时,可采用降温结晶
的方法析出丙
B
堂堂清:
1、甲、乙两种固体的溶解度曲线
如右图所示。
①
℃时,甲和乙的溶解度相等;
②40℃时,若将30g乙放入50g水
中充分溶解,所得溶液的溶质质量与溶液质量之比
,该溶液是
溶液(填“饱和”或“不饱和”);
③40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体的质量关系是:m(甲)
m(乙)
(填“﹥”、“﹦”或“﹤”)。
课题2
溶解度
(第一课时)
学习目标
1.理解饱和溶液和不饱和溶液。
2.掌握饱和溶液与不饱和溶液的相互转化关系。
3.了解溶液结晶的方法。
自学指导一:
阅读课本P33-35
,5分钟后回答下列问题:
1.什么是饱和溶液?什么是不饱和溶液?
2.饱和溶液与不饱和溶液怎样相互转化?
3.溶液中可通过哪些方法得到晶体?
操作
加入5克氯化钠,搅拌
再加入5克氯化钠,搅拌
再加入5ml水,搅拌
现象
结论
全部溶解
部分溶解
剩余的氯化
钠全部溶解
物质溶解受溶剂的量的影响
一.饱和溶液、不饱和溶液
物质能不能无限制地溶解在水中呢?
【实验9-5】室温下,20mL水最多能溶解多少氯化钠?
操作
现象
结论
加入5克硝酸钾,搅拌
再加入5克硝酸钾,搅拌
加热
再加入5克硝酸钾,搅拌
冷却
全部溶解
部分溶解
全部溶解
全部溶解
有晶体析出
物质的溶解受温度
的影响
【实验9-6】室温下,20mL水最多能溶解多少硝酸钾?
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液叫做某种溶质饱和溶液。
1、什么叫饱和溶液?
在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时所得到的溶液叫做某种溶质不饱和溶液。
2.什么叫不饱和溶液?
1、如何判断某一溶液是否是饱和溶液?
2、如下图,冷却后该溶液一定是饱和溶液吗?
3、饱和溶液的前提条件是什么?
4、在氯化钠的饱和溶液中再加入蔗糖,蔗糖是否继续
溶解?
5、在一定条件下,任何物质都能形成饱和溶液,对吗?
讨论:
加入溶质,溶质是否溶解
一定是
一定温度下、一定量溶剂
继续溶解
不对;酒精溶液不能形成饱和溶液
3、饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.升高温度
③.增加溶质
①.蒸发溶剂
②.降低温度
已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
4.从溶液中怎样得到晶体?(混合物分离)
结晶
①.冷却热饱和溶液法(降温结晶)
如:硝酸钾晶体从溶液中析出
②.蒸发溶剂法(蒸发结晶)
如:海水晒盐
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
从海水中提取食盐(海水晒盐),其大致过程如下:
1.在一定
______下,一定量的_______里
_______再继
续溶解某种溶质的溶液叫饱和溶液。
2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施
有:(1)____________;(2)_____________。
温度
溶剂
不能
增加水分
升高温度
当堂练习1
3.要使接近饱和溶液的硝酸钾溶液达到饱和溶液,可采取的措施是:(1)____________;(2)_____________;
(3)______________。
蒸发水分
降低温度
增加硝酸钾
5、20度时,将33克食盐放入100克水中,食盐全部溶解,此时溶液质量为_____克,再向此溶液加入3克食盐又恰好全部溶解,则溶质为______克,现在溶液恰好饱和,此时溶液的质量为_____克,再向此溶液加入3克食盐,溶液的质量是______克。
4、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是(
)
A.溶剂质量减少;
B.溶液质量增大;
C.溶质质量不变;
D.溶质质量增加.
C
133
36
136
136
6、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)___________中盛的一定是饱和溶液;
(2)___________中盛的可能是饱和溶液;
(3)___________中盛的一定是不饱和溶液;
A
B
C
D
A
B
C
D
···
···
···
···
···
·
·
·
……..
……..
……..
1.欲将100g不饱和的KNO3溶液变为饱和溶液.可采用的方法是(
)
①升温
②降温
③蒸发水分
④增加溶质
A
①③
B
②④
C
②③④
D
①②③④
2.某学生在一定的温度下,进行溶解硝酸钾实验,记录的数据如下:
(1)根据上述数据分析,实验1得到的溶液是_________;
(填“饱和”或“不饱和”)溶液。实验3得到的溶液
是
_
溶液。
(2)该温度下100克水中最多溶解硝酸钾的质量是_____。
(3)X的值是
。
所用水的质量
实验序号
加入硝酸钾的质量
所得溶液的质量
1
2
3
4
100g
80g
180g
100g
100g
200g
100g
100g
120g
210g
140g
x
课题2
溶解度
(第二课时)
学习目标
1.理解固体溶解度的涵义。
2.了解溶解度与溶解性的关系。
3.初步学会绘制和查阅溶解度曲线。
自学指导一:
阅读课本P35-36的第一段,2分钟后回答下列问题:
1.什么是溶解度?
溶解度的四要素是什么?
2.溶解性与溶解度的关系怎样?
二、固体溶解度(符合:S)
表示在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
条件:一定温度
标准:100克溶剂
状态:饱和状态
单位:克
3),涵义:20℃时,NaCl的溶解度为36克.
________________________________________________
4)关系:(
m溶质:
m溶剂:
m溶液=
____:
___:____
)
注意:
对于固体物质来说改变溶剂的量不会改变溶解度
1).定义:
2).四要素:
20℃时,100克水溶解36克NaCl,溶液就达到饱和状态
36
100
136
a、
NaCl在10?C和20?C溶解度的是否相同?说明溶解度大小与什么因素有关?
b、
20?C时,NaCl在水中的溶解度和在汽油中的溶解度是否相同?说明溶解度大小与什么因素有关?
c、
20?C时,NaCl和KCl在水中的溶解度是否相同?说明溶解度大小与什么因素有关?
d、在20?C时,
NaCl在100克水和在200克水中的溶解度是否相同?
讨论
5),固体溶解度大小的影响因素:______、_________和_________。与_________无关。
温度
溶剂性质
溶质性质
溶剂的量
判断下列说法是否正确
a、在20?C时,100克水中溶解了23克食盐,则食
盐在20?C时的溶解度为23克。
b、在20?C时,100克饱和溶液中含有溶质23克,
则该物质的溶解度为23克。
c、在100克水中最多能溶解NaCl36克,则氯化钠
的溶解度为36克。
d、在20?C时,在100克水中最多能溶解NaCl36
克,则氯化钠的溶解度为36克。
思考
×
×
×
√
溶解性
易溶
可溶
微溶
难(不)溶
溶解度(20℃/g)
6),溶解度与溶解性的关系:
0.01-1
>10
1-10
<0.01
当堂训练:
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时氢氧化钙的溶解度是0.017g,所以氢氧化钙是______溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于(
)
A.易溶物质
B.可溶物质
C.微溶物质
D.难溶物质
0.01g
10g
1g
难溶
易溶
可溶
微溶
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g
36
2、在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是______g。
13.3
3、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
温度
溶质的质量
溶剂的质量
溶液的质量
20℃
31.6g
100g
131.6g
当堂训练:
自学指导二:
阅读课本P36-38的表9-1和探究:溶解度曲线,5分钟后回答下列问题:
1.根据表格中几种固体物质在不同温度时的
溶解度,你能获取的信息有哪些?
2.学会绘制和查阅溶解度曲线
从表中你能获取的信息有哪些?
1.几种固体物质在不同温度时的溶解度(克)
温度
(°C)
0
10
20
30
40
50
60
70
80
90
100
氯化钠
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
氯化钾
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
56.7
氯化铵
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
71.3
77.3
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
①某一温度时,某一物质的溶解度
②同一温度时,不同物质的溶解度大小比较
③不同温度时,同一物质的溶解度大小比较
④某一物质的溶解度随温度的变化情况
.
.
.
.
0
60
70
808
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(1)列表法:
(2)溶解度曲线:
五、溶解度的表示方法
以温度为横坐标,
溶解度为纵坐标
几种固体物质的溶解度曲线
氢氧化钙的溶解度曲线
观察下列物质的溶解度曲线,仔细分析,回答下列问题:
思考:
固体物质的溶解度随温度的变化有什么规律?
①大部分固体物质的溶解度随温度的升高而增大
例如:硝酸钾(KNO3)
②少数的溶解度受温度的影响很少
例如:氯化钠(NaCl)
③极少数物质的溶解度随温度的升高而减少
例如:熟石灰(Ca(OH)2)
规律:
练习:
根据溶解度曲线比较大小:
①
40℃时KNO3的溶解度_________NaNO3的溶解度
②
40℃时KNO3的溶解度_________50℃时KNO3的溶解度
③
40℃时KNO3的溶解度_________50℃时NaNO3的溶解度
a
同一温度,不同物质的溶解度可比较大小。
b
同一物质,不同温度的溶解度可比较大小。
c
不同温度,不同物质的溶解度不可比较大小。
小于
小于
无法比较
1、将80℃的硝酸钾饱和溶液降温至20℃时,下
列说法不正确的是
(
)
A.溶液中溶质质量不变
B.溶液质量减少
C.溶液中溶质的溶解度减少
D.溶液仍为饱和溶液
2.25℃时50g水最多溶解5gA;60℃时,100g水最多溶解10gB,则比较A,B溶解度大小为(
)
A.不能比较
B.
A=B
C.
A>B
D.
A
质量为(
)
A.105g
B.120g
C.65g
D.110g
A
A
A
当堂训练:
堂堂清:
1.
如图所示,A、B、C三种固体物质的溶解度曲
线示意图,试回答下列问题:
①
a点表示的意义是_____________________。
②
A和C两物质在___℃时溶解度相等为___克。
③
t3℃时,A、B、C三种
固体物质的溶解度由小
到大的顺序为______。
④
溶解度随温度升高而
减小的物质是______。
25
20
15
a
课题2
溶解度
(第三课时)
学习目标
1.根据溶解度曲线理解饱和溶液与不饱和溶
液相互转化的关系。
2.根据溶解度曲线理解降温结晶和蒸发结晶
适合范围。
3.了解气体溶解度与温度、压强的关系。
思考:1.回忆饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.升高温度
③.增加溶质
①.蒸发溶剂
②.降低温度
2.氢氧化钙的饱和溶液与不饱和溶液的转化
饱和
溶液
不饱和
溶液
①.增加溶剂
②.降低温度
①.蒸发溶剂
②.升高温度
③.增加溶质
[适用于:溶解度随温度升高而增大的物质]
[适用于:溶解度随温度升高而减小的物质]
3.从溶液中怎样得到晶体?(混合物分离)
结晶
①.冷却热饱和溶液法(降温结晶)
②.蒸发溶剂法(蒸发结晶)
适用:溶解度随温度升高而增大的物质
如
KNO3
适用:溶解度随温度升高变化不大的物质
如
NaCl
如图所示,A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题:
①
a点表示的意义是________________________。
②
A和C两物质在____℃时溶解度相等为____克。
③
t3℃时,A、B、C三种
固体物质的溶解度由小
到大的顺序为_________。
④
溶解度随温度升高而减小
的物质是_______。
⑤
采用降温结晶从溶液中分
离出的物质是_________。
⑥
将C物质的不饱和溶液转化
为饱和溶液应_________。
(升高温度或降低温度)
25
20
15
a
练习:
思考:
怎样分离含有NaCl和KNO3的混合物?
操作步骤:
1.溶解,配成高温下的饱和溶液
2.冷却,析出的晶体主要是KNO3
3.过滤,主要得到KNO3晶体
4.蒸发,主要得到NaCl晶体
方法:冷却热饱和溶液法
自学指导:
阅读课本P38的最后一段,1分钟后回答下列问题:
1.气体的溶解度与什么因素有关系?
2.什么是气体的溶解度?
气体的溶解度与什么有关系呢?回答以下问题找出答案:
(1)打开汽水盖时,汽水会自动喷出来。这说明气体
在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。
这说明气体的溶解度还与什
么有关?
气体的溶解度与温度、压强的关系:
⑴气体溶解度一般随压强增大而增大,压强减小而减小
⑵气体溶解度一般随温度升高而减小,温度降低而增大
压强减小,气体的溶解度减小
温度升高,气体的溶解度减小
三.气体溶解度
气体在压强为101KPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
1.定义:
如:在0℃时,氮气的溶解度为0.024。
(在101KPa和温度为00C时,1体积水里最多能溶解
0.024体积氮气)
2.四要素:
条件:101KPa和一定温度
标准:1体积水
状态:饱和状态
单位:1(省略)
思考:
1.天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
2.深海中CO2气体的溶解度为什么比海面要大?
天气闷热,温度升高,氧气的溶解度减小;
因为深海中的压强比海面大。
1、增大二氧化碳在水中的溶解度的方法(
)
A.
升温增压;
B.
升温减压
C.
降温增压;
D.
降温减压。
当堂训练:
3、将氯化钠和硝酸钾混合物用结晶法分离,对
于滤液来说,下列说法能够成立的是( )
A.滤液中不含硝酸钾
B.滤液中不含氯化钠
C.滤液是硝酸钾不饱和溶液
D.滤液是硝酸钾饱和溶液
C
D
2.下列几种物质①硝酸钾②熟石灰③氧气④二氧
化碳,溶解度随温度的升高而增大的是(
)
A.①②
B.③④
C.①③④
D.只有①
D
4、下图是甲、乙、丙三种物质的溶解度曲线.下列说
法正确的是(
)
A.在t1℃时,三种物质的溶解度由大到小的顺序是甲>
乙>丙
B.在t2℃时,甲、乙两物质的溶解度相等
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不
饱和溶液
D.当乙的饱和溶液中混有少量丙时,可采用降温结晶
的方法析出丙
B
堂堂清:
1、甲、乙两种固体的溶解度曲线
如右图所示。
①
℃时,甲和乙的溶解度相等;
②40℃时,若将30g乙放入50g水
中充分溶解,所得溶液的溶质质量与溶液质量之比
,该溶液是
溶液(填“饱和”或“不饱和”);
③40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体的质量关系是:m(甲)
m(乙)
(填“﹥”、“﹦”或“﹤”)。
同课章节目录
