人教版九年级下册化学《11.1 生活中常见的盐》课件(43张PPT)
文档属性
| 名称 | 人教版九年级下册化学《11.1 生活中常见的盐》课件(43张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-10 23:28:56 | ||
图片预览











文档简介
(共43张PPT)
课题1
生活中常见的盐
(第一课时)
课前复习:
1.下列物质哪些是酸、碱、盐?
①HCl、
②Ca(OH)2、
③NaCl、
④H2SO4、
⑤NH4NO3、⑥Na2CO3、
⑦NaOH、
⑧NaHCO3
酸_________;碱_________;盐__________。
①④
②⑦
③⑤⑥⑧
学习目标
1.了解生活中的盐和化学中的盐的关系
2.了解食盐的主要用途、粗盐初步提纯的步骤
3.
了解碳酸钠、碳酸氢钠、碳酸钙的物理性质
和用途
自学指导1
阅读课本72-73页第一段,2分钟后回答:
1、了解生活中的盐和化学中的盐的关系?
2、记住一些常见的盐及其俗称:
3、食盐有哪些用途?
4、粗盐怎样得到初步提纯?
1.什么叫盐?
化学中的盐与生活中的盐是同种物质吗?
工业用盐:
亚硝酸钠(NaNO2)外形、味道与食盐相似,有毒,
能导致癌症,其水溶液显碱性。
思考:
怎样区别亚硝酸钠与氯化钠?
化学中的盐:______________________________________
生活中的盐:______________________________________
指一类含有金属离子和酸根离子的化合物
通常指食盐(主要成分NaCl)
2.说出下列盐的俗称:
碳酸钠(Na2CO3)______________
碳酸氢钠(NaHCO3)_____________
碳酸钙(CaCO3)________________
高锰酸钾(KMnO4)______________
氯化钠(NaCl)_____________
纯碱、苏打
小苏打
大理石、石灰石
灰锰氧、PP粉
食盐
3.氯化钠有哪些用途?
①配制生理盐水(0.9﹪NaCl溶液);
②用NaCl溶液来选种;
③调味、腌渍;
④消除马路积雪;
⑤化工原料:制取Na2CO3、
NaOH、Cl2、HCl等。
氯
化
钠
的
分
布
海盐
湖盐
岩盐
井盐
4、粗盐初步提纯的步骤:
粗盐→______→______→_______→_______
→_______→精盐
溶解
沉淀
过滤
蒸发
结晶
自学指导2
阅读课本73页第二段,2分钟后
回答:
比较碳酸钠、碳酸氢钠、碳酸钙的化学式、俗称、物理性质和用途
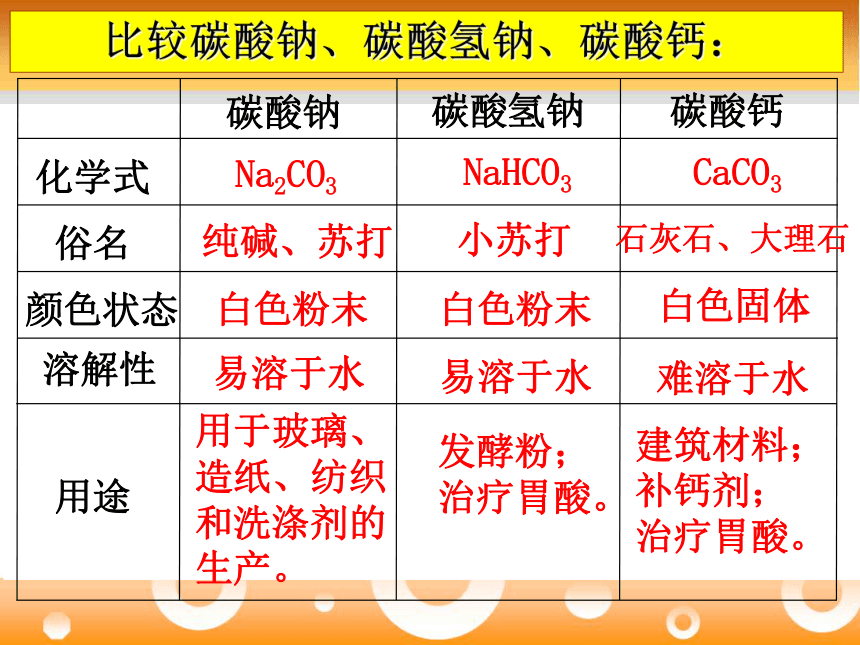
比较碳酸钠、碳酸氢钠、碳酸钙:
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗名
颜色状态
溶解性
用途
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
石灰石、大理石
白色粉末
白色粉末
白色固体
易溶于水
易溶于水
难溶于水
用于玻璃、造纸、纺织和洗涤剂的生产。
发酵粉;
治疗胃酸。
建筑材料;
补钙剂;
治疗胃酸。
1.下列各组物质名称不代表同一物质的一组
是(
)
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2.下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
当堂练习:
A
C
课题1
生活中常见的盐
(第二课时)
学习目标
学习重点
CO32-(HCO3-)的检验方法
1、掌握几种常见盐的化学性质
2、掌握检验CO32-(HCO3-)的方法
3、了解侯德榜、石笋和钟乳石的形成
自学指导1
阅读课本73-74页的内容,2分钟后:
1、掌握Na2CO3、NaHCO3分别与盐酸反应的现象
及化学方程式。
2、掌握检验CO32-、HCO3-的检验方法。
【回顾】
请书写出实验室制取CO2的方程式。
____________________________
【讨论】
比较碳酸钙与碳酸钠、碳酸氢钠的组成,
推断碳酸钠与碳酸氢钠是否也能发生上述反应。
CaCO3+2HCl=CaCl2+H2O+CO2↑
碳酸钠、碳酸氢钠与盐酸反应:
现象
分析
碳酸钠+盐酸
碳酸氢钠+盐酸
[实验]
11-1:
反应方程式:___________________________
_______________________________
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
反应更剧烈,产生气泡,澄清的石灰水变浑浊。
反应剧烈,产生气泡,澄清的石灰水变浑浊。
产生CO2
产生CO2
CO32-、HCO3-的检验方法
1、检验依据:组成里含有CO32-或HCO3-的盐都能
与盐酸反应,生成二氧化碳气体。
2、检验试剂:______________________
3、检验方法:
稀盐酸、澄清的石灰水
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清的石灰水中
澄清的石灰水变浑浊
该样品是碳酸
盐(碳酸氢盐)
思考:
设计一个实验,证明鸡蛋壳的主要成分是碳酸钙?
将鸡蛋壳捣碎,放入试管中,再加入稀
HCl,产生气体,将气体通入澄清的石灰水中,
若澄清的石灰水变浑浊,证明鸡蛋壳中含有
碳酸钙。
碳酸钠溶液与氢氧化钙溶液反应:
[实验]
11-2:向盛有少量的碳酸钠溶液的试管中加入澄清的石灰水,观察并分析现象。
现象
分析
溶液变浑浊
生成不溶于水的碳酸钙沉淀
有关反应的化学方程式:
________________________________________
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(纯碱制烧碱)
讨论:
1.某化工厂以纯碱、石灰石、水为原料怎样制取烧碱?(用化学反应表示)
①
CaCO3
CaO+CO2↑
高温
②
CaO+H2O
==
Ca(OH)2
③
Na2CO3+Ca(OH)2
==
CaCO3↓+2NaOH
硫酸铜(CuSO4):
1.物理性质:白色固体,易溶于水,溶液显蓝色。
2.作用:检验水(遇水变蓝色)
3.硫酸铜晶体:CuSO4·5H2O
(蓝色)
1.将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的(
)。
A.Cl-
B.CO32-
C.SO42-
D.OH-
2.用下列物质:a食盐;
b纯碱;
c碳酸氢钠;
d碳酸钙
填空
①可用作洗涤剂的是(填序号,下同)______;
②可用作调味剂的_______;
③可用作补钙剂和牙膏填充剂的是_______;
④可用于生产玻璃的是_______;
⑤可用作发酵粉和治疗胃酸过多症的是______。
当堂练习:
B
b
a
d
b
c
自学指导3
阅读课本76页和77页的资料卡片,1分钟后:
1、了解侯德榜其人其事
2、了解石笋和钟乳石的形成
资料
侯德榜,中国化学家,“联合制碱法”(又称侯氏
制碱法)的创始人。是在中国化学工业史上一位杰出的
科学家,他为祖国的化学工业事业奋斗终生,并以独创
的制碱工艺闻名于世界,他就像一块坚硬的基石,托起
了中国现代化学工业的大厦,这位先驱者就是被称为
“国宝”的侯德榜。[“碱”指纯碱(Na2CO3)]
侯德榜
联合制碱法反应分三步进行:
①
NH3+H2O+CO2
=
NH4HCO3
②
NH4HCO3+NaCl
=
NH4Cl+NaHCO3↓
③
2NaHCO3
=
Na2CO3+H2O+CO2↑
Δ
张家界黄龙洞风景
石灰石和石灰岩地区的溶洞和钟乳石:
1.溶洞的形成:
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙[Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
“滴水穿石”
2.钟乳石、石笋和石柱的形成:
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O“水滴石长”
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱
资料
1.在日常生活中常用做调味剂和防腐剂的是[
]
A.纯碱
B.酒精
C.食盐
D.醋酸
2.下列物质溶于水,其溶液呈蓝色的是[
]
A.食盐 B.蔗糖
C.硫酸铜 D.氢氧化钠
3.在制碱法方面,做出杰出贡献的科学家是[
]
A.侯德榜
B.拉瓦锡
C.道尔顿
D.汤姆生
4.某学生为检验草木灰的主要成分是K2CO3,所选
试剂是[
]
A.石灰水
B.水
C.稀盐酸和石灰水
D.稀盐酸
3.用H、Na、C、O四种元素,写出组成下列物质的
化学式(只写一种):
①金属氧化物______;②非金属氧化物_______;
③酸_______;
④碱_______;
⑤盐________.
堂堂清:
(第三课时)
复分解反应
课前复习:
1.写出下列反应的化学方程式:
①
CuO+HCl-
②
Na2CO3+Ca(OH)2-
③
NaHCO3+HCl-
④
CaCO3+HCl-
2.观察:上述几个反应物和生成物有什么特点?
学习目标
学习重点
确书写复分解反应的化学方程式
1、理解复分解反应的定义
2、掌握复分解反应发生的条件
3、能正确书写复分解反应的化学方程式
自学指导1
阅读课本74最后一段至75页,
2分钟后回答:
1、什么叫复分解反应?
2、发生复分解反应要满足什么条件?
3、正确书写复分解反应的化学方程式
1.什么是复分解反应?(四种基本反应类型之一)
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
AB
+
CD
→
AD
+
CB
(两交换、价不变)
3.怎样书写复分解反应的化学方程式?
2.表达式:
例:CuO
+
HCl
1、交换位置:
2、定化学式(根据化合价):
复分解反应的化学方程式书写
3、配平:
CuO
+
HCl
CuCl
+
H
O
CuO
+
HCl
CuCl2
+
H2O
CuO
+
2HCl
CuCl2
+
H2O
1.下列反应属于复分解反应的是(
)
A.CO2+H2O=H2CO3
B.Ca(OH)2+CO2=CaCO3↓+H2O
C.K2CO3+2HCl=2KCl+H2O+CO2↑
D.Zn+H2SO4=ZnSO4+H2↑
2.完成下列复分解反应:
(1)
CuO
+
H2SO4─
(2)
Fe(OH)3
+
HCl─
(3)
NaOH
+
HNO3─
(4)
Na2CO3
+
HCl
─
(5)
Al2O3
+
H2SO4─
当堂训练:
C
3.复分解反应发生需要什么条件?
实验11-3:
讨论:
1.上述反应是否属于复分解反应?有什么共同之处?
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=
2Na2SO4+Cu(OH)2↓
CuSO4+BaCl2=
BaSO4↓+CuCl2
是;都产生沉淀
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
反应方程式
2.酸碱中和反应是否属于复分解反应?相同的
生成物是什么?
如:2KOH+H2SO4=K2SO4+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
3.Na2CO3、CaCO3等碳酸盐与盐酸是否属于复分
解反应反应?共同的现象是什么?
如:Na2CO3+2HCl=2NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
是;都产生水
是;都产生气体
复分解反应发生的条件:
酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有_____或有_____或有_____生成时(至少满足上述条件之一),复分解反应才可以发生。
沉淀
气体
水
注意:当碱和盐,盐和盐均可溶时,复分解
反应才可以发生。
钾钠铵硝溶水快,
Mg
Al
Fe
Cu碱不溶,
BaSO4,AgCl不溶酸来不溶水
溶酸不溶水的是BaCO3
CaCO3
碱和盐溶解性记忆口诀:
K__、Na__、NH4__
、
__NO3
Mg(OH)2↓、Al(OH)3↓、
Fe(OH)3↓
Fe(OH)2↓
Cu(OH)2↓
当堂训练2
下列物质间能否发生复分解反应?若能,写出反应的化学方程式
1.硫酸和硝酸钠溶液
2.氢氧化钠溶液和硝酸
3.硫酸钠溶液和氯化钡溶液
4.硝酸和碳酸钾
5.硝酸钾溶液和氢氧化钠溶液
不能,因为交换成分后,无沉淀、气体、水生成
不能,因为交换成分后,无沉淀、气体、水生成
能,NaOH+HNO3=NaNO3+H2O
能,Na2SO4+BaCl2=
2NaCl+BaSO4↓
能,2HNO3+K2CO3=2KNO3+H2O+CO2↑
NaOH
NaCl
K2CO3
Ba(NO3)2
H2SO4
判断
依据
当堂训练3
判断下列四种化合物的溶液两两之间是否能发生反应。
能
能
能
不能
交换成分后,有水生成
交换成分后,有沉淀生成
交换成分后,有气体生成
交换成分后,
没有沉淀、
气体、水生成
盐的化学性质
①盐与金属反应:________________________
②盐与酸反应:___________________________
③盐与碱反应:__________________________
④盐与盐反应:__________________________
反应物盐和碱
必须溶于水
反应物盐和盐
必须溶于水
例:Fe
+
CuSO4
=
Cu
+
FeSO4
例:HCl
+
AgNO3
=
HNO3
+
AgCl↓
例:2KOH
+
CuCl2
=
Cu(OH)2↓
+
2KCl
例:Ba(NO3)2
+
Na2SO4
=
2NaNO3
+
BaSO4↓
金属
+
盐
=
金属
+
盐
酸
+
盐
=
酸
+
盐
碱
+
盐
=
碱
+
盐
盐
+
盐
=
盐
+
盐
堂堂清:
1.根据复分解反应填空:
(1)
_____
+
HCl
=
MgCl2
+
______
(2)
BaCl2
+
______
=
BaSO4↓
+
______
(3)
______
+
_____
=
CuCl2
+
H2O
(4)
CuSO4
+
Ba(OH)2
=______
+
______
2.写出下列复分解反应:
①Ba(OH)2+H2SO4=
②KCl+AgNO3=
3.一次性鉴别硝酸钡、碳酸钠、稀盐酸三种无
色的溶液:
(1)甲同学选用了一种指示剂,是
。
(2)乙同学选用了一种酸溶液,是
。
(3)丙同学选用了一种钾盐溶液,是
。
课题1
生活中常见的盐
(第一课时)
课前复习:
1.下列物质哪些是酸、碱、盐?
①HCl、
②Ca(OH)2、
③NaCl、
④H2SO4、
⑤NH4NO3、⑥Na2CO3、
⑦NaOH、
⑧NaHCO3
酸_________;碱_________;盐__________。
①④
②⑦
③⑤⑥⑧
学习目标
1.了解生活中的盐和化学中的盐的关系
2.了解食盐的主要用途、粗盐初步提纯的步骤
3.
了解碳酸钠、碳酸氢钠、碳酸钙的物理性质
和用途
自学指导1
阅读课本72-73页第一段,2分钟后回答:
1、了解生活中的盐和化学中的盐的关系?
2、记住一些常见的盐及其俗称:
3、食盐有哪些用途?
4、粗盐怎样得到初步提纯?
1.什么叫盐?
化学中的盐与生活中的盐是同种物质吗?
工业用盐:
亚硝酸钠(NaNO2)外形、味道与食盐相似,有毒,
能导致癌症,其水溶液显碱性。
思考:
怎样区别亚硝酸钠与氯化钠?
化学中的盐:______________________________________
生活中的盐:______________________________________
指一类含有金属离子和酸根离子的化合物
通常指食盐(主要成分NaCl)
2.说出下列盐的俗称:
碳酸钠(Na2CO3)______________
碳酸氢钠(NaHCO3)_____________
碳酸钙(CaCO3)________________
高锰酸钾(KMnO4)______________
氯化钠(NaCl)_____________
纯碱、苏打
小苏打
大理石、石灰石
灰锰氧、PP粉
食盐
3.氯化钠有哪些用途?
①配制生理盐水(0.9﹪NaCl溶液);
②用NaCl溶液来选种;
③调味、腌渍;
④消除马路积雪;
⑤化工原料:制取Na2CO3、
NaOH、Cl2、HCl等。
氯
化
钠
的
分
布
海盐
湖盐
岩盐
井盐
4、粗盐初步提纯的步骤:
粗盐→______→______→_______→_______
→_______→精盐
溶解
沉淀
过滤
蒸发
结晶
自学指导2
阅读课本73页第二段,2分钟后
回答:
比较碳酸钠、碳酸氢钠、碳酸钙的化学式、俗称、物理性质和用途
比较碳酸钠、碳酸氢钠、碳酸钙:
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗名
颜色状态
溶解性
用途
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
石灰石、大理石
白色粉末
白色粉末
白色固体
易溶于水
易溶于水
难溶于水
用于玻璃、造纸、纺织和洗涤剂的生产。
发酵粉;
治疗胃酸。
建筑材料;
补钙剂;
治疗胃酸。
1.下列各组物质名称不代表同一物质的一组
是(
)
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2.下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
当堂练习:
A
C
课题1
生活中常见的盐
(第二课时)
学习目标
学习重点
CO32-(HCO3-)的检验方法
1、掌握几种常见盐的化学性质
2、掌握检验CO32-(HCO3-)的方法
3、了解侯德榜、石笋和钟乳石的形成
自学指导1
阅读课本73-74页的内容,2分钟后:
1、掌握Na2CO3、NaHCO3分别与盐酸反应的现象
及化学方程式。
2、掌握检验CO32-、HCO3-的检验方法。
【回顾】
请书写出实验室制取CO2的方程式。
____________________________
【讨论】
比较碳酸钙与碳酸钠、碳酸氢钠的组成,
推断碳酸钠与碳酸氢钠是否也能发生上述反应。
CaCO3+2HCl=CaCl2+H2O+CO2↑
碳酸钠、碳酸氢钠与盐酸反应:
现象
分析
碳酸钠+盐酸
碳酸氢钠+盐酸
[实验]
11-1:
反应方程式:___________________________
_______________________________
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
反应更剧烈,产生气泡,澄清的石灰水变浑浊。
反应剧烈,产生气泡,澄清的石灰水变浑浊。
产生CO2
产生CO2
CO32-、HCO3-的检验方法
1、检验依据:组成里含有CO32-或HCO3-的盐都能
与盐酸反应,生成二氧化碳气体。
2、检验试剂:______________________
3、检验方法:
稀盐酸、澄清的石灰水
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清的石灰水中
澄清的石灰水变浑浊
该样品是碳酸
盐(碳酸氢盐)
思考:
设计一个实验,证明鸡蛋壳的主要成分是碳酸钙?
将鸡蛋壳捣碎,放入试管中,再加入稀
HCl,产生气体,将气体通入澄清的石灰水中,
若澄清的石灰水变浑浊,证明鸡蛋壳中含有
碳酸钙。
碳酸钠溶液与氢氧化钙溶液反应:
[实验]
11-2:向盛有少量的碳酸钠溶液的试管中加入澄清的石灰水,观察并分析现象。
现象
分析
溶液变浑浊
生成不溶于水的碳酸钙沉淀
有关反应的化学方程式:
________________________________________
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(纯碱制烧碱)
讨论:
1.某化工厂以纯碱、石灰石、水为原料怎样制取烧碱?(用化学反应表示)
①
CaCO3
CaO+CO2↑
高温
②
CaO+H2O
==
Ca(OH)2
③
Na2CO3+Ca(OH)2
==
CaCO3↓+2NaOH
硫酸铜(CuSO4):
1.物理性质:白色固体,易溶于水,溶液显蓝色。
2.作用:检验水(遇水变蓝色)
3.硫酸铜晶体:CuSO4·5H2O
(蓝色)
1.将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的(
)。
A.Cl-
B.CO32-
C.SO42-
D.OH-
2.用下列物质:a食盐;
b纯碱;
c碳酸氢钠;
d碳酸钙
填空
①可用作洗涤剂的是(填序号,下同)______;
②可用作调味剂的_______;
③可用作补钙剂和牙膏填充剂的是_______;
④可用于生产玻璃的是_______;
⑤可用作发酵粉和治疗胃酸过多症的是______。
当堂练习:
B
b
a
d
b
c
自学指导3
阅读课本76页和77页的资料卡片,1分钟后:
1、了解侯德榜其人其事
2、了解石笋和钟乳石的形成
资料
侯德榜,中国化学家,“联合制碱法”(又称侯氏
制碱法)的创始人。是在中国化学工业史上一位杰出的
科学家,他为祖国的化学工业事业奋斗终生,并以独创
的制碱工艺闻名于世界,他就像一块坚硬的基石,托起
了中国现代化学工业的大厦,这位先驱者就是被称为
“国宝”的侯德榜。[“碱”指纯碱(Na2CO3)]
侯德榜
联合制碱法反应分三步进行:
①
NH3+H2O+CO2
=
NH4HCO3
②
NH4HCO3+NaCl
=
NH4Cl+NaHCO3↓
③
2NaHCO3
=
Na2CO3+H2O+CO2↑
Δ
张家界黄龙洞风景
石灰石和石灰岩地区的溶洞和钟乳石:
1.溶洞的形成:
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙[Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
“滴水穿石”
2.钟乳石、石笋和石柱的形成:
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O“水滴石长”
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱
资料
1.在日常生活中常用做调味剂和防腐剂的是[
]
A.纯碱
B.酒精
C.食盐
D.醋酸
2.下列物质溶于水,其溶液呈蓝色的是[
]
A.食盐 B.蔗糖
C.硫酸铜 D.氢氧化钠
3.在制碱法方面,做出杰出贡献的科学家是[
]
A.侯德榜
B.拉瓦锡
C.道尔顿
D.汤姆生
4.某学生为检验草木灰的主要成分是K2CO3,所选
试剂是[
]
A.石灰水
B.水
C.稀盐酸和石灰水
D.稀盐酸
3.用H、Na、C、O四种元素,写出组成下列物质的
化学式(只写一种):
①金属氧化物______;②非金属氧化物_______;
③酸_______;
④碱_______;
⑤盐________.
堂堂清:
(第三课时)
复分解反应
课前复习:
1.写出下列反应的化学方程式:
①
CuO+HCl-
②
Na2CO3+Ca(OH)2-
③
NaHCO3+HCl-
④
CaCO3+HCl-
2.观察:上述几个反应物和生成物有什么特点?
学习目标
学习重点
确书写复分解反应的化学方程式
1、理解复分解反应的定义
2、掌握复分解反应发生的条件
3、能正确书写复分解反应的化学方程式
自学指导1
阅读课本74最后一段至75页,
2分钟后回答:
1、什么叫复分解反应?
2、发生复分解反应要满足什么条件?
3、正确书写复分解反应的化学方程式
1.什么是复分解反应?(四种基本反应类型之一)
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
AB
+
CD
→
AD
+
CB
(两交换、价不变)
3.怎样书写复分解反应的化学方程式?
2.表达式:
例:CuO
+
HCl
1、交换位置:
2、定化学式(根据化合价):
复分解反应的化学方程式书写
3、配平:
CuO
+
HCl
CuCl
+
H
O
CuO
+
HCl
CuCl2
+
H2O
CuO
+
2HCl
CuCl2
+
H2O
1.下列反应属于复分解反应的是(
)
A.CO2+H2O=H2CO3
B.Ca(OH)2+CO2=CaCO3↓+H2O
C.K2CO3+2HCl=2KCl+H2O+CO2↑
D.Zn+H2SO4=ZnSO4+H2↑
2.完成下列复分解反应:
(1)
CuO
+
H2SO4─
(2)
Fe(OH)3
+
HCl─
(3)
NaOH
+
HNO3─
(4)
Na2CO3
+
HCl
─
(5)
Al2O3
+
H2SO4─
当堂训练:
C
3.复分解反应发生需要什么条件?
实验11-3:
讨论:
1.上述反应是否属于复分解反应?有什么共同之处?
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=
2Na2SO4+Cu(OH)2↓
CuSO4+BaCl2=
BaSO4↓+CuCl2
是;都产生沉淀
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
反应方程式
2.酸碱中和反应是否属于复分解反应?相同的
生成物是什么?
如:2KOH+H2SO4=K2SO4+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
3.Na2CO3、CaCO3等碳酸盐与盐酸是否属于复分
解反应反应?共同的现象是什么?
如:Na2CO3+2HCl=2NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
是;都产生水
是;都产生气体
复分解反应发生的条件:
酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有_____或有_____或有_____生成时(至少满足上述条件之一),复分解反应才可以发生。
沉淀
气体
水
注意:当碱和盐,盐和盐均可溶时,复分解
反应才可以发生。
钾钠铵硝溶水快,
Mg
Al
Fe
Cu碱不溶,
BaSO4,AgCl不溶酸来不溶水
溶酸不溶水的是BaCO3
CaCO3
碱和盐溶解性记忆口诀:
K__、Na__、NH4__
、
__NO3
Mg(OH)2↓、Al(OH)3↓、
Fe(OH)3↓
Fe(OH)2↓
Cu(OH)2↓
当堂训练2
下列物质间能否发生复分解反应?若能,写出反应的化学方程式
1.硫酸和硝酸钠溶液
2.氢氧化钠溶液和硝酸
3.硫酸钠溶液和氯化钡溶液
4.硝酸和碳酸钾
5.硝酸钾溶液和氢氧化钠溶液
不能,因为交换成分后,无沉淀、气体、水生成
不能,因为交换成分后,无沉淀、气体、水生成
能,NaOH+HNO3=NaNO3+H2O
能,Na2SO4+BaCl2=
2NaCl+BaSO4↓
能,2HNO3+K2CO3=2KNO3+H2O+CO2↑
NaOH
NaCl
K2CO3
Ba(NO3)2
H2SO4
判断
依据
当堂训练3
判断下列四种化合物的溶液两两之间是否能发生反应。
能
能
能
不能
交换成分后,有水生成
交换成分后,有沉淀生成
交换成分后,有气体生成
交换成分后,
没有沉淀、
气体、水生成
盐的化学性质
①盐与金属反应:________________________
②盐与酸反应:___________________________
③盐与碱反应:__________________________
④盐与盐反应:__________________________
反应物盐和碱
必须溶于水
反应物盐和盐
必须溶于水
例:Fe
+
CuSO4
=
Cu
+
FeSO4
例:HCl
+
AgNO3
=
HNO3
+
AgCl↓
例:2KOH
+
CuCl2
=
Cu(OH)2↓
+
2KCl
例:Ba(NO3)2
+
Na2SO4
=
2NaNO3
+
BaSO4↓
金属
+
盐
=
金属
+
盐
酸
+
盐
=
酸
+
盐
碱
+
盐
=
碱
+
盐
盐
+
盐
=
盐
+
盐
堂堂清:
1.根据复分解反应填空:
(1)
_____
+
HCl
=
MgCl2
+
______
(2)
BaCl2
+
______
=
BaSO4↓
+
______
(3)
______
+
_____
=
CuCl2
+
H2O
(4)
CuSO4
+
Ba(OH)2
=______
+
______
2.写出下列复分解反应:
①Ba(OH)2+H2SO4=
②KCl+AgNO3=
3.一次性鉴别硝酸钡、碳酸钠、稀盐酸三种无
色的溶液:
(1)甲同学选用了一种指示剂,是
。
(2)乙同学选用了一种酸溶液,是
。
(3)丙同学选用了一种钾盐溶液,是
。
同课章节目录
