第七单元 常见的酸和碱单元复习训练(34张PPT)
文档属性
| 名称 | 第七单元 常见的酸和碱单元复习训练(34张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-11 11:09:34 | ||
图片预览








文档简介
单元复习训练
鲁教版·九年级化学下册
知识回顾
一. 酸及其性质
1.浓盐酸是___色,有_______气味。打开浓盐酸的瓶盖,在瓶口会看到_______,说明浓盐酸具有______性。
刺激性
白雾
挥发
无
酸的物理性质
2.浓硫酸是 色、黏稠状液体,不易挥发。浓H2SO4具有的特性:
①吸水性,常做 ;
②腐蚀性,能使木材、纸张等 而变黑;
③溶于水放出大量的热,所以稀释浓H2SO4的操作应
。
无
干燥剂
炭化
把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
酸的化学性质
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
5.能与部分盐反应,生成新的酸和新的盐。
4.能与某些碱反应,生成盐和水;
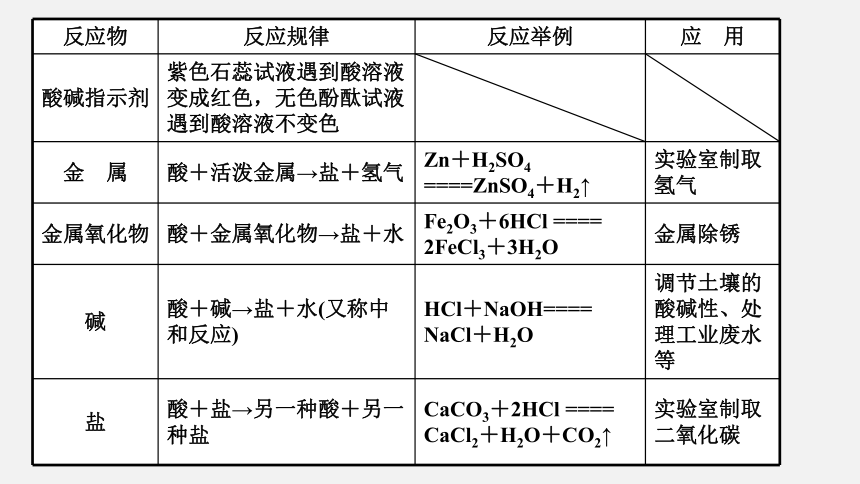
反应物
反应规律
反应举例
应 用
酸碱指示剂
紫色石蕊试液遇到酸溶液变成红色,无色酚酞试液遇到酸溶液不变色
金 属
酸+活泼金属→盐+氢气
Zn+H2SO4 ====ZnSO4+H2↑
实验室制取氢气
金属氧化物
酸+金属氧化物→盐+水
Fe2O3+6HCl ==== 2FeCl3+3H2O
金属除锈
碱
酸+碱→盐+水(又称中和反应)
HCl+NaOH==== NaCl+H2O
调节土壤的酸碱性、处理工业废水等
盐
酸+盐→另一种酸+另一种盐
CaCO3+2HCl ==== CaCl2+H2O+CO2↑
实验室制取二氧化碳
二. 碱及其性质
常见的碱
1.氢氧化钠(NaOH):
(1)俗称为“烧碱”、“火碱”、“苛性钠”,白色块状或片状固体。
(2)溶解性:氢氧化钠易溶于水,溶解时放热。
(3)氢氧化钠固体具有强烈的吸水性,可做干燥剂。
(4)氢氧化钠固体暴露在空气中,易吸收空气中的水份而潮解;氢氧化钠固体和溶液,暴露在空气中,易吸收空气中的二氧化碳而变质。所以氢氧化钠要密封保存。
(5)氢氧化钠具有强烈的腐蚀性。氢氧化钠能溶解蛋白质和油脂;氢氧化钠还能腐蚀玻璃,盛装氢氧化钠的试剂瓶要用橡皮塞。
(6)由于氢氧化钠固体易潮解和具有强烈的腐蚀性,所以称量氢氧化钠固体时,要在玻璃容器中称量。
2.氢氧化钙(Ca(OH)2):
(1)俗称为“熟石灰”、“消石灰”,为白色粉末。
(2)溶解性:氢氧化钙微溶于水,溶解度随温度的升高而降低。氢氧化钙溶液俗称为“石灰水”。
(3)氢氧化钙易吸收空气中的二氧化碳而变质。
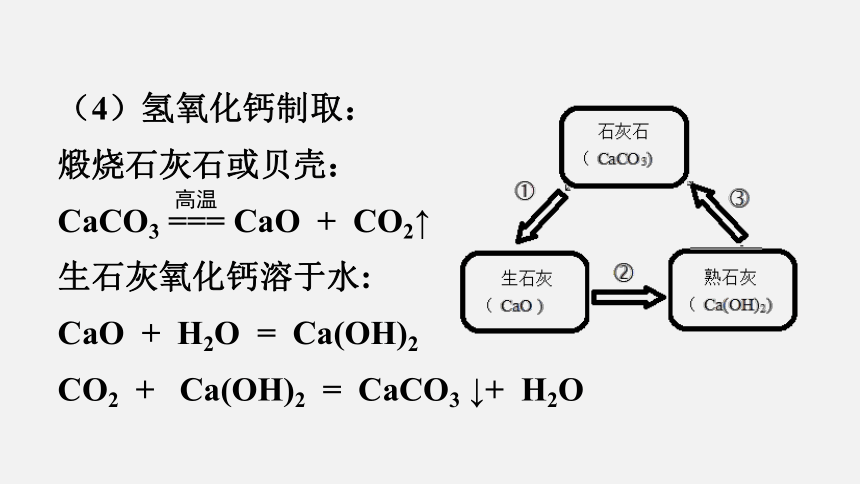
(4)氢氧化钙制取:
煅烧石灰石或贝壳:
CaCO3 === CaO + CO2↑
生石灰氧化钙溶于水:
CaO + H2O = Ca(OH)2
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
高温
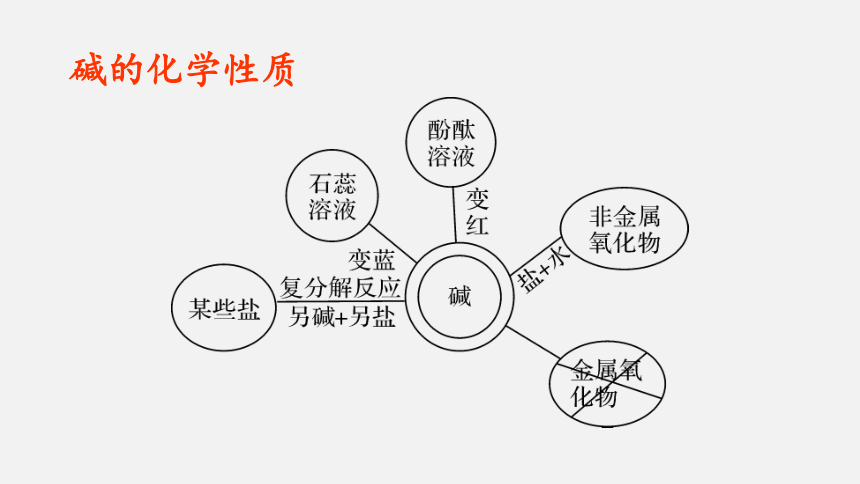
碱的化学性质
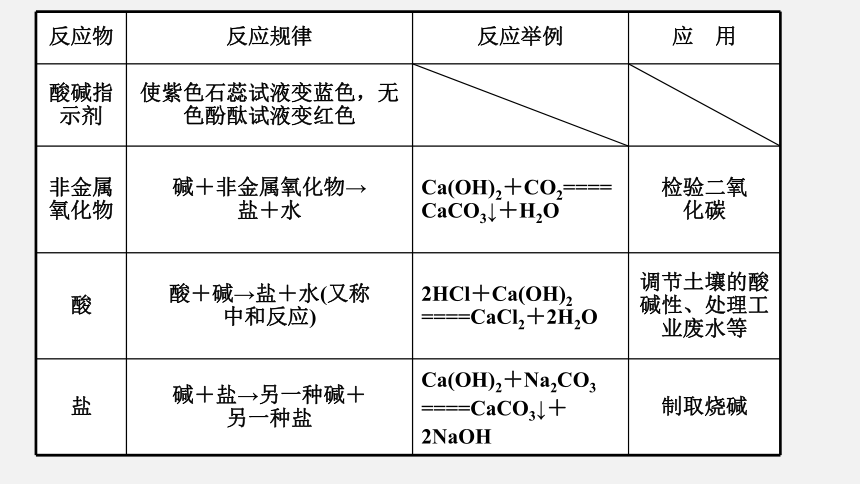
反应物
反应规律
反应举例
应 用
酸碱指
示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
非金属
氧化物
碱+非金属氧化物→
盐+水
Ca(OH)2+CO2==== CaCO3↓+H2O
检验二氧
化碳
酸
酸+碱→盐+水(又称
中和反应)
2HCl+Ca(OH)2 ====CaCl2+2H2O
调节土壤的酸碱性、处理工业废水等
盐
碱+盐→另一种碱+
另一种盐
Ca(OH)2+Na2CO3 ====CaCO3↓+2NaOH
制取烧碱
三. 溶液的酸碱性
溶液酸碱性的检验
1. 酸碱指示剂
(1)酸碱指示剂:能检验溶液酸碱性的试液。常用的酸碱指示剂有石蕊和酚酞。
(2)紫色石蕊试液遇酸变红,遇碱变蓝,中性不变色仍为紫色;
无色酚酞试液遇酸和中性不变色仍为无色,遇碱变为红色。
规律总结:
(1)酸碱指示剂跟酸或碱溶液反应时是酸或碱使指示剂显示不同的颜色,而不是指示剂使酸碱溶液变色。
(2)指示剂颜色的变化,只能说明被测溶液显酸性或碱性而不能确定此溶液一定是酸溶液或碱溶液。如Na2CO3溶液显碱性,(NH4)2SO4溶液显酸性,二者既不是酸溶液也不是碱溶液。
①溶液变色是酸碱指示剂变色,而不是酸或碱变色;②不是所有的酸或碱都能使酸碱指示剂变色。只有溶解后能电离出H+(或OH-)的酸或碱的溶液,才能使酸碱指示剂变色;不溶性酸或碱,不能使酸碱指示剂变色。
注意
2.石蕊试纸
蓝色石蕊试纸专用于检测酸性溶液(遇酸变红)
红色石蕊试纸专用于检测碱性溶液(遇碱变蓝)。
注意:①不能将石蕊试纸直接浸入待测液中测量。否则,会污染待测液;②测试前,不能用蒸馏水将石蕊试纸润湿,否则,所测得溶液的酸碱性要偏弱。
当pH=7时,溶液呈____性;当pH<7时,溶液呈_
____性,且pH越小,__________;当pH>7时,溶液呈____性,且pH越大,__________。
中
酸
酸性越强
碱
碱性越强
酸碱度
溶液酸碱性的强弱程度(用pH表示)
溶液酸碱性或pH的变化
基本规律:向酸性或碱性溶液中,加入另一种溶液,混合后,溶液pH最终要接近所加入的溶液的pH。
酸碱性对生命活动和农作物的生长的影响
1.人的健康与体内某些液体正常的pH密不可分。
2.农作物的正常生长需要中性的土壤环境。
四. 酸碱中和反应
酸与碱作用生成盐和水的反应。
中和反应
酸 + 碱 = 盐 + 水
NaOH+HCl=NaCl+H2O
注意:(1)中和反应的实质:酸解离出的H+与碱解离出的OH-结合生成水,H++OH-=H2O;
(2)中和反应的反应物是酸与碱;
(3)有盐和水生成的反应不一定是中和反应:
CO2+ Ca(OH)2 = CaCO3↓+ H2O;
(4)中和反应要放热;
(5)中和反应属于复分解反应。
盐
金属阳离子和酸根阴离子构成的化合物。
(1)盐可以看作是酸与碱中和作用的产物。
(2)命名:盐一般命名为“X酸X”,盐酸盐(含Cl-)命名为“氯化X”。
(3)分类:依据阴离子或阳离子种类:碳酸盐、钠盐等。
(4)常见的有色的盐溶液
蓝色溶液(含Cu2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液
浅绿色溶液(含Fe2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
黄色溶液(含Fe3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液
紫红色溶液:高锰酸钾溶液
中和反应的应用
(1)用于医药卫生:胃酸分泌过多,可以服用含有氢氧化铝等碱性物质的药物,中和过多的胃酸。
(2)改变土壤的酸碱性:向土壤中加入酸性或碱性物质,把土壤的pH控制在最适宜庄稼生长的范围内。常用熟石灰(氢氧化钙:Ca(OH)2)改良酸性土壤。
(3)处理工业废水:常用熟石灰处理污水中超标的酸。当酸泄露污染土壤时,最好使用过量的石灰石粉末来处理。如果加入过量的熟石灰处理,会让土壤显碱性。
(4)调节溶液的酸碱性:可以用适当的酸或碱来调节溶液的pH。如操作不慎,无色酚酞试液中混有了氢氧化钠溶液,无色酚酞试液变成了红色。则可以向酚酞试液中滴入适当的稀盐酸至红色恰好褪去。
随堂练习
1.物质的性质决定其保存方法。固体氢氧化钠具有以下性质:
①白色固体,②有腐蚀性,③易吸收水分,④能与空气中的二氧化碳反应。
由此可知,氢氧化钠固体必须密封保存的主要原因是( )
A.①② B.②③ C.①③ D.③④
D
2.打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
D
3.下列溶液中pH最大的是( )
A.10% KOH B.20% KOH
C.10% HCl D.20% HCl
【解析】碱的浓度越大,其pH越大。
B
4.小科看到妈妈炒的一盘紫色高丽菜(一种紫色的卷心菜)的菜汁呈紫色,后来因为掺了醋变成了红色,在洗盘子时遇到碱性洗涤剂变成黄绿色。下列也能使紫色高丽菜汁呈现黄绿色的物质是( )
A.柠檬汁 B.雪碧
C.食盐水 D.肥皂水
D
5.如图是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学反应方程式。
答案:CO2被浓NaOH溶液吸收,锥形瓶内的气压变小,外界大气压大于锥形瓶内的气压,使气球胀大。
2NaOH+CO2==Na2CO3+H2O
6.某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40 g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量 是多少?
解:设这一定量石油产品中含H2SO4的质量为x。
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
解得x=7.35g
答:这一定量石油产品中含H2SO4的质量为7.35g。
课堂小结
1.本节课学习了什么内容?
2.你有何收获?
课后作业
1.完成教材P26-28 1~ 10 题,
2.完成练习册本课时的习题.
鲁教版·九年级化学下册
知识回顾
一. 酸及其性质
1.浓盐酸是___色,有_______气味。打开浓盐酸的瓶盖,在瓶口会看到_______,说明浓盐酸具有______性。
刺激性
白雾
挥发
无
酸的物理性质
2.浓硫酸是 色、黏稠状液体,不易挥发。浓H2SO4具有的特性:
①吸水性,常做 ;
②腐蚀性,能使木材、纸张等 而变黑;
③溶于水放出大量的热,所以稀释浓H2SO4的操作应
。
无
干燥剂
炭化
把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
酸的化学性质
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
5.能与部分盐反应,生成新的酸和新的盐。
4.能与某些碱反应,生成盐和水;
反应物
反应规律
反应举例
应 用
酸碱指示剂
紫色石蕊试液遇到酸溶液变成红色,无色酚酞试液遇到酸溶液不变色
金 属
酸+活泼金属→盐+氢气
Zn+H2SO4 ====ZnSO4+H2↑
实验室制取氢气
金属氧化物
酸+金属氧化物→盐+水
Fe2O3+6HCl ==== 2FeCl3+3H2O
金属除锈
碱
酸+碱→盐+水(又称中和反应)
HCl+NaOH==== NaCl+H2O
调节土壤的酸碱性、处理工业废水等
盐
酸+盐→另一种酸+另一种盐
CaCO3+2HCl ==== CaCl2+H2O+CO2↑
实验室制取二氧化碳
二. 碱及其性质
常见的碱
1.氢氧化钠(NaOH):
(1)俗称为“烧碱”、“火碱”、“苛性钠”,白色块状或片状固体。
(2)溶解性:氢氧化钠易溶于水,溶解时放热。
(3)氢氧化钠固体具有强烈的吸水性,可做干燥剂。
(4)氢氧化钠固体暴露在空气中,易吸收空气中的水份而潮解;氢氧化钠固体和溶液,暴露在空气中,易吸收空气中的二氧化碳而变质。所以氢氧化钠要密封保存。
(5)氢氧化钠具有强烈的腐蚀性。氢氧化钠能溶解蛋白质和油脂;氢氧化钠还能腐蚀玻璃,盛装氢氧化钠的试剂瓶要用橡皮塞。
(6)由于氢氧化钠固体易潮解和具有强烈的腐蚀性,所以称量氢氧化钠固体时,要在玻璃容器中称量。
2.氢氧化钙(Ca(OH)2):
(1)俗称为“熟石灰”、“消石灰”,为白色粉末。
(2)溶解性:氢氧化钙微溶于水,溶解度随温度的升高而降低。氢氧化钙溶液俗称为“石灰水”。
(3)氢氧化钙易吸收空气中的二氧化碳而变质。
(4)氢氧化钙制取:
煅烧石灰石或贝壳:
CaCO3 === CaO + CO2↑
生石灰氧化钙溶于水:
CaO + H2O = Ca(OH)2
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
高温
碱的化学性质
反应物
反应规律
反应举例
应 用
酸碱指
示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
非金属
氧化物
碱+非金属氧化物→
盐+水
Ca(OH)2+CO2==== CaCO3↓+H2O
检验二氧
化碳
酸
酸+碱→盐+水(又称
中和反应)
2HCl+Ca(OH)2 ====CaCl2+2H2O
调节土壤的酸碱性、处理工业废水等
盐
碱+盐→另一种碱+
另一种盐
Ca(OH)2+Na2CO3 ====CaCO3↓+2NaOH
制取烧碱
三. 溶液的酸碱性
溶液酸碱性的检验
1. 酸碱指示剂
(1)酸碱指示剂:能检验溶液酸碱性的试液。常用的酸碱指示剂有石蕊和酚酞。
(2)紫色石蕊试液遇酸变红,遇碱变蓝,中性不变色仍为紫色;
无色酚酞试液遇酸和中性不变色仍为无色,遇碱变为红色。
规律总结:
(1)酸碱指示剂跟酸或碱溶液反应时是酸或碱使指示剂显示不同的颜色,而不是指示剂使酸碱溶液变色。
(2)指示剂颜色的变化,只能说明被测溶液显酸性或碱性而不能确定此溶液一定是酸溶液或碱溶液。如Na2CO3溶液显碱性,(NH4)2SO4溶液显酸性,二者既不是酸溶液也不是碱溶液。
①溶液变色是酸碱指示剂变色,而不是酸或碱变色;②不是所有的酸或碱都能使酸碱指示剂变色。只有溶解后能电离出H+(或OH-)的酸或碱的溶液,才能使酸碱指示剂变色;不溶性酸或碱,不能使酸碱指示剂变色。
注意
2.石蕊试纸
蓝色石蕊试纸专用于检测酸性溶液(遇酸变红)
红色石蕊试纸专用于检测碱性溶液(遇碱变蓝)。
注意:①不能将石蕊试纸直接浸入待测液中测量。否则,会污染待测液;②测试前,不能用蒸馏水将石蕊试纸润湿,否则,所测得溶液的酸碱性要偏弱。
当pH=7时,溶液呈____性;当pH<7时,溶液呈_
____性,且pH越小,__________;当pH>7时,溶液呈____性,且pH越大,__________。
中
酸
酸性越强
碱
碱性越强
酸碱度
溶液酸碱性的强弱程度(用pH表示)
溶液酸碱性或pH的变化
基本规律:向酸性或碱性溶液中,加入另一种溶液,混合后,溶液pH最终要接近所加入的溶液的pH。
酸碱性对生命活动和农作物的生长的影响
1.人的健康与体内某些液体正常的pH密不可分。
2.农作物的正常生长需要中性的土壤环境。
四. 酸碱中和反应
酸与碱作用生成盐和水的反应。
中和反应
酸 + 碱 = 盐 + 水
NaOH+HCl=NaCl+H2O
注意:(1)中和反应的实质:酸解离出的H+与碱解离出的OH-结合生成水,H++OH-=H2O;
(2)中和反应的反应物是酸与碱;
(3)有盐和水生成的反应不一定是中和反应:
CO2+ Ca(OH)2 = CaCO3↓+ H2O;
(4)中和反应要放热;
(5)中和反应属于复分解反应。
盐
金属阳离子和酸根阴离子构成的化合物。
(1)盐可以看作是酸与碱中和作用的产物。
(2)命名:盐一般命名为“X酸X”,盐酸盐(含Cl-)命名为“氯化X”。
(3)分类:依据阴离子或阳离子种类:碳酸盐、钠盐等。
(4)常见的有色的盐溶液
蓝色溶液(含Cu2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液
浅绿色溶液(含Fe2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
黄色溶液(含Fe3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液
紫红色溶液:高锰酸钾溶液
中和反应的应用
(1)用于医药卫生:胃酸分泌过多,可以服用含有氢氧化铝等碱性物质的药物,中和过多的胃酸。
(2)改变土壤的酸碱性:向土壤中加入酸性或碱性物质,把土壤的pH控制在最适宜庄稼生长的范围内。常用熟石灰(氢氧化钙:Ca(OH)2)改良酸性土壤。
(3)处理工业废水:常用熟石灰处理污水中超标的酸。当酸泄露污染土壤时,最好使用过量的石灰石粉末来处理。如果加入过量的熟石灰处理,会让土壤显碱性。
(4)调节溶液的酸碱性:可以用适当的酸或碱来调节溶液的pH。如操作不慎,无色酚酞试液中混有了氢氧化钠溶液,无色酚酞试液变成了红色。则可以向酚酞试液中滴入适当的稀盐酸至红色恰好褪去。
随堂练习
1.物质的性质决定其保存方法。固体氢氧化钠具有以下性质:
①白色固体,②有腐蚀性,③易吸收水分,④能与空气中的二氧化碳反应。
由此可知,氢氧化钠固体必须密封保存的主要原因是( )
A.①② B.②③ C.①③ D.③④
D
2.打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
D
3.下列溶液中pH最大的是( )
A.10% KOH B.20% KOH
C.10% HCl D.20% HCl
【解析】碱的浓度越大,其pH越大。
B
4.小科看到妈妈炒的一盘紫色高丽菜(一种紫色的卷心菜)的菜汁呈紫色,后来因为掺了醋变成了红色,在洗盘子时遇到碱性洗涤剂变成黄绿色。下列也能使紫色高丽菜汁呈现黄绿色的物质是( )
A.柠檬汁 B.雪碧
C.食盐水 D.肥皂水
D
5.如图是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学反应方程式。
答案:CO2被浓NaOH溶液吸收,锥形瓶内的气压变小,外界大气压大于锥形瓶内的气压,使气球胀大。
2NaOH+CO2==Na2CO3+H2O
6.某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40 g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量 是多少?
解:设这一定量石油产品中含H2SO4的质量为x。
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
解得x=7.35g
答:这一定量石油产品中含H2SO4的质量为7.35g。
课堂小结
1.本节课学习了什么内容?
2.你有何收获?
课后作业
1.完成教材P26-28 1~ 10 题,
2.完成练习册本课时的习题.
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
