人教版化学高中必修一4.1《无机非金属材料的主角—硅》(26张PPT)
文档属性
| 名称 | 人教版化学高中必修一4.1《无机非金属材料的主角—硅》(26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-11 23:03:50 | ||
图片预览







文档简介
(共41张PPT)
一、硅的分布与存在
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
元素周期表中,第ⅣA族元素包括,碳、硅、锗、锡、铅,称为碳族元素。
存在形式:硅有晶体硅和无定形硅两种。
晶体硅是灰黑色、有金属光泽、硬而脆的固体。晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
导电性介于导体和绝缘体之间。
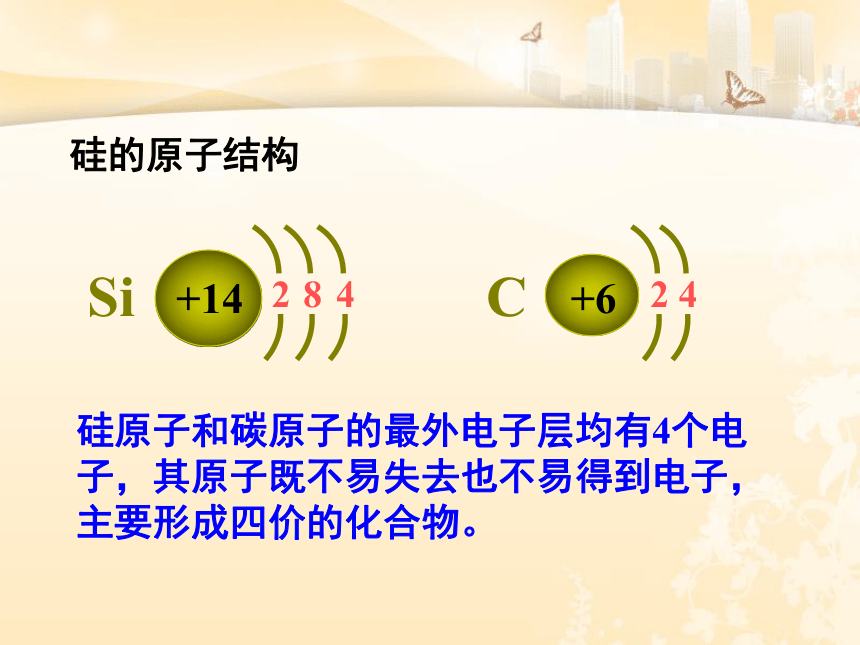
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
Si
+14
8
4
2
+6
4
2
C
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
Si+O2
SiO2
1、硅单质的化学性质
Si
+
2Cl2
====
SiCl4
工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到
SiCl4后再用氢气还原制得纯硅:
2、硅的工业制备
SiO2+2C=Si(粗)+2CO↑
①
高温
SiCl4+2H2=Si(纯)+4HCl
③
高温
Si(粗)+2Cl2=SiCl4
②
(1)反应①中焦炭做(
)
A.还原剂
B.氧化剂
C.二者都不是
(2)反应
②属于(
),反应③
属于(
)
A.化合反应
B.分解反应
C.氧化还原反应
D.非氧化还原反应
E.置换反应
A
AC
CE
SiO2+2C=Si(粗)+2CO↑
①
Si(粗)+2Cl2=SiCl4
②
SiCl4+2H2=Si(纯)+4HCl
③
危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。
二、二氧化硅和硅酸
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
1、二氧化硅
石英
紫水晶
黄水晶
晶体二氧化硅
Si
O
SiO2是由Si和O按1:2的比例组成的立体空间网状结构,没有SiO2
分子存在,只存在硅氧原子。因此性质很稳定。
⑴SiO2化学性质很不活泼,氢氟酸(
HF)是唯一可以与之反应的酸。
SiO2+4HF=SiF4?+2H2O
注意:玻璃中含有SiO2,所以可以用HF来刻蚀玻璃。
⑵酸性氧化物
与碱性氧化物反应生成盐
SiO2+
CaO
===
CaSiO3
高温
与强碱反应生成盐和水
SiO2
+
2NaOH
===
Na2SiO3
+H2O
硅酸钠(粘合性)
因为玻璃中含有SiO2,会与NaOH反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。
⑶与盐反应
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3
+SiO2
===
CaSiO3
+
CO2↑
高温
高温
⑷弱氧化性
SiO2
+
2C
=====
Si
+
2CO↑
高温
性
质
二氧化碳(CO2)
二氧化硅(SiO2)
SiO2与CO2化学性质的比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
SiO2+
CaO
==
CaSiO3
高温
——
——
SiO2
+
4HF=SiF4↑
+
2H2O
酸性氧化物
与碱性氧化物反应
与碱反应
与水反应
与氢氟酸反应
Na2CO3+SiO2
==Na2SiO3+CO2↑
CaCO3
+SiO2
==
CaSiO3
+
CO2↑
高温
高温
Na2CO3+H2O+CO2===2NaHCO3
CaCO3
+H2O+CO2
===Ca(HCO3)2
与盐反应
2、硅酸(
)
H2SiO3
制取原理:强酸制弱酸
现
象
结
论
方程式
离子方程式
①滴入酚酞溶液呈红色
Na2SiO3+2HCl
=
H2SiO3(胶体)+2NaCl
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
SiO32-
+
2H+
==
H2SiO3
(胶体)
a、Na2SiO3溶液呈碱性,b、可溶性
硅酸盐与盐酸反应生成不溶于水的硅酸,
c、先形成硅酸溶胶,后形成硅酸凝胶
硅酸是一种白色粉末状的固体,它不溶于水;是一种很弱的酸,不能使指示剂变色。
硅酸钠水溶液久置在空气中会出现什么现象?
硅酸钠水溶液久置在空气中会出现白色浑浊。
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
常温下,
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
说明H2CO3的酸性强于H2SiO3
;
在高温下,
Na2CO3+SiO2===Na2SiO3+CO2↑
说明H2SiO3酸性强于H2CO3。
高温
H2SiO3
+
2NaOH
==
Na2SiO3
+
2H2O
②不稳定(比H2CO3稳定),受热易分解
?
H2SiO3
====
H2O
+
SiO2
①弱酸性。只能与强碱发生中和反应
1、定义:
硅酸盐是由硅、氧和金属组成的化合物的总称
2、性质:
硅酸盐种类很多,是一大类结构复杂的固态物质,
大多数不溶于水,化学性质很稳定。
3、表示方法:
(1)化学式法:
适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。
三、硅酸盐
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:
Na2SiO3
Na2O·SiO2
硅酸钙:
CaSiO3
CaO·SiO2
高岭石:Al2(Si2O5)(OH)4
Al2O3·2SiO2·2H2O
正长石:KAlSi3O8不能写
K2O·Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2
(2)氧化物法:
K2O·2Al2O3·6SiO2·H2O
K(Al2Si3O9)(OH)
4、最简单的硅酸盐---硅酸钠(Na2SiO3)
硅酸钠是白色固体,可溶于水,其水溶液俗称水玻璃。是制备硅胶和木材防火剂等的原料。
(1)硅酸钠的物理性质
(2)硅酸钠化学性质
硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。
②与盐反应
①与酸反应
Na2SiO3
+
2HCl
=2NaCl
+
H2SiO3↓
CaCl2+Na2SiO3=CaSiO3+2NaCl
四、硅酸盐工业
⑴水泥
普通硅酸盐水泥的成分
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2)
铝酸三钙(3CaO·Al2O3)
水泥具有水硬性。
⑵玻璃
普通玻璃的成分
Na2SiO3、CaSiO3和SiO2组成的混合物。
或Na2O·CaO·6SiO2;
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3
+SiO2===CaSiO3
+
CO2↑
高温
高温
⑶陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
练习:
1.下列说法正确的是(
)
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
B
2.硅酸钠溶液俗称水玻璃,呈碱性.下列物质中,能用带磨口玻璃塞的试剂瓶盛放的是(
)
A.浓硫酸
B.水玻璃
C.氢氟酸
D
苛性碱
A
3.下列物质中能跟SiO2发生反应的是(
)
A
盐酸
B
硝酸
C
硫酸
D
烧碱溶液
D
4.光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是(
)
A
铜
B
钢
C
石英
D
铝
C
5.除去二氧化硅固体中混有的CaCO3固体,方法正确的是(
)
A
加水,过滤
B
加热
C
加盐酸,过滤
D
加NaOH溶液,过滤
C
6.将过量的CO2分别通入(1)CaCl2溶液(2)Na2SiO3溶液(3)Ca(ClO)2溶液(4)饱和Na2CO3溶液.最终溶液中有白色沉淀的是(
)
A
(1)(2)(3)(4)
B(2)(4)
C(1)
(2)(3)
D(2)(3)
B
一、硅的分布与存在
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
元素周期表中,第ⅣA族元素包括,碳、硅、锗、锡、铅,称为碳族元素。
存在形式:硅有晶体硅和无定形硅两种。
晶体硅是灰黑色、有金属光泽、硬而脆的固体。晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
导电性介于导体和绝缘体之间。
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
Si
+14
8
4
2
+6
4
2
C
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
Si+O2
SiO2
1、硅单质的化学性质
Si
+
2Cl2
====
SiCl4
工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到
SiCl4后再用氢气还原制得纯硅:
2、硅的工业制备
SiO2+2C=Si(粗)+2CO↑
①
高温
SiCl4+2H2=Si(纯)+4HCl
③
高温
Si(粗)+2Cl2=SiCl4
②
(1)反应①中焦炭做(
)
A.还原剂
B.氧化剂
C.二者都不是
(2)反应
②属于(
),反应③
属于(
)
A.化合反应
B.分解反应
C.氧化还原反应
D.非氧化还原反应
E.置换反应
A
AC
CE
SiO2+2C=Si(粗)+2CO↑
①
Si(粗)+2Cl2=SiCl4
②
SiCl4+2H2=Si(纯)+4HCl
③
危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。
二、二氧化硅和硅酸
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
1、二氧化硅
石英
紫水晶
黄水晶
晶体二氧化硅
Si
O
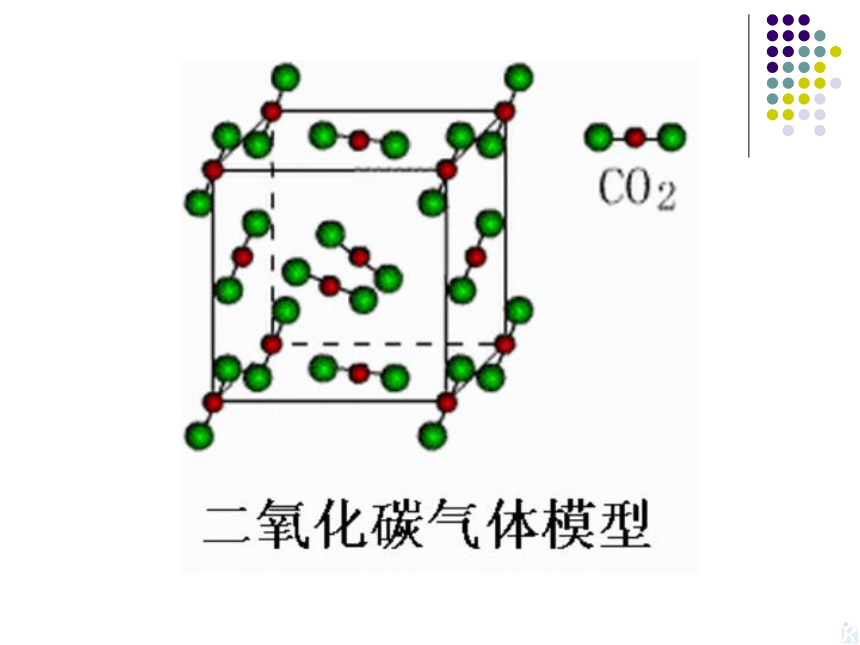
SiO2是由Si和O按1:2的比例组成的立体空间网状结构,没有SiO2
分子存在,只存在硅氧原子。因此性质很稳定。
⑴SiO2化学性质很不活泼,氢氟酸(
HF)是唯一可以与之反应的酸。
SiO2+4HF=SiF4?+2H2O
注意:玻璃中含有SiO2,所以可以用HF来刻蚀玻璃。
⑵酸性氧化物
与碱性氧化物反应生成盐
SiO2+
CaO
===
CaSiO3
高温
与强碱反应生成盐和水
SiO2
+
2NaOH
===
Na2SiO3
+H2O
硅酸钠(粘合性)
因为玻璃中含有SiO2,会与NaOH反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。
⑶与盐反应
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3
+SiO2
===
CaSiO3
+
CO2↑
高温
高温
⑷弱氧化性
SiO2
+
2C
=====
Si
+
2CO↑
高温
性
质
二氧化碳(CO2)
二氧化硅(SiO2)
SiO2与CO2化学性质的比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
SiO2+
CaO
==
CaSiO3
高温
——
——
SiO2
+
4HF=SiF4↑
+
2H2O
酸性氧化物
与碱性氧化物反应
与碱反应
与水反应
与氢氟酸反应
Na2CO3+SiO2
==Na2SiO3+CO2↑
CaCO3
+SiO2
==
CaSiO3
+
CO2↑
高温
高温
Na2CO3+H2O+CO2===2NaHCO3
CaCO3
+H2O+CO2
===Ca(HCO3)2
与盐反应
2、硅酸(
)
H2SiO3
制取原理:强酸制弱酸
现
象
结
论
方程式
离子方程式
①滴入酚酞溶液呈红色
Na2SiO3+2HCl
=
H2SiO3(胶体)+2NaCl
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
SiO32-
+
2H+
==
H2SiO3
(胶体)
a、Na2SiO3溶液呈碱性,b、可溶性
硅酸盐与盐酸反应生成不溶于水的硅酸,
c、先形成硅酸溶胶,后形成硅酸凝胶
硅酸是一种白色粉末状的固体,它不溶于水;是一种很弱的酸,不能使指示剂变色。
硅酸钠水溶液久置在空气中会出现什么现象?
硅酸钠水溶液久置在空气中会出现白色浑浊。
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
常温下,
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
说明H2CO3的酸性强于H2SiO3
;
在高温下,
Na2CO3+SiO2===Na2SiO3+CO2↑
说明H2SiO3酸性强于H2CO3。
高温
H2SiO3
+
2NaOH
==
Na2SiO3
+
2H2O
②不稳定(比H2CO3稳定),受热易分解
?
H2SiO3
====
H2O
+
SiO2
①弱酸性。只能与强碱发生中和反应
1、定义:
硅酸盐是由硅、氧和金属组成的化合物的总称
2、性质:
硅酸盐种类很多,是一大类结构复杂的固态物质,
大多数不溶于水,化学性质很稳定。
3、表示方法:
(1)化学式法:
适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。
三、硅酸盐
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:
Na2SiO3
Na2O·SiO2
硅酸钙:
CaSiO3
CaO·SiO2
高岭石:Al2(Si2O5)(OH)4
Al2O3·2SiO2·2H2O
正长石:KAlSi3O8不能写
K2O·Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2
(2)氧化物法:
K2O·2Al2O3·6SiO2·H2O
K(Al2Si3O9)(OH)
4、最简单的硅酸盐---硅酸钠(Na2SiO3)
硅酸钠是白色固体,可溶于水,其水溶液俗称水玻璃。是制备硅胶和木材防火剂等的原料。
(1)硅酸钠的物理性质
(2)硅酸钠化学性质
硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。
②与盐反应
①与酸反应
Na2SiO3
+
2HCl
=2NaCl
+
H2SiO3↓
CaCl2+Na2SiO3=CaSiO3+2NaCl
四、硅酸盐工业
⑴水泥
普通硅酸盐水泥的成分
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2)
铝酸三钙(3CaO·Al2O3)
水泥具有水硬性。
⑵玻璃
普通玻璃的成分
Na2SiO3、CaSiO3和SiO2组成的混合物。
或Na2O·CaO·6SiO2;
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3
+SiO2===CaSiO3
+
CO2↑
高温
高温
⑶陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
练习:
1.下列说法正确的是(
)
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
B
2.硅酸钠溶液俗称水玻璃,呈碱性.下列物质中,能用带磨口玻璃塞的试剂瓶盛放的是(
)
A.浓硫酸
B.水玻璃
C.氢氟酸
D
苛性碱
A
3.下列物质中能跟SiO2发生反应的是(
)
A
盐酸
B
硝酸
C
硫酸
D
烧碱溶液
D
4.光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是(
)
A
铜
B
钢
C
石英
D
铝
C
5.除去二氧化硅固体中混有的CaCO3固体,方法正确的是(
)
A
加水,过滤
B
加热
C
加盐酸,过滤
D
加NaOH溶液,过滤
C
6.将过量的CO2分别通入(1)CaCl2溶液(2)Na2SiO3溶液(3)Ca(ClO)2溶液(4)饱和Na2CO3溶液.最终溶液中有白色沉淀的是(
)
A
(1)(2)(3)(4)
B(2)(4)
C(1)
(2)(3)
D(2)(3)
B
