高中化学必修2课件:《第3章 有机化合物》课件(共57 张PPT)
文档属性
| 名称 | 高中化学必修2课件:《第3章 有机化合物》课件(共57 张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-12 20:17:05 | ||
图片预览






文档简介
第三章 有机化合物
有 机 物
一、什么叫有机物?
1.定义:
2.组成元素:
一般含有碳元素的化合物为有机物。
碳、氢、氧、氮、硫、磷、卤素等
( 但碳的氧化物(CO、CO2)、碳酸及其盐 、碳的金属化合物(CaC2)等看作无机物。)
主要元素
其他元素
有机物
无机物
溶解性
多数不溶于水,一般易溶于有机溶剂
多数溶于水,而不溶于有机溶剂
耐热性
多数不耐热,固体熔点低,一般在400℃以下
多数耐热、难熔化,熔点一般较高
可燃性
多数可燃烧
多数不可燃烧
导电性
多数为非电解质,难电离,不导电
多数是电解质,溶液或熔融状态下可导电
反应特点
一般复杂、副反应多,速率较慢,方程式用箭号表示
一般简单,副反应少,速率较快,方程式用等号表示
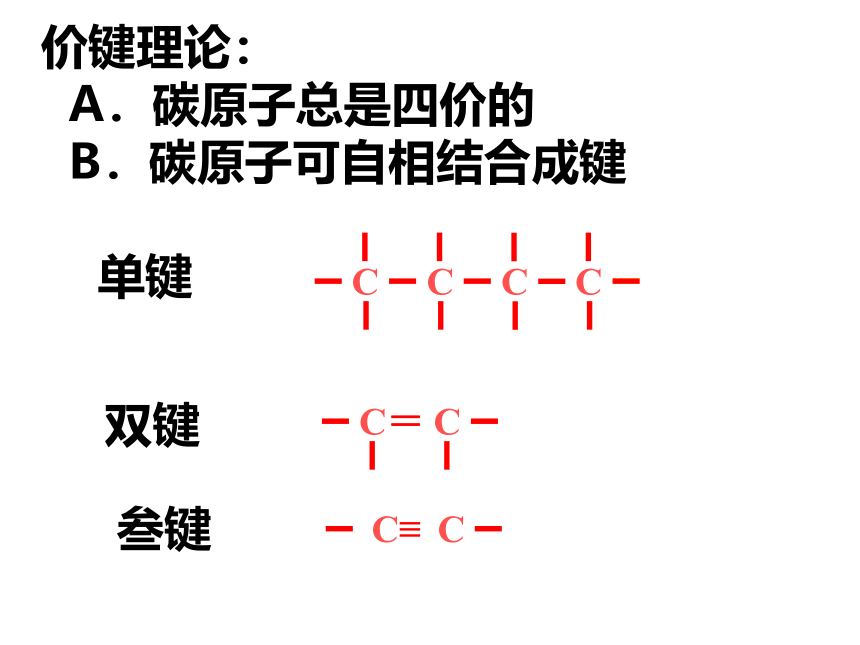
双键
C
C
C
C
价键理论:
A.碳原子总是四价的
B.碳原子可自相结合成键
单键
叁键
C=
C
C≡
C
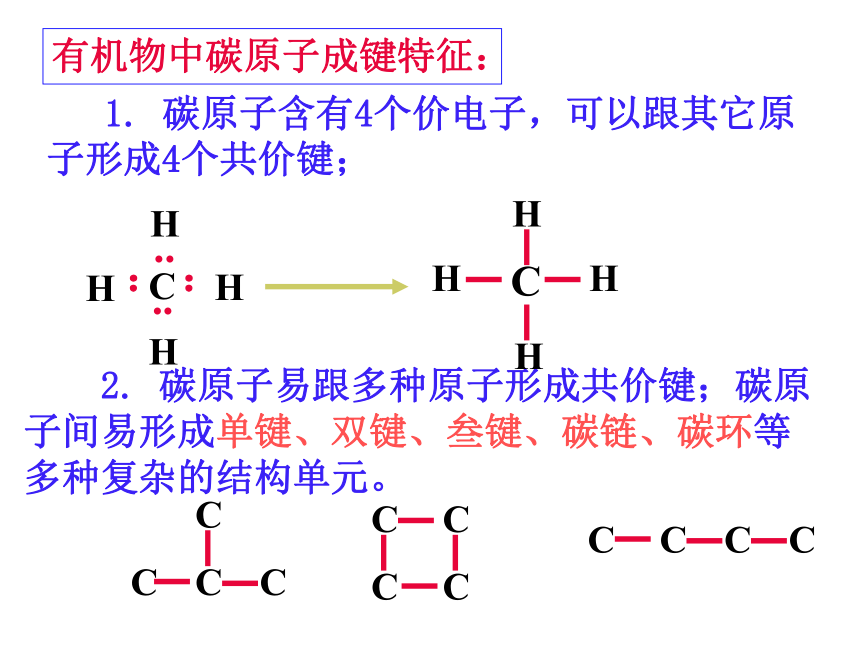
有机物中碳原子成键特征:
1. 碳原子含有4个价电子,可以跟其它原子形成4个共价键;
2. 碳原子易跟多种原子形成共价键;碳原子间易形成单键、双键、叁键、碳链、碳环等多种复杂的结构单元。
C
H
H
H
H
:
:
C
C
C
C
C
C
C
C
C
C
C
C
H
H
H
..
C
..
H
3. 烃
仅含碳、氢两种元素的有机物称为碳氢化合物。
定义:
【知识简介】
有机物名称组字一般规则:
烃—— 碳取“火”、氢取“ ” ;
烷——这类物质中“碳”的价键“完”全被氢所饱和;
烯——这类物质中氢比较“稀”少;
炔——这类物质中氢比较“缺”少。
烷烃通式:CnH2n+2
结构特点:链状、碳碳单键 (饱和烃)
烯烃通式:CnH2n
结构特点:链状、碳碳双键(不饱和烃)
炔烃通式:CnH2n-2
结构特点:链状、碳碳叁键(不饱和烃)
环烷烃通式:CnH2n
结构特点:环状、碳碳单键(饱和烃)
芳香烃
(如:苯)化学式:C6H6
结构特点:环状、介于单双键之间的特殊键
有机物的结构:
特征反应:
取代反应
特征反应:
加成、加聚反应
特征反应:
加成、加聚反应
特征反应:
取代、加成反应
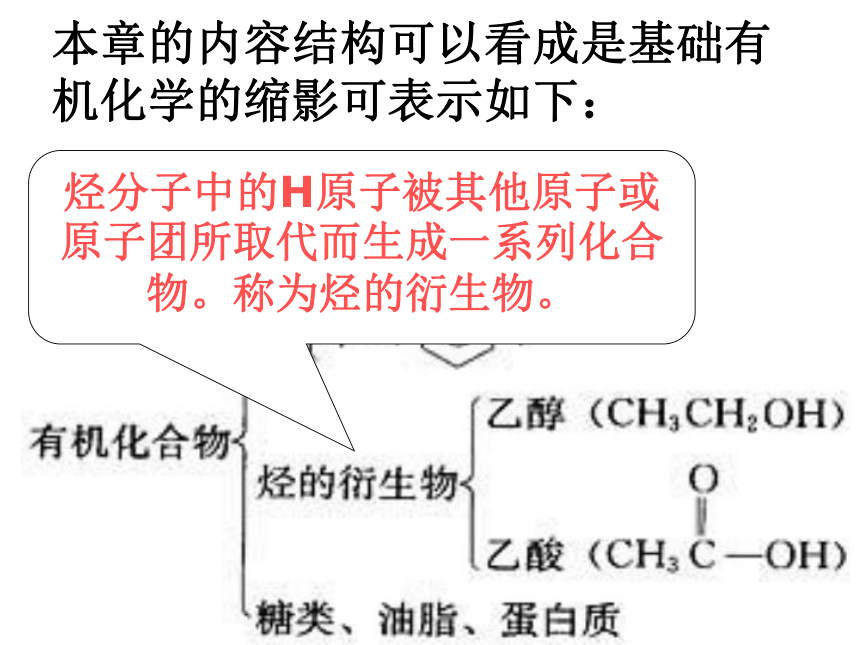
本章的内容结构可以看成是基础有机化学的缩影可表示如下:
烃分子中的H原子被其他原子或原子团所取代而生成一系列化合物。称为烃的衍生物。
1.甲烷的化学式、电子式、结构式
化学式:CH4
甲烷——最简单的烃
2. 甲烷的空间结构:
试验证明:甲烷分子是正四面体结构,碳原子位于正四面体的中心,4个氢原子位于四个顶点上。
①物理性质
无色、无味的气体;
?=0.717g/L(标准状况下)
(密度求算公式:M=22.4 ?);
极难溶于水;
俗名:沼气、坑气,是天然气的主要成分(80~97%)
3. 甲烷的性质
②化学性质:
(1)常温下比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
CH4
甲烷通入KMnO4酸性溶液中
现象:紫色溶液没有变化
结论:甲烷不能使酸化的高锰酸钾溶液褪色
(2)可燃性(氧化反应)
在空气中燃烧 :
CH4 + 2O2 CO2 + 2H2O
点燃
烃燃烧的通式:
安静燃烧,产生淡蓝色火焰
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
点燃
CxHy + (x+ )O2 xCO2 + H2O
_
2
y
y
_
4
(3)与纯卤素的取代反应(分步且连锁进行的)
①
(一氯甲烷)
②
(二氯甲烷)
③
(三氯甲烷) (氯仿)
④
(四氯甲烷) (四氯化碳)
*甲烷与氯气的反应,共得到五种产物。
各氯代甲烷结构式
二氯甲烷的结构式
取代反应与置换反应的比较
取代反应
置换反应
可与化合物发生取代,生成物中不一定有单质
反应物、生成物中一定有单质
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属(或非金属)活动顺序
逐步取代,很多反应是可逆的
反应一般单方向进行
烷烃的化学性质(与CH4相似)
① 氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应。
②与纯卤素的取代反应
在光照条件下进行,产物更复杂。
例如:
会产生10种产物。
CH3-CH2Cl、CH3-CHCl2、CH2Cl-CH2Cl、CH3-CCl3、CH2Cl-CHCl2、CH2Cl-CCl3、CHCl2-CHCl2、CHCl2-CCl3、 CCl3-CCl3、 HCl
常见烷烃的结构式:
乙烷: H H 丙烷: H H H
| | | | |
H-C-C-H H-C-C-C-H
| | | | |
H H H H H
丁烷: H H H H 异丁烷: H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
结构简式:
例: H H H H H
| | | | |
H—C —C— C—C—C—H
| | | | |
H H—C—H H H H
|
H
CH3—CH—CH2—CH2—CH3
|
CH3
省略C—H键
把同一C上的H合并
省略横线上C—C键
或者
CH3CH(CH3)CH2CH2CH3
CH3CHCH2CH2CH3
|
CH3
常见烷烃对应的结构简式:
乙烷: H H 丙烷: H H H
| | | | |
H-C-C-H H-C-C-C-H
| | | | |
H H H H H
丁烷: H H H H 异丁烷: H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3CH(CH3)CH3
同系物:
结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
名称
结构简式
甲烷
CH4
乙烷
CH3CH3
丙烷
CH3CH2CH3
丁烷
CH3(CH2)2CH3
戊烷
CH3(CH2)3CH3
十七烷
CH3(CH2)15CH3
都是链状或都是环状
1. 下列哪组是同系物?( )
A. CH3CH2CH2CH3、CH3CH(CH3)CH3
B. CH3CH3、CH3CH(CH3)CH3
CH2
C. CH3-CH=CH3 CH2 CH2
练习
同分异构体
C4H10 丁烷
化合物具有相同的分子式,但具有不同结构式的化合物互称同分异构体。
CH3CH2CH2CH3
CH3CHCH3
CH3
特点
同系物
同:
不同:
同分异构体(化合物)
同:
不同:
同素异形体(单质)
同:
不同:
同位素
同:
不同:
(通式)结构相似
分子式
分子式
结构
元素
单质
质子数
中子数
2.下列五组物质中___互为同位素,___是同素异形体,___ 是同分异构体,___是同系物,___是同一物质。
A. B. 白磷、红磷
C. H H D. CH3CH3、CH3CHCH3
| | |
H-C-Cl 、Cl- C-Cl CH3
| |
Cl H
E. CH3CH(CH3)CH2CH3、C(CH3)4
A
练习
B
E
D
C
烷烃的命名
(1)
——习惯命名法
根据分子里所含碳原子的数目来命名:
碳原子数在十以上的,就用数字来表示,如:十一烷、十七烷等。
石油液化气就是丙烷和丁烷的混合气,打火机里的液体主要是丁烷。
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)简单烷烃的同分异构体用:
正、异、新来区别。
如:正丁烷、异丁烷;
正戊烷、异戊烷、新戊烷。
1.乙烯
乙烯的产量是一个国家石油化工发展水平的标志之一。
来自石油和煤的两种基本化工原料
2.苯(芳香烃)
苯是由英国科学家法拉第发现的,一种无色油状液体(致癌物之一)。
6个原子共平面,键角120°,平面型分子。
乙烯分子的结构
分子式:C2H4
结构式:
结构简式:
CH2=CH2
乙烯的性质
①物理性质
无色稍有气味,比空气略轻,难溶于水。
②化学性质
乙烯分子的碳碳双键中的一个键容易断裂。所以,乙烯的化学性质比较活泼。
⑴乙烯的氧化反应
⑵乙烯的加成反应
⑶乙烯的加聚反应
⑴氧化反应
①燃烧
——火焰明亮并伴有黒烟
CH2=CH2+3O2 2CO2+2H2O
点燃
将乙烯通入酸性KMnO4溶液中:
现象:
紫色褪去
②与酸性KMnO4的作用:
⑵加成反应
黄色(或橙色)褪去
乙烯能使酸性KMnO4溶液褪色
将乙烯通入溴水中:
现象:
1, 2—二溴乙烷 (无色液体)
有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应 。
⑶加聚反应
乙烯分子之间可否发生加成反应呢?
nCH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
CH2
=CH2
CH2
=CH2
CH2
=CH2
+
+
+
……
[ CH2—CH2 ]n
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子的反应
西红柿或香蕉的催熟实验
乙烯常用作果实催熟剂
一种无色、有毒、有特殊气味、不溶于水的液体,比水轻。
苯分子结构:
分子式:C6H6
苯的物理性质:
结构特点:
a. 平面结构;
b. 碳碳键是一种介于单键和双键之间的独特的键。
结构简式: 或
苯的一氯代物种类?
苯的邻二氯代物种类?
研究发现:
苯的一氯代物:一种
苯的邻二氯代物:一种
Cl
Cl
Cl
Cl
(1) 取代反应
苯的化学性质:
①溴代反应
②硝化反应
硝基苯
⑵加成反应
注意:苯不能与溴水发生加成反应(但能萃取溴而使水层褪色)。
环己烷
⑶氧化反应
苯不能使酸性KMnO4溶液褪色 ,但可以点燃。
2C6H6 + 15O2 12CO2 + 6H2O
点燃
现象:火焰明亮,有浓黑烟。
2. 易取代,难加成。
总结苯的化学性质(较稳定):
1. 难氧化(但可燃);
性质
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
结构
生活中两种常见的有机物
1.乙醇 C2H5OH
2.乙酸 CH3COOH
颜 色 :
气 味 :
状 态:
挥发性:
密 度:
溶解性:
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
乙醇
1. 物理性质
乙醇俗称酒精
2. 乙醇的分子结构
分子式: C2H6O
乙醇分子的比例模型
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基写作-OH
醇属于烃的衍生物
思考:-OH 与OH- 有何区别?
结构简式:
烃的衍生物的概念:
官能团的概念
决定化合物特殊性质的原子或原子团称为官能团。
名称
卤素原子
羟基
硝基
醛基
羧基
符号
-X
-OH
-NO2
-CHO
-COOH
几种常见的官能团名称和符号
3 . 乙醇的化学性质
(1)与活泼金属反应(如Na、K、Mg、Al等)
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
现象:沉在底部;有气泡;反应不如水剧烈
该反应属于有机化学的 反应。
取代
(2)乙醇的氧化反应
2CO2 +3H2O
C2H5OH + 3 O2
点燃
a.乙醇在空气中燃烧?:
现象:产生淡蓝色火焰,同时放出大量热。
CH3CH2OH
b.乙醇被强氧化剂如酸性高锰酸钾(乙醇能使酸性高锰酸钾溶液褪色)或重铬酸钾等氧化为乙酸。
CH3COOH
c.乙醇催化氧化:
C—C—H
H
H
H
H
O—H
[O]
H2O
催化剂
? 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
C—C—H
H
H
H
O
-2H
乙醇在加热和催化剂(Cu或Ag)的条件下,能够被空气氧化,其实质是“去氢”:脱去与羟基上的氢和与羟基相连的碳原子上的氢,生成乙醛。
乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
⑴与活泼金属反应____断裂
⑵C2H5OH燃烧_____断裂
⑶在Cu或Ag催化下和O2反应键_____断裂
练 习 题
①
全部
①③
乙酸
乙酸又名醋酸,它是食醋的主要成分,是日常生活中经常接触的一种有机酸。
乙酸的分子式是C2H4O2,结构简式是:
物理性质:
无色、强烈刺激性气味、液体
沸点:117.9℃,易挥发
熔点:16.6℃当温度低于16.6℃时, 乙酸凝结成冰一样的晶体,故纯净的乙酸又称为冰醋酸。
乙酸易溶于水和乙醇
使石蕊试液变红
与金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
化学性质:
(1)酸性
CH3COOH CH3COO-+H+
设计一个实验,比较醋酸和碳酸的酸性强弱.
科学探究
酸性: CH3COOH>H2CO3
可以看到试管里有气泡产生,是二氧化碳气体。这说明乙酸的酸性强于碳酸。尽管如此,但它在水溶液里还是只能发生部分电离,仍是一种弱酸。
(2)酯化反应
酯化反应的实质:酸脱羟基,醇脱氢
小结:
O
CH3—C—O—H
酸性
酯化反应
植物油
动物脂肪
人类为了维持生命与健康,除了阳光与空气外,必须摄取食物。食物的成分主要有糖类、油脂、蛋白质、维生素、无机盐和水六大类,通常称为营养素。
1. 糖类、油脂的组成元素 ;
蛋白质的组成元素除 外还有 等
2. 果糖、葡萄糖的分子式:
蔗糖、麦芽糖的分子式:
淀粉、纤维素的分子式:
一、几种基本营养物质的化学组成
C12H22O11
C H O
N S P
(C6H10O5)n
C6H12O6
C H O
CH2—CH—CH—CH—CH—C—H
=
O
—
OH
—
OH
—
—
—
OH
OH
OH
葡萄糖的结构式:
CH2—CH—CH—CH—C—CH2
O
=
—
OH
—
OH
—
—
—
OH
OH
OH
果糖的结构式:
结论:葡萄糖与果糖的结构不同,而其分子式相同,故二者互为同分异构体。
同分异构体
同分异构体
不是同分异构体
因为n值不同
淀粉的特征反应:
在常温下,淀粉遇碘 ( I2 ) 变蓝。
葡萄糖的特征反应:
与新制Cu(OH)2反应,产生砖红色沉淀。
与银氨溶液反应,有银镜生成。
蛋白质的特征反应:
颜色反应
现象:硝酸使蛋白质颜色变黄。
可以用来鉴别蛋白质。
蛋白质灼烧时,会有焦味。
有 机 物
一、什么叫有机物?
1.定义:
2.组成元素:
一般含有碳元素的化合物为有机物。
碳、氢、氧、氮、硫、磷、卤素等
( 但碳的氧化物(CO、CO2)、碳酸及其盐 、碳的金属化合物(CaC2)等看作无机物。)
主要元素
其他元素
有机物
无机物
溶解性
多数不溶于水,一般易溶于有机溶剂
多数溶于水,而不溶于有机溶剂
耐热性
多数不耐热,固体熔点低,一般在400℃以下
多数耐热、难熔化,熔点一般较高
可燃性
多数可燃烧
多数不可燃烧
导电性
多数为非电解质,难电离,不导电
多数是电解质,溶液或熔融状态下可导电
反应特点
一般复杂、副反应多,速率较慢,方程式用箭号表示
一般简单,副反应少,速率较快,方程式用等号表示
双键
C
C
C
C
价键理论:
A.碳原子总是四价的
B.碳原子可自相结合成键
单键
叁键
C=
C
C≡
C
有机物中碳原子成键特征:
1. 碳原子含有4个价电子,可以跟其它原子形成4个共价键;
2. 碳原子易跟多种原子形成共价键;碳原子间易形成单键、双键、叁键、碳链、碳环等多种复杂的结构单元。
C
H
H
H
H
:
:
C
C
C
C
C
C
C
C
C
C
C
C
H
H
H
..
C
..
H
3. 烃
仅含碳、氢两种元素的有机物称为碳氢化合物。
定义:
【知识简介】
有机物名称组字一般规则:
烃—— 碳取“火”、氢取“ ” ;
烷——这类物质中“碳”的价键“完”全被氢所饱和;
烯——这类物质中氢比较“稀”少;
炔——这类物质中氢比较“缺”少。
烷烃通式:CnH2n+2
结构特点:链状、碳碳单键 (饱和烃)
烯烃通式:CnH2n
结构特点:链状、碳碳双键(不饱和烃)
炔烃通式:CnH2n-2
结构特点:链状、碳碳叁键(不饱和烃)
环烷烃通式:CnH2n
结构特点:环状、碳碳单键(饱和烃)
芳香烃
(如:苯)化学式:C6H6
结构特点:环状、介于单双键之间的特殊键
有机物的结构:
特征反应:
取代反应
特征反应:
加成、加聚反应
特征反应:
加成、加聚反应
特征反应:
取代、加成反应
本章的内容结构可以看成是基础有机化学的缩影可表示如下:
烃分子中的H原子被其他原子或原子团所取代而生成一系列化合物。称为烃的衍生物。
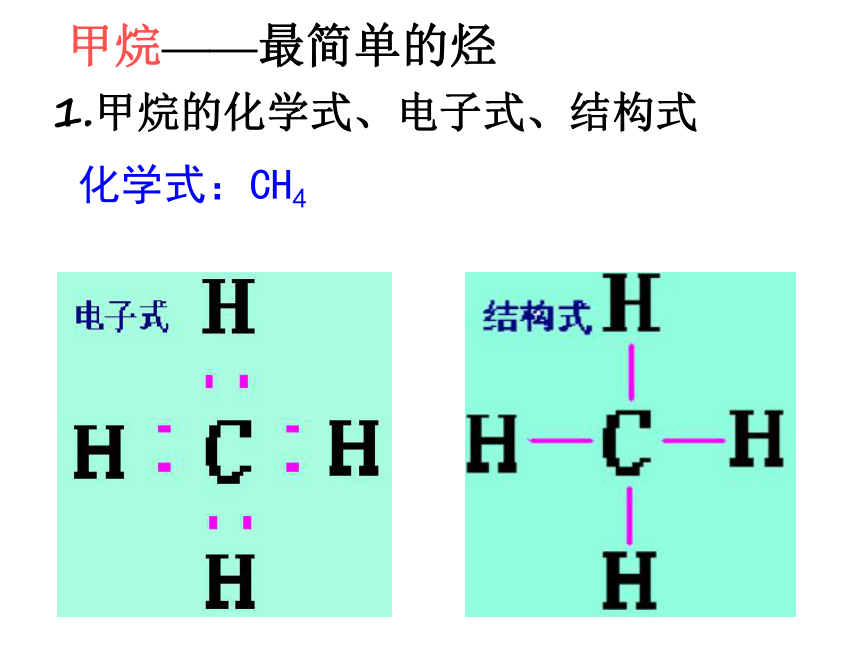
1.甲烷的化学式、电子式、结构式
化学式:CH4
甲烷——最简单的烃
2. 甲烷的空间结构:
试验证明:甲烷分子是正四面体结构,碳原子位于正四面体的中心,4个氢原子位于四个顶点上。
①物理性质
无色、无味的气体;
?=0.717g/L(标准状况下)
(密度求算公式:M=22.4 ?);
极难溶于水;
俗名:沼气、坑气,是天然气的主要成分(80~97%)
3. 甲烷的性质
②化学性质:
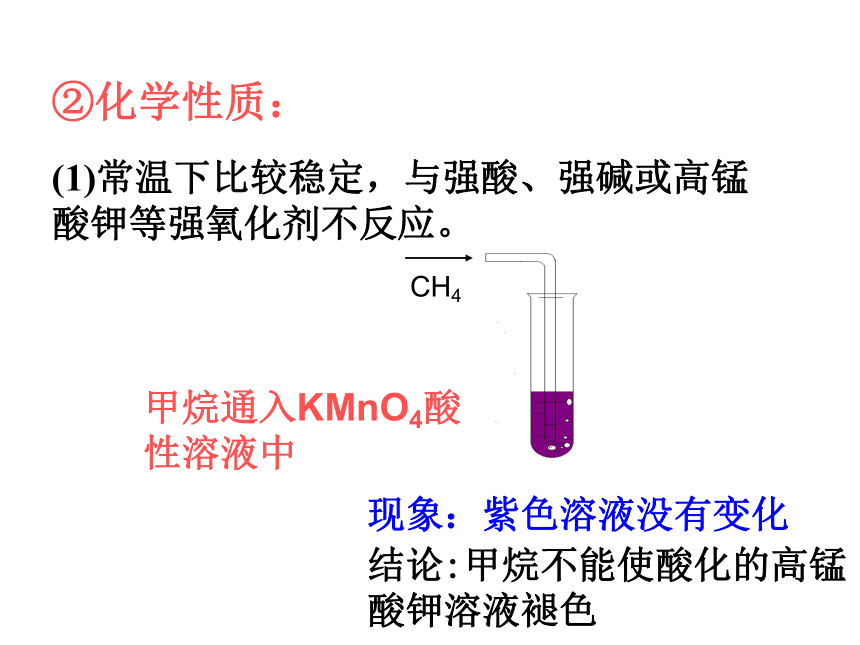
(1)常温下比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
CH4
甲烷通入KMnO4酸性溶液中
现象:紫色溶液没有变化
结论:甲烷不能使酸化的高锰酸钾溶液褪色
(2)可燃性(氧化反应)
在空气中燃烧 :
CH4 + 2O2 CO2 + 2H2O
点燃
烃燃烧的通式:
安静燃烧,产生淡蓝色火焰
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
点燃
CxHy + (x+ )O2 xCO2 + H2O
_
2
y
y
_
4
(3)与纯卤素的取代反应(分步且连锁进行的)
①
(一氯甲烷)
②
(二氯甲烷)
③
(三氯甲烷) (氯仿)
④
(四氯甲烷) (四氯化碳)
*甲烷与氯气的反应,共得到五种产物。
各氯代甲烷结构式
二氯甲烷的结构式
取代反应与置换反应的比较
取代反应
置换反应
可与化合物发生取代,生成物中不一定有单质
反应物、生成物中一定有单质
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属(或非金属)活动顺序
逐步取代,很多反应是可逆的
反应一般单方向进行
烷烃的化学性质(与CH4相似)
① 氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应。
②与纯卤素的取代反应
在光照条件下进行,产物更复杂。
例如:
会产生10种产物。
CH3-CH2Cl、CH3-CHCl2、CH2Cl-CH2Cl、CH3-CCl3、CH2Cl-CHCl2、CH2Cl-CCl3、CHCl2-CHCl2、CHCl2-CCl3、 CCl3-CCl3、 HCl
常见烷烃的结构式:
乙烷: H H 丙烷: H H H
| | | | |
H-C-C-H H-C-C-C-H
| | | | |
H H H H H
丁烷: H H H H 异丁烷: H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
结构简式:
例: H H H H H
| | | | |
H—C —C— C—C—C—H
| | | | |
H H—C—H H H H
|
H
CH3—CH—CH2—CH2—CH3
|
CH3
省略C—H键
把同一C上的H合并
省略横线上C—C键
或者
CH3CH(CH3)CH2CH2CH3
CH3CHCH2CH2CH3
|
CH3
常见烷烃对应的结构简式:
乙烷: H H 丙烷: H H H
| | | | |
H-C-C-H H-C-C-C-H
| | | | |
H H H H H
丁烷: H H H H 异丁烷: H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3CH(CH3)CH3
同系物:
结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
名称
结构简式
甲烷
CH4
乙烷
CH3CH3
丙烷
CH3CH2CH3
丁烷
CH3(CH2)2CH3
戊烷
CH3(CH2)3CH3
十七烷
CH3(CH2)15CH3
都是链状或都是环状
1. 下列哪组是同系物?( )
A. CH3CH2CH2CH3、CH3CH(CH3)CH3
B. CH3CH3、CH3CH(CH3)CH3
CH2
C. CH3-CH=CH3 CH2 CH2
练习
同分异构体
C4H10 丁烷
化合物具有相同的分子式,但具有不同结构式的化合物互称同分异构体。
CH3CH2CH2CH3
CH3CHCH3
CH3
特点
同系物
同:
不同:
同分异构体(化合物)
同:
不同:
同素异形体(单质)
同:
不同:
同位素
同:
不同:
(通式)结构相似
分子式
分子式
结构
元素
单质
质子数
中子数
2.下列五组物质中___互为同位素,___是同素异形体,___ 是同分异构体,___是同系物,___是同一物质。
A. B. 白磷、红磷
C. H H D. CH3CH3、CH3CHCH3
| | |
H-C-Cl 、Cl- C-Cl CH3
| |
Cl H
E. CH3CH(CH3)CH2CH3、C(CH3)4
A
练习
B
E
D
C
烷烃的命名
(1)
——习惯命名法
根据分子里所含碳原子的数目来命名:
碳原子数在十以上的,就用数字来表示,如:十一烷、十七烷等。
石油液化气就是丙烷和丁烷的混合气,打火机里的液体主要是丁烷。
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)简单烷烃的同分异构体用:
正、异、新来区别。
如:正丁烷、异丁烷;
正戊烷、异戊烷、新戊烷。
1.乙烯
乙烯的产量是一个国家石油化工发展水平的标志之一。
来自石油和煤的两种基本化工原料
2.苯(芳香烃)
苯是由英国科学家法拉第发现的,一种无色油状液体(致癌物之一)。
6个原子共平面,键角120°,平面型分子。
乙烯分子的结构
分子式:C2H4
结构式:
结构简式:
CH2=CH2
乙烯的性质
①物理性质
无色稍有气味,比空气略轻,难溶于水。
②化学性质
乙烯分子的碳碳双键中的一个键容易断裂。所以,乙烯的化学性质比较活泼。
⑴乙烯的氧化反应
⑵乙烯的加成反应
⑶乙烯的加聚反应
⑴氧化反应
①燃烧
——火焰明亮并伴有黒烟
CH2=CH2+3O2 2CO2+2H2O
点燃
将乙烯通入酸性KMnO4溶液中:
现象:
紫色褪去
②与酸性KMnO4的作用:
⑵加成反应
黄色(或橙色)褪去
乙烯能使酸性KMnO4溶液褪色
将乙烯通入溴水中:
现象:
1, 2—二溴乙烷 (无色液体)
有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应 。
⑶加聚反应
乙烯分子之间可否发生加成反应呢?
nCH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
CH2
=CH2
CH2
=CH2
CH2
=CH2
+
+
+
……
[ CH2—CH2 ]n
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子的反应
西红柿或香蕉的催熟实验
乙烯常用作果实催熟剂
一种无色、有毒、有特殊气味、不溶于水的液体,比水轻。
苯分子结构:
分子式:C6H6
苯的物理性质:
结构特点:
a. 平面结构;
b. 碳碳键是一种介于单键和双键之间的独特的键。
结构简式: 或
苯的一氯代物种类?
苯的邻二氯代物种类?
研究发现:
苯的一氯代物:一种
苯的邻二氯代物:一种
Cl
Cl
Cl
Cl
(1) 取代反应
苯的化学性质:
①溴代反应
②硝化反应
硝基苯
⑵加成反应
注意:苯不能与溴水发生加成反应(但能萃取溴而使水层褪色)。
环己烷
⑶氧化反应
苯不能使酸性KMnO4溶液褪色 ,但可以点燃。
2C6H6 + 15O2 12CO2 + 6H2O
点燃
现象:火焰明亮,有浓黑烟。
2. 易取代,难加成。
总结苯的化学性质(较稳定):
1. 难氧化(但可燃);
性质
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
结构
生活中两种常见的有机物
1.乙醇 C2H5OH
2.乙酸 CH3COOH
颜 色 :
气 味 :
状 态:
挥发性:
密 度:
溶解性:
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
乙醇
1. 物理性质
乙醇俗称酒精
2. 乙醇的分子结构
分子式: C2H6O
乙醇分子的比例模型
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基写作-OH
醇属于烃的衍生物
思考:-OH 与OH- 有何区别?
结构简式:
烃的衍生物的概念:
官能团的概念
决定化合物特殊性质的原子或原子团称为官能团。
名称
卤素原子
羟基
硝基
醛基
羧基
符号
-X
-OH
-NO2
-CHO
-COOH
几种常见的官能团名称和符号
3 . 乙醇的化学性质
(1)与活泼金属反应(如Na、K、Mg、Al等)
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
现象:沉在底部;有气泡;反应不如水剧烈
该反应属于有机化学的 反应。
取代
(2)乙醇的氧化反应
2CO2 +3H2O
C2H5OH + 3 O2
点燃
a.乙醇在空气中燃烧?:
现象:产生淡蓝色火焰,同时放出大量热。
CH3CH2OH
b.乙醇被强氧化剂如酸性高锰酸钾(乙醇能使酸性高锰酸钾溶液褪色)或重铬酸钾等氧化为乙酸。
CH3COOH
c.乙醇催化氧化:
C—C—H
H
H
H
H
O—H
[O]
H2O
催化剂
? 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
C—C—H
H
H
H
O
-2H
乙醇在加热和催化剂(Cu或Ag)的条件下,能够被空气氧化,其实质是“去氢”:脱去与羟基上的氢和与羟基相连的碳原子上的氢,生成乙醛。
乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
⑴与活泼金属反应____断裂
⑵C2H5OH燃烧_____断裂
⑶在Cu或Ag催化下和O2反应键_____断裂
练 习 题
①
全部
①③
乙酸
乙酸又名醋酸,它是食醋的主要成分,是日常生活中经常接触的一种有机酸。
乙酸的分子式是C2H4O2,结构简式是:
物理性质:
无色、强烈刺激性气味、液体
沸点:117.9℃,易挥发
熔点:16.6℃当温度低于16.6℃时, 乙酸凝结成冰一样的晶体,故纯净的乙酸又称为冰醋酸。
乙酸易溶于水和乙醇
使石蕊试液变红
与金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
化学性质:
(1)酸性
CH3COOH CH3COO-+H+
设计一个实验,比较醋酸和碳酸的酸性强弱.
科学探究
酸性: CH3COOH>H2CO3
可以看到试管里有气泡产生,是二氧化碳气体。这说明乙酸的酸性强于碳酸。尽管如此,但它在水溶液里还是只能发生部分电离,仍是一种弱酸。
(2)酯化反应
酯化反应的实质:酸脱羟基,醇脱氢
小结:
O
CH3—C—O—H
酸性
酯化反应
植物油
动物脂肪
人类为了维持生命与健康,除了阳光与空气外,必须摄取食物。食物的成分主要有糖类、油脂、蛋白质、维生素、无机盐和水六大类,通常称为营养素。
1. 糖类、油脂的组成元素 ;
蛋白质的组成元素除 外还有 等
2. 果糖、葡萄糖的分子式:
蔗糖、麦芽糖的分子式:
淀粉、纤维素的分子式:
一、几种基本营养物质的化学组成
C12H22O11
C H O
N S P
(C6H10O5)n
C6H12O6
C H O
CH2—CH—CH—CH—CH—C—H
=
O
—
OH
—
OH
—
—
—
OH
OH
OH
葡萄糖的结构式:
CH2—CH—CH—CH—C—CH2
O
=
—
OH
—
OH
—
—
—
OH
OH
OH
果糖的结构式:
结论:葡萄糖与果糖的结构不同,而其分子式相同,故二者互为同分异构体。
同分异构体
同分异构体
不是同分异构体
因为n值不同
淀粉的特征反应:
在常温下,淀粉遇碘 ( I2 ) 变蓝。
葡萄糖的特征反应:
与新制Cu(OH)2反应,产生砖红色沉淀。
与银氨溶液反应,有银镜生成。
蛋白质的特征反应:
颜色反应
现象:硝酸使蛋白质颜色变黄。
可以用来鉴别蛋白质。
蛋白质灼烧时,会有焦味。
