高中化学必修2课件:第2章 第1节 化学能与热能课件(共 20张PPT)
文档属性
| 名称 | 高中化学必修2课件:第2章 第1节 化学能与热能课件(共 20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 670.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-12 20:17:31 | ||
图片预览







文档简介
第1节 化学能与热能 (第1课时)
第二章 化学反应与能量
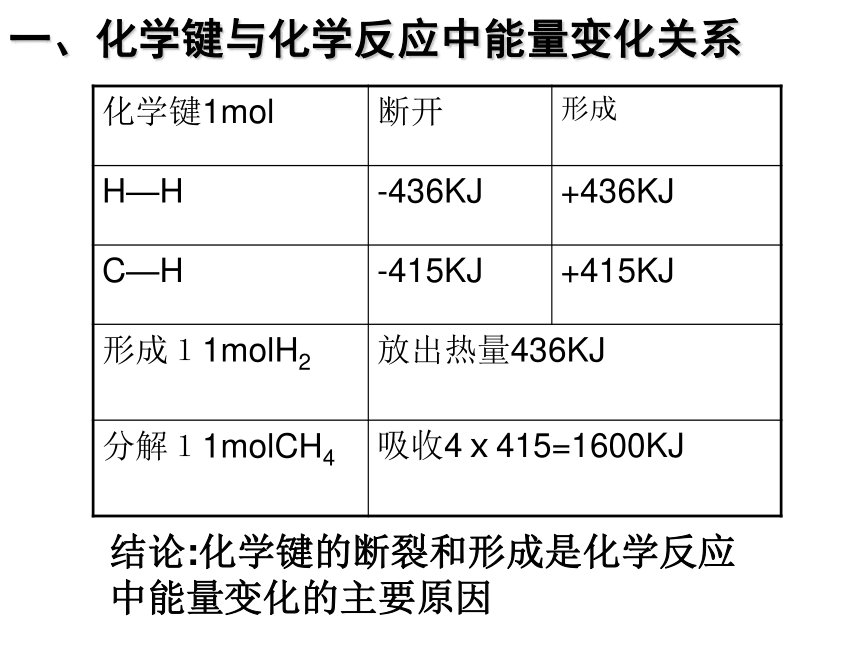
化学键1mol
断开
形成
H—H
-436KJ
+436KJ
C—H
-415KJ
+415KJ
形成11molH2
放出热量436KJ
分解11molCH4
吸收4ⅹ415=1600KJ
结论:化学键的断裂和形成是化学反应中能量变化的主要原因
一、化学键与化学反应中能量变化关系
反应物总能量
高于生成物总能量
(化学能——热能)
放出热量
反应物总能量
低于生成物总能量
(热能——化学能)
吸收热量
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出热量
吸收热量
放热反应
吸热反应
E(反应物)>E(生成物)
E(反应物)<E(生成物)
结论:一个化学反应是释放能量还是吸收能量取决于反应物总能量与生成物总能量的相对高低
一、化学键与化学反应中能量变化关系
(化学能释放)
(化学能储存)
E(反)-E(生)=E(放)
E(生)-E(反)=E(吸)
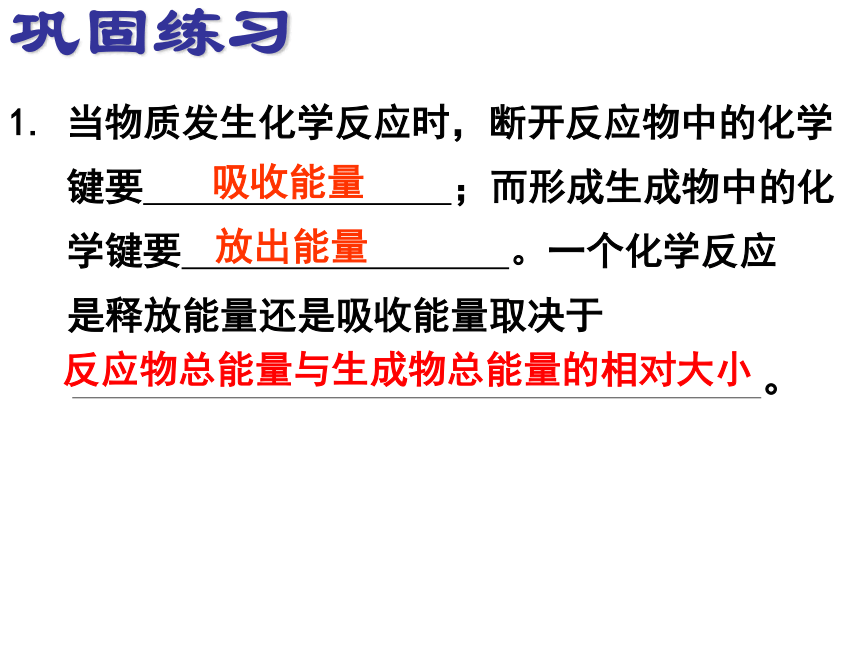
1. 当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。
吸收能量
放出能量
反应物总能量与生成物总能量的相对大小
巩固练习
2. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能 量
D. 该反应为放热反应,故不必加热就
一定能发生
C
1moL H-H 键断裂所需能量 436kJ
1moL Cl-Cl 键断裂所需能量 243kJ
1mol H-Cl 键形成放出能量 431kJ
反应物吸收总能量 436kJ + 243kJ = 679kJ
生成物释放总能量 431kJ × 2 = 862kJ
吸收能量 < 放出能量 反应放热
吸收能量 > 放出能量 反应吸热
H2 + Cl2 ==== 2HCl
点燃
是放热反应
3.下列各图中,表示正反应是吸热
反应的是 ( )
A
4. 下列说法中正确的是 ( )
A. 物质发生化学反应都伴随着能量的变化
B. 伴有能量变化的物质变化都是化学变化
C. 在一个确定的化学反应关系中,
反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应关系中,
反应物的总能量总是高于生成物的总能量
AC
现象
结论
二、化学能与热能的相互转化
实验2-1:盐酸与铝片的反应
实验2-2 :Ba(OH)2· 8H2O与NH4Cl的反应
现象
结论
反应放出热量。
有气泡放出,温度升高。
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片被冻在一起。
反应吸收热量。
实验2-3 :酸与碱的中和反应
反应物及其用量
HCl
20mL 1mol/L
NaOH 20mL1mol/L
混合前温度
混合后温度
结 论
归纳与概括
HCl与NaOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
思考与交流
测量中和反应热应该注意哪些问题?
1. 保温隔热的效果一定要好。
2. 酸碱浓度要准确。
3. 温度计要读准,水银球要全浸在
4. 实验操作时动作要快,以尽量
溶液中,且要稳定一段时间再读。
减少热量的散失。
三、常见放热反应和吸热反应
放热反应:
1. 燃料物质的燃烧:C + O2 = CO2
2. 常见金属(Al、Fe、Zn等)
与酸(HCl、H2SO4等)的反应
3. 酸碱中和反应:
HCl + NaOH = NaCl + H2O
5. 缓慢氧化:食物的腐败
4. 大多数化合反应
吸热反应:
1. 大多数分解反应:CaCO3 = CaO + CO2↑
2. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应:
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
3. 碳与CO2气体的反应: C + CO2 =2CO
4. 碳与水蒸气的反应:C + H2O=CO + H2
△
5. 氢气还原氧化铜:H2+CuO = H2O+Cu
△
巩固练习:
1. 下列物质加入水中显著放热的是:
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
2. 下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
巩固练习:
3. 下列反应属于放热反应的是:
A. NaOH与HCl反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应
4. 1molBa(OH)2 和1mol H2SO4反应放出的热量为Q,则Q为它们的中和热
错
其中和热为1/2 Q
四、化学反应提供的热能对人类社会意义
利用热量进行生活、生产、和科研。
利用热能使许多化学反应得以发生。
小结:
第1节 化学能与热能
一、化学键的断裂和形成是化学反应中能量变化的主要原因
二、化学反应中能量变化与反应热
1. 放热反应---反应物总能量大于生成物总能量
例如:燃烧、金属与酸的反应、酸碱中和反应等
2. 吸热反应---生成物总能量大于反应物总能量
例如:大多数分解反应、 Ba(OH)2·8H2O和NH4Cl的反应等
1. 断裂化学键----吸收能量
2. 形成化学键----放出能量
第二章 化学反应与能量
化学键1mol
断开
形成
H—H
-436KJ
+436KJ
C—H
-415KJ
+415KJ
形成11molH2
放出热量436KJ
分解11molCH4
吸收4ⅹ415=1600KJ
结论:化学键的断裂和形成是化学反应中能量变化的主要原因
一、化学键与化学反应中能量变化关系
反应物总能量
高于生成物总能量
(化学能——热能)
放出热量
反应物总能量
低于生成物总能量
(热能——化学能)
吸收热量
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出热量
吸收热量
放热反应
吸热反应
E(反应物)>E(生成物)
E(反应物)<E(生成物)
结论:一个化学反应是释放能量还是吸收能量取决于反应物总能量与生成物总能量的相对高低
一、化学键与化学反应中能量变化关系
(化学能释放)
(化学能储存)
E(反)-E(生)=E(放)
E(生)-E(反)=E(吸)
1. 当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。
吸收能量
放出能量
反应物总能量与生成物总能量的相对大小
巩固练习
2. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能 量
D. 该反应为放热反应,故不必加热就
一定能发生
C
1moL H-H 键断裂所需能量 436kJ
1moL Cl-Cl 键断裂所需能量 243kJ
1mol H-Cl 键形成放出能量 431kJ
反应物吸收总能量 436kJ + 243kJ = 679kJ
生成物释放总能量 431kJ × 2 = 862kJ
吸收能量 < 放出能量 反应放热
吸收能量 > 放出能量 反应吸热
H2 + Cl2 ==== 2HCl
点燃
是放热反应
3.下列各图中,表示正反应是吸热
反应的是 ( )
A
4. 下列说法中正确的是 ( )
A. 物质发生化学反应都伴随着能量的变化
B. 伴有能量变化的物质变化都是化学变化
C. 在一个确定的化学反应关系中,
反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应关系中,
反应物的总能量总是高于生成物的总能量
AC
现象
结论
二、化学能与热能的相互转化
实验2-1:盐酸与铝片的反应
实验2-2 :Ba(OH)2· 8H2O与NH4Cl的反应
现象
结论
反应放出热量。
有气泡放出,温度升高。
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片被冻在一起。
反应吸收热量。
实验2-3 :酸与碱的中和反应
反应物及其用量
HCl
20mL 1mol/L
NaOH 20mL1mol/L
混合前温度
混合后温度
结 论
归纳与概括
HCl与NaOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
思考与交流
测量中和反应热应该注意哪些问题?
1. 保温隔热的效果一定要好。
2. 酸碱浓度要准确。
3. 温度计要读准,水银球要全浸在
4. 实验操作时动作要快,以尽量
溶液中,且要稳定一段时间再读。
减少热量的散失。
三、常见放热反应和吸热反应
放热反应:
1. 燃料物质的燃烧:C + O2 = CO2
2. 常见金属(Al、Fe、Zn等)
与酸(HCl、H2SO4等)的反应
3. 酸碱中和反应:
HCl + NaOH = NaCl + H2O
5. 缓慢氧化:食物的腐败
4. 大多数化合反应
吸热反应:
1. 大多数分解反应:CaCO3 = CaO + CO2↑
2. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应:
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
3. 碳与CO2气体的反应: C + CO2 =2CO
4. 碳与水蒸气的反应:C + H2O=CO + H2
△
5. 氢气还原氧化铜:H2+CuO = H2O+Cu
△
巩固练习:
1. 下列物质加入水中显著放热的是:
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
2. 下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
巩固练习:
3. 下列反应属于放热反应的是:
A. NaOH与HCl反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应
4. 1molBa(OH)2 和1mol H2SO4反应放出的热量为Q,则Q为它们的中和热
错
其中和热为1/2 Q
四、化学反应提供的热能对人类社会意义
利用热量进行生活、生产、和科研。
利用热能使许多化学反应得以发生。
小结:
第1节 化学能与热能
一、化学键的断裂和形成是化学反应中能量变化的主要原因
二、化学反应中能量变化与反应热
1. 放热反应---反应物总能量大于生成物总能量
例如:燃烧、金属与酸的反应、酸碱中和反应等
2. 吸热反应---生成物总能量大于反应物总能量
例如:大多数分解反应、 Ba(OH)2·8H2O和NH4Cl的反应等
1. 断裂化学键----吸收能量
2. 形成化学键----放出能量
