高中化学必修2课件:第2章 第2节 化学能与电能课件(共22 张PPT)
文档属性
| 名称 | 高中化学必修2课件:第2章 第2节 化学能与电能课件(共22 张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-12 20:19:39 | ||
图片预览







文档简介
第二章 化学反应与能量
第2节
化学能与电能
能源
水能
风能
石油
天然气
蒸汽
电能
原煤
能源
一次能源:直接从自然界取得的能源。
二次能源:一次能源经过加工、转换 得到的能源。
一次能源:直接从自然界取得的能源。
二次能源:一次能源经过加工、转换得到的能源。
水能
风能
石油
天然气
蒸汽
电能
原煤
一次能源:
二次能源:
蒸汽
电能
水能
风能
石油
天然气
原煤
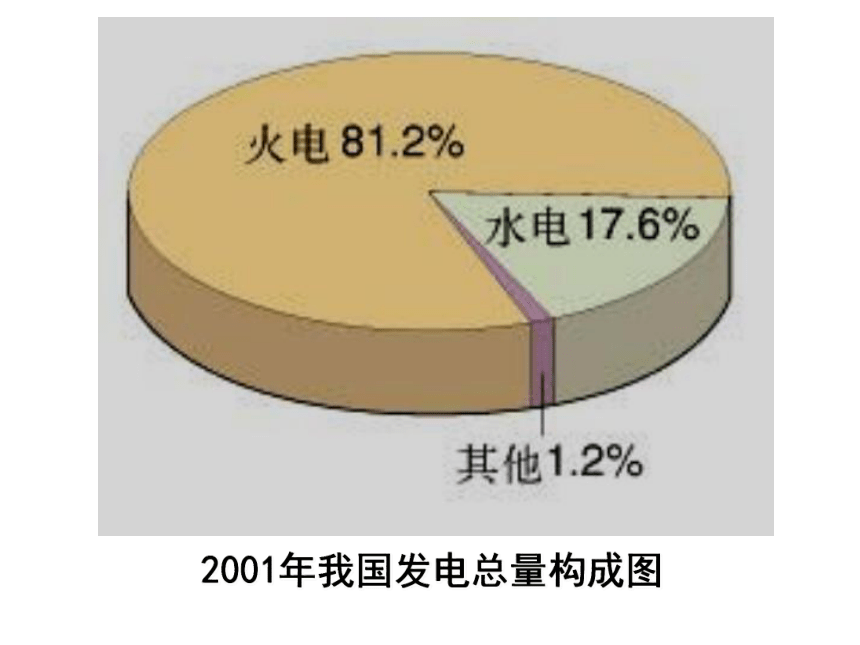
2001年我国发电总量构成图
火电站工作原理示意图
化学能
电能
机械能
热能
燃烧
蒸汽
发电机
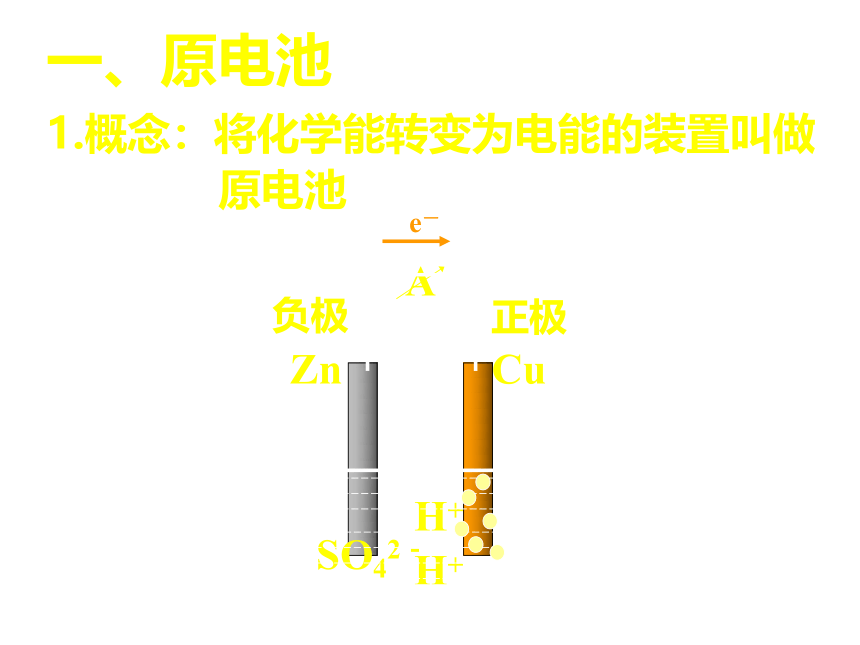
一、原电池
1.概念:将化学能转变为电能的装置叫做
原电池
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
2.原电池的电极反应:
锌片(负极):
铜片(正极):
Zn-2e- = Zn2+
2H++2e-=H2 ↑
原电池的总反应:
Zn+H2SO4=ZnSO4+H2↑
Zn+2H+=Zn2++H2↑
氧化反应
还原反应
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
3.构成原电池的条件
⑴有两种活动性不同的金属(或一种是非
金属导体如碳棒)做电极。
⑵电极材料均插入电解质溶液中。
⑶两电极要相连接或接触,形成闭合回路。
⑷自发进行的氧化还原反应。
负极:较活泼的金属
正极:较不活泼的金属或非金属导体
4. 判断原电池正、负极的方法
*由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
*根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
*根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
5.设计原电池
氧化还原反应:Fe+ H+ = Fe2+ + H2
C
A
Fe
果汁
电极材料:
负极:铁片
正极:铜片
电解质溶液:果汁
水果电池
思考
1.我们平时使用的干电池的正、负极是
由什么材料做成的?干电池中有电
解质溶液吗?它是怎样做成的?
二、发展中的化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1. 干电池结构及电极反应原理
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
其他电池
空气电池
第2节
化学能与电能
能源
水能
风能
石油
天然气
蒸汽
电能
原煤
能源
一次能源:直接从自然界取得的能源。
二次能源:一次能源经过加工、转换 得到的能源。
一次能源:直接从自然界取得的能源。
二次能源:一次能源经过加工、转换得到的能源。
水能
风能
石油
天然气
蒸汽
电能
原煤
一次能源:
二次能源:
蒸汽
电能
水能
风能
石油
天然气
原煤
2001年我国发电总量构成图
火电站工作原理示意图
化学能
电能
机械能
热能
燃烧
蒸汽
发电机
一、原电池
1.概念:将化学能转变为电能的装置叫做
原电池
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
2.原电池的电极反应:
锌片(负极):
铜片(正极):
Zn-2e- = Zn2+
2H++2e-=H2 ↑
原电池的总反应:
Zn+H2SO4=ZnSO4+H2↑
Zn+2H+=Zn2++H2↑
氧化反应
还原反应
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
3.构成原电池的条件
⑴有两种活动性不同的金属(或一种是非
金属导体如碳棒)做电极。
⑵电极材料均插入电解质溶液中。
⑶两电极要相连接或接触,形成闭合回路。
⑷自发进行的氧化还原反应。
负极:较活泼的金属
正极:较不活泼的金属或非金属导体
4. 判断原电池正、负极的方法
*由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
*根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
*根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
5.设计原电池
氧化还原反应:Fe+ H+ = Fe2+ + H2
C
A
Fe
果汁
电极材料:
负极:铁片
正极:铜片
电解质溶液:果汁
水果电池
思考
1.我们平时使用的干电池的正、负极是
由什么材料做成的?干电池中有电
解质溶液吗?它是怎样做成的?
二、发展中的化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
干电池
碱性电池
1. 干电池结构及电极反应原理
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
其他电池
空气电池
