2011—2012学年化学苏教版必修1同步教学案:专题4 硫、氮和可持续发展:专题4 硫、氮和可持续发展 本专题复习课
文档属性
| 名称 | 2011—2012学年化学苏教版必修1同步教学案:专题4 硫、氮和可持续发展:专题4 硫、氮和可持续发展 本专题复习课 |
|
|
| 格式 | zip | ||
| 文件大小 | 149.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-08-30 00:00:00 | ||
图片预览


文档简介
专题4 硫、氮和可持续发展
本专题复习课
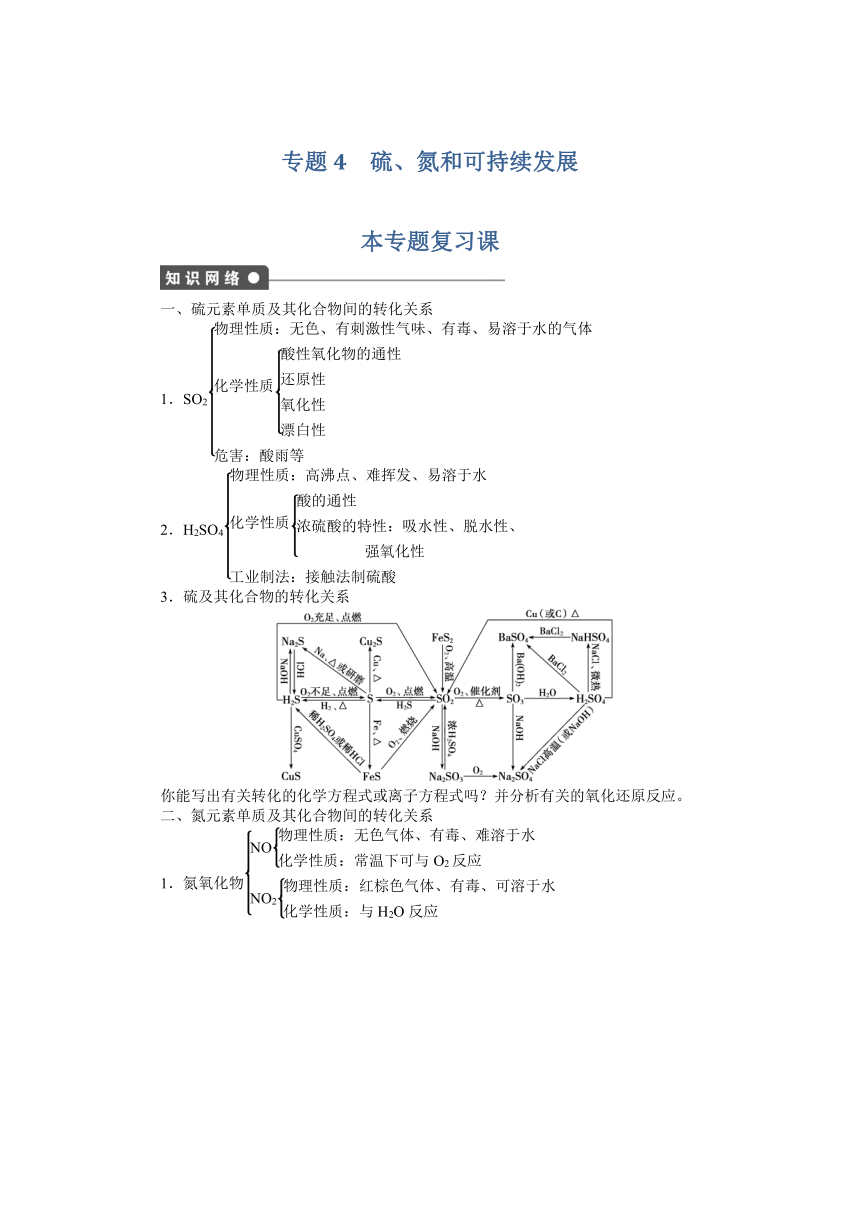
一、硫元素单质及其化合物间的转化关系
1.SO2
2.H2SO4
3.硫及其化合物的转化关系
你能写出有关转化的化学方程式或离子方程式吗?并分析有关的氧化还原反应。
二、氮元素单质及其化合物间的转化关系
1.氮氧化物
2.
3.氮及其化合物间的转化关系
你能写出有关转化的化学方程式或离子方程式吗?并分析有关的氧化还原反应。
1.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理
②少用原煤作燃料 ③燃煤时鼓入足量空气 ④开发清洁能源。其中能减少酸雨产生的措施是( )
A.①②③ B.②③④ C.①②④ D.①③④
2.向50 mL 18 mol·L-1的H2SO4中加入足量的Cu片并加热,被还原的H2SO4的物质的量是( )
A.等于0.9 mol
B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol
D.小于0.45 mol
3.下列反应中硫元素只体现了氧化性的是( )
A.SO2+2H2S===3S↓+2H2O
B.2SO2+O22SO3
C.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
D.Zn+H2SO4===ZnSO4+H2↑
4.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2有漂白性
C.湿润淀粉碘化钾试纸未变蓝说明SO2的氧化性弱于I2
D.NaCl溶液可用于除去实验中多余的SO2
5.我国“神舟七号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量的高温气体,并从火箭尾部喷出。引燃后的高温气体有CO2、H2O、H2、NO等成分,这些气体均为无色。但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成NO2
D.NO与H2O反应生成NO2
6.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液加以区别的一种试剂是( )
A.BaCl2 B.Ba(OH)2
C.Ba(NO3)2 D.NaOH
7.A、B、C、D、E是含有一种相同元素的五种无机物,在一定条件下发生如下所示的转化。其中A为单质,B是气体,C、D是氧化物,E是最高价氧化物的水化物,则A可能是( )
①Cl2 ②N2 ③S ④H2
A.①③ B.①④ C.②③ D.②④
8.下列关于硝酸的说法中错误的是( )
A.硝酸具有强氧化性
B.硝酸是一种重要的化工原料,可用于制造炸药
C.稀硝酸和较活泼的金属反应,一般不生成氢气
D.稀硝酸跟铜反应,N的化合价由+5降为+2;浓硝酸跟铜反应,N的化合价只能由+5降为+4,可见稀硝酸的氧化性比浓硝酸强
9.已知NaHSO4+NaOH===Na2SO4+H2O;H2SO4+NaOH(不足量)===NaHSO4+H2O。A~E均为含硫的化合物,且能发生下列变化:
①A+NaOH―→B+H2O
②B+O2―→D
③C+NaOH―→D+H2O
④E+NaOH(不足)―→C+H2O
由此推测(填化学式):A________,B________,C________,D________,E________。
10.将红热的固体单质甲放入显黄色的溶液乙中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。
(1)推导出各物质的化学式:甲____________,乙____________,丙____________,A____________,B____________,C____________,D____________。
(2)写出甲跟乙反应的化学方程式: ________________________________________
__________________。
11.为了测定某铜银合金的成分,将30.0 g合金溶于80 mL 12.5 mol·L-1的浓硝酸中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液中的c(H+)=1 mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
本专题复习课
课后作业
1.C [酸雨产生的原因在工业城市中主要是由含硫煤的燃烧引起的,对煤进行脱硫处理,少用原煤作燃料,开发新能源,都能减少SO2排放。燃煤时鼓入足量空气只能使煤充分燃烧,无法减少SO2的排放。]
2.D [Cu与稀H2SO4不反应,在加热条件下Cu和浓H2SO4发生反应;浓度不同,发生的化学反应不同,在具体分析、计算时应注意。]
3.C [硫元素有多种可变化合价,在化学反应中硫元素的化合价降低时,表现为氧化性,在化学反应中硫元素的化合价升高时,表现为还原性。A选项SO2和H2S中均含硫元素,但是H2S中硫元素体现的是还原性,所以A错误;B选项中体现的是还原性;D选项中硫酸体现氧化性,但不是硫元素,而是氢元素。]
4.C [本题主要考查SO2、H2SO4、亚硫酸盐的性质,吸入少量浓硫酸后与Na2SO3反应生成SO2,SO2使湿润的蓝色石蕊试纸变红,但不能褪色,因为H2SO3没有强氧化性,SO2、H2SO3也不能漂白酸碱指示剂,所以A项错;SO2使酸性KMnO4溶液褪色,是SO2的还原性,而不是漂白性,所以B项错;NaCl溶液不能有效地除去SO2,因为它们不反应,H2SO3不稳定,有挥发性,所以D项也错。C项对。]
5.B [O2与N2在放电或极高温度条件下反应生成NO,而不生成NO2。NO与O2在常温下即发生反应生成NO2,NO2气体的颜色是红棕色。CO2的氧化性很弱,不能氧化NO。NO与H2O不发生化学反应。]
6.B [检验NH用OH-;检验SO用Ba2+。所以此题选用Ba(OH)2。]
7.C
8.D [氧化性或还原性的强弱不能看得失电子的多少,而要看它们得失电子的难易。浓、稀硝酸分别与铜反应时,明显浓硝酸反应的快。所以浓硝酸氧化性比稀硝酸强。]
9.SO2(或H2SO3) Na2SO3 NaHSO4 Na2SO4 H2SO4
解析 A、B、C、D、E均为含硫化合物,由①可知A可能是SO2或H2SO3或H2SO4,B为Na2SO3或Na2SO4,由②知B中S的化合价比D中低,则B为Na2SO3,D为Na2SO4;由③和④知C为NaHSO4,E为H2SO4,则A为SO2或H2SO3。
10.(1)C 浓HNO3 Cu CO2和NO2 CaCO3 NO
Cu(NO3)2 (2)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
解析 从A发生的变化可推知,A与水反应生成的气体中含有CO2及难溶于水的无色气体;A与水反应得到的无色溶液能与单质丙反应,并有蓝
色溶液产生,这一溶液可以推知含有Cu2+,则A与水反应生成的无色溶液中含有强氧化性物质,为HNO3;由此,可以推断A中含有NO2和CO2。生成A的反应应该为在溶有NO2的浓硝酸中投入了灼热的碳,二者反应生成了NO2、CO2和H2O。所以,甲为碳,乙为浓硝酸,丙为金属铜,A为CO2和NO2,C为NO,B为CaCO3,D为Cu(NO3)2。
11.(1)0.3 mol (2)50.4%
解析 (1)硝酸被还原生成NO和NO2气体,因此产生的气体的物质的量即是被还原硝酸的物质的量。
n=6.72 L/22.4 L·mol-1=0.3 mol
(2)c(H+)=1 mol·L-1,说明HNO3过量。参加反应的硝酸为11.5 mol·L-1×0.08 L=0.92 mol,设合金中Ag为x mol,Cu为y mol,又由N元素守恒则有
,解得
w(Ag)=×100%=46.8%
本专题复习课
一、硫元素单质及其化合物间的转化关系
1.SO2
2.H2SO4
3.硫及其化合物的转化关系
你能写出有关转化的化学方程式或离子方程式吗?并分析有关的氧化还原反应。
二、氮元素单质及其化合物间的转化关系
1.氮氧化物
2.
3.氮及其化合物间的转化关系
你能写出有关转化的化学方程式或离子方程式吗?并分析有关的氧化还原反应。
1.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理
②少用原煤作燃料 ③燃煤时鼓入足量空气 ④开发清洁能源。其中能减少酸雨产生的措施是( )
A.①②③ B.②③④ C.①②④ D.①③④
2.向50 mL 18 mol·L-1的H2SO4中加入足量的Cu片并加热,被还原的H2SO4的物质的量是( )
A.等于0.9 mol
B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol
D.小于0.45 mol
3.下列反应中硫元素只体现了氧化性的是( )
A.SO2+2H2S===3S↓+2H2O
B.2SO2+O22SO3
C.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
D.Zn+H2SO4===ZnSO4+H2↑
4.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2有漂白性
C.湿润淀粉碘化钾试纸未变蓝说明SO2的氧化性弱于I2
D.NaCl溶液可用于除去实验中多余的SO2
5.我国“神舟七号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量的高温气体,并从火箭尾部喷出。引燃后的高温气体有CO2、H2O、H2、NO等成分,这些气体均为无色。但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成NO2
D.NO与H2O反应生成NO2
6.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液加以区别的一种试剂是( )
A.BaCl2 B.Ba(OH)2
C.Ba(NO3)2 D.NaOH
7.A、B、C、D、E是含有一种相同元素的五种无机物,在一定条件下发生如下所示的转化。其中A为单质,B是气体,C、D是氧化物,E是最高价氧化物的水化物,则A可能是( )
①Cl2 ②N2 ③S ④H2
A.①③ B.①④ C.②③ D.②④
8.下列关于硝酸的说法中错误的是( )
A.硝酸具有强氧化性
B.硝酸是一种重要的化工原料,可用于制造炸药
C.稀硝酸和较活泼的金属反应,一般不生成氢气
D.稀硝酸跟铜反应,N的化合价由+5降为+2;浓硝酸跟铜反应,N的化合价只能由+5降为+4,可见稀硝酸的氧化性比浓硝酸强
9.已知NaHSO4+NaOH===Na2SO4+H2O;H2SO4+NaOH(不足量)===NaHSO4+H2O。A~E均为含硫的化合物,且能发生下列变化:
①A+NaOH―→B+H2O
②B+O2―→D
③C+NaOH―→D+H2O
④E+NaOH(不足)―→C+H2O
由此推测(填化学式):A________,B________,C________,D________,E________。
10.将红热的固体单质甲放入显黄色的溶液乙中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。
(1)推导出各物质的化学式:甲____________,乙____________,丙____________,A____________,B____________,C____________,D____________。
(2)写出甲跟乙反应的化学方程式: ________________________________________
__________________。
11.为了测定某铜银合金的成分,将30.0 g合金溶于80 mL 12.5 mol·L-1的浓硝酸中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液中的c(H+)=1 mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
本专题复习课
课后作业
1.C [酸雨产生的原因在工业城市中主要是由含硫煤的燃烧引起的,对煤进行脱硫处理,少用原煤作燃料,开发新能源,都能减少SO2排放。燃煤时鼓入足量空气只能使煤充分燃烧,无法减少SO2的排放。]
2.D [Cu与稀H2SO4不反应,在加热条件下Cu和浓H2SO4发生反应;浓度不同,发生的化学反应不同,在具体分析、计算时应注意。]
3.C [硫元素有多种可变化合价,在化学反应中硫元素的化合价降低时,表现为氧化性,在化学反应中硫元素的化合价升高时,表现为还原性。A选项SO2和H2S中均含硫元素,但是H2S中硫元素体现的是还原性,所以A错误;B选项中体现的是还原性;D选项中硫酸体现氧化性,但不是硫元素,而是氢元素。]
4.C [本题主要考查SO2、H2SO4、亚硫酸盐的性质,吸入少量浓硫酸后与Na2SO3反应生成SO2,SO2使湿润的蓝色石蕊试纸变红,但不能褪色,因为H2SO3没有强氧化性,SO2、H2SO3也不能漂白酸碱指示剂,所以A项错;SO2使酸性KMnO4溶液褪色,是SO2的还原性,而不是漂白性,所以B项错;NaCl溶液不能有效地除去SO2,因为它们不反应,H2SO3不稳定,有挥发性,所以D项也错。C项对。]
5.B [O2与N2在放电或极高温度条件下反应生成NO,而不生成NO2。NO与O2在常温下即发生反应生成NO2,NO2气体的颜色是红棕色。CO2的氧化性很弱,不能氧化NO。NO与H2O不发生化学反应。]
6.B [检验NH用OH-;检验SO用Ba2+。所以此题选用Ba(OH)2。]
7.C
8.D [氧化性或还原性的强弱不能看得失电子的多少,而要看它们得失电子的难易。浓、稀硝酸分别与铜反应时,明显浓硝酸反应的快。所以浓硝酸氧化性比稀硝酸强。]
9.SO2(或H2SO3) Na2SO3 NaHSO4 Na2SO4 H2SO4
解析 A、B、C、D、E均为含硫化合物,由①可知A可能是SO2或H2SO3或H2SO4,B为Na2SO3或Na2SO4,由②知B中S的化合价比D中低,则B为Na2SO3,D为Na2SO4;由③和④知C为NaHSO4,E为H2SO4,则A为SO2或H2SO3。
10.(1)C 浓HNO3 Cu CO2和NO2 CaCO3 NO
Cu(NO3)2 (2)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
解析 从A发生的变化可推知,A与水反应生成的气体中含有CO2及难溶于水的无色气体;A与水反应得到的无色溶液能与单质丙反应,并有蓝
色溶液产生,这一溶液可以推知含有Cu2+,则A与水反应生成的无色溶液中含有强氧化性物质,为HNO3;由此,可以推断A中含有NO2和CO2。生成A的反应应该为在溶有NO2的浓硝酸中投入了灼热的碳,二者反应生成了NO2、CO2和H2O。所以,甲为碳,乙为浓硝酸,丙为金属铜,A为CO2和NO2,C为NO,B为CaCO3,D为Cu(NO3)2。
11.(1)0.3 mol (2)50.4%
解析 (1)硝酸被还原生成NO和NO2气体,因此产生的气体的物质的量即是被还原硝酸的物质的量。
n=6.72 L/22.4 L·mol-1=0.3 mol
(2)c(H+)=1 mol·L-1,说明HNO3过量。参加反应的硝酸为11.5 mol·L-1×0.08 L=0.92 mol,设合金中Ag为x mol,Cu为y mol,又由N元素守恒则有
,解得
w(Ag)=×100%=46.8%
