第 十 单元 课题 1 常见的酸和碱 第 2课时
文档属性
| 名称 | 第 十 单元 课题 1 常见的酸和碱 第 2课时 |
|
|
| 格式 | zip | ||
| 文件大小 | 267.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-08-31 00:00:00 | ||
图片预览


文档简介
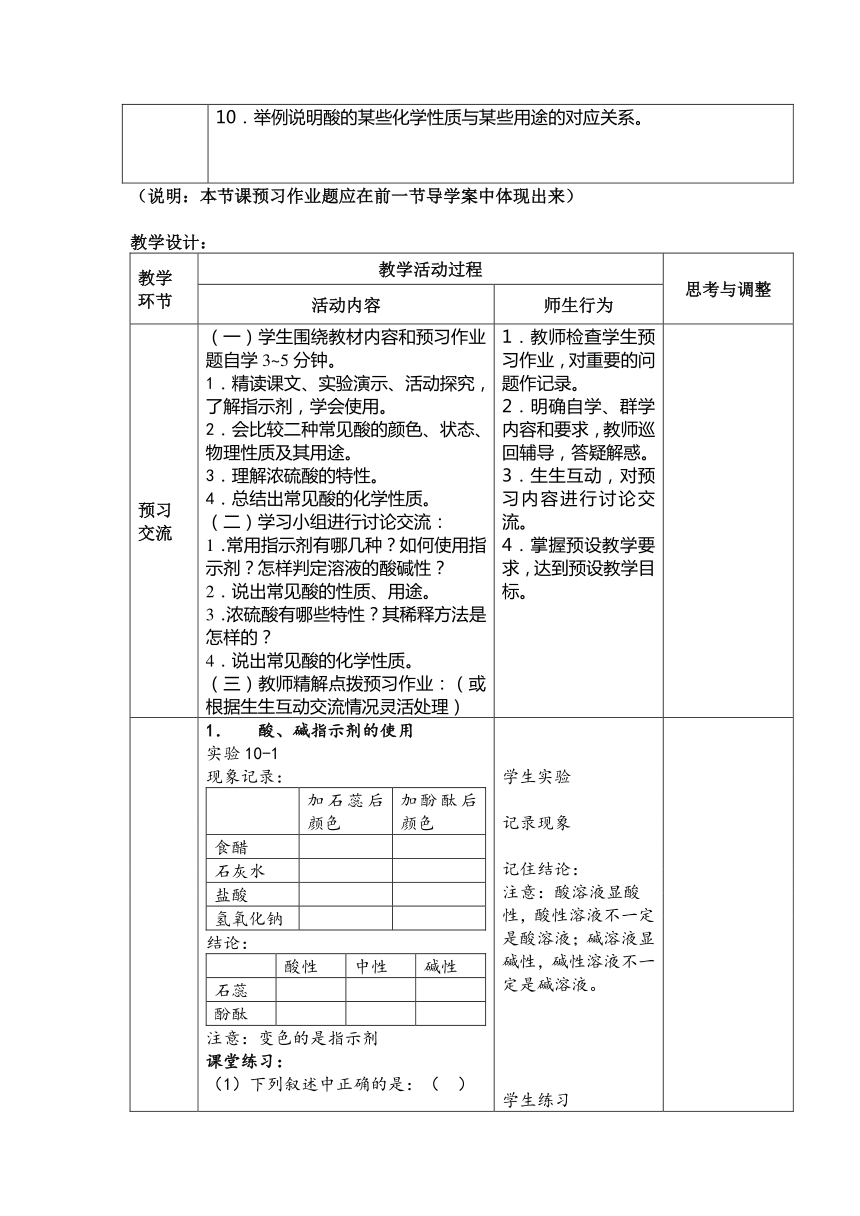
第 十 单元 课题 1 常见的酸和碱 第 2课时 总第 个教案
主备人:天汾中学 邓廷木 审核人:
学习目标 1、会使用酸碱指示剂;认识几种常见的酸;认识浓硫酸的特性及稀释方法;认识酸常见的一些化学性质。2、注重化学实验探究,运用师生合作展示交流方法,加深对本节知识点的理解及规律的记忆。3、创设问题情境,增强学生探究问题的好奇心和求知欲
学习重点 会用指示剂;浓硫酸的特性;酸的几点化学性质
学习难点 掌握酸的几点化学性质
教具学具 书本实验10-(1~6)所需实验仪器与器材,小黑板,实物投影仪等
本节课预习作业题 1.取四朵用石蕊试剂染成紫色的干燥纸花进行如下操作,能够观察到纸花变红的是A.喷石灰水 B.直接喷水C.直接放入CO2中 D.喷水后放入CO2中 2.石蕊和酚酞溶液称_______剂。紫色石蕊试液遇酸溶液变成_____色,遇碱溶液变成________色。无色酚酞试液遇酸溶液_______色,遇碱溶液变成___色。3.浓硫酸具有强烈的_______性,它能夺取_______、_______、_______、皮肤里的水分,生成黑色的炭。因此,使用浓硫酸时应__________________________。4.下列图示的实验操作正确的是( )5.人的胃液中含有________,可以帮助___________。6.浓硫酸具有___________性,实验室常用作_______剂。7.如果不慎将浓硫酸沾到皮肤或衣服上,应立即用________8.在空气中敞放下列物质,质量会增重的是 ( ) A.浓盐酸 B.浓硫酸 C.食醋 D.食盐水9.酸有一些相似的化学性质。(1)酸能使紫色石蕊试液变成_____色,但不能使无色酚酞试液________。(2)酸能与___________反应,生成________________。如:_____________。(3)酸能与___________反应,生成________________。如:_____________。10.举例说明酸的某些化学性质与某些用途的对应关系。
(说明:本节课预习作业题应在前一节导学案中体现出来)
教学设计:
教学环节 教学活动过程 思考与调整
活动内容 师生行为
预习交流 (一)学生围绕教材内容和预习作业题自学3~5分钟。1.精读课文、实验演示、活动探究,了解指示剂,学会使用。2.会比较二种常见酸的颜色、状态、物理性质及其用途。3.理解浓硫酸的特性。4.总结出常见酸的化学性质。(二)学习小组进行讨论交流:1.常用指示剂有哪几种?如何使用指示剂?怎样判定溶液的酸碱性?2.说出常见酸的性质、用途。3.浓硫酸有哪些特性?其稀释方法是怎样的?4.说出常见酸的化学性质。(三)教师精解点拨预习作业:(或根据生生互动交流情况灵活处理) 1.教师检查学生预习作业,对重要的问题作记录。2.明确自学、群学内容和要求,教师巡回辅导,答疑解惑。3.生生互动,对预习内容进行讨论交流。4.掌握预设教学要求,达到预设教学目标。
展示探究 酸、碱指示剂的使用实验10-1现象记录:加石蕊后颜色加酚酞后颜色食醋石灰水盐酸氢氧化钠结论:酸性中性碱性石蕊酚酞注意:变色的是指示剂课堂练习:(1)下列叙述中正确的是:( )A.盐酸遇石蕊试剂就可以变成红色B.酚酞可以使稀硫酸变红色C.用石蕊试剂可以鉴别盐酸和硫酸D.用酚酞试剂可以区别稀硫酸和氢氧化钠溶液(2)桌子上有一瓶失去标签的无色溶液,请你对该溶液的酸碱性提出猜想,并用实验对你的猜想进行验证。猜想操作现象分析结论(3)为什么不同的酸溶液都能使石蕊变红,使无色的酚酞不变色呢?同样不同的碱溶液都能使石蕊变蓝,使无色的酚酞试液变红呢?(4)下列物质中,不属于酸的是( )A.HNO3 B.H2SO4 C.AgNO3 D.H3PO42.浓盐酸、浓硫酸的物理性质实验10-2现象记录:浓盐酸浓硫酸颜色、状态打开瓶盖现象原因气味敞口放置现象原因课堂练习:敞口放置的浓硫酸和浓盐酸,一段时间后,溶质的质量分数将如何变化?原因是什么,试分析?3.浓硫酸特性实验10-3现象记录:结论:浓硫酸有吸水性,脱水性,腐蚀性 浓硫酸是某些常见气体(如:O2、CO2等气体)的液体干燥剂实验10-4:现象:结论:稀释浓硫酸时要注意什么?注意:一定要将浓硫酸沿着容器壁(忌往量筒中倒)慢慢倒入水中并不断地用玻璃棒搅拌,切不可将水倒入浓硫酸中。4.探究常见酸的化学性质实验10-6对常见酸的化学性质进行规律的揭示与总结。酸与指示剂反应。酸与活泼金属反应。酸与金属氧化物反应。课堂练习:1.盐酸、硫酸、醋酸等同属于酸,它们具有相似的化学性质的原因是()A.都含有氢离子 B.都含有酸根离子C.都含有金属离子D.都含有氢氧根离子2.下列用途中利用了物质的化学性质的是 ( )用稀盐酸除铁锈B.用干冰进行人工降雨C.用金刚石切割玻璃D.用活性炭吸附毒气 学生实验记录现象记住结论:注意:酸溶液显酸性,酸性溶液不一定是酸溶液;碱溶液显碱性,碱性溶液不一定是碱溶液。学生练习学生猜想,实验注意与金属导电性进行比较,分析二者间的差异。结论:1.存在着可以自由移动的带电的离子2. 酸溶液中都有氢离子,碱溶液中都有氢氧根离子。学生练习学生观察现象将刚上课时敞口放置的浓盐酸和浓硫酸再进行称量,并与之前原有的质量进行比较,记录并分析原因。请学生思考,为什么?教师演示实验学生观察学生分组实验学生观察记住现象,规律,注意事项。教师注意对解题规律的总结、归纳与点拨。
检测反馈 当堂检测:1.请用最简单的方法区别浓盐酸和浓硫酸。2.一朵牵牛花,清晨呈粉红色,下午变蓝紫色。这是由于牵牛花中含有一种遇酸变红,遇碱变蓝的色素。牵牛花在清晨呈粉红色是因为经过一夜的呼吸作用,细胞内的 含量增高,细胞液呈酸性;白天由于 作用,细胞内 含量降低,该色素的这种性质在实验中与常用的__________指示剂性质相似。3.写出稀硫酸分别与金属镁、铁、锌、铝反应的方程式。4.写出稀盐酸除铁锈的化学方程式。 1.教师布置检测题,巡回查看学生答题情况,当堂批阅,统计差错及目标达成率。第2、3题让学生自行纠正。教师重点讲评第1、4题,对学生不同的方法进行实物展示,交流点评。
课堂评价小结 总结酸碱与指示剂反应的变色规律。总结常见酸的性质、用途。总结浓硫酸的特性及稀释方法。总结常见酸的几点化学性质。
课后作业 1.若将氧气和二氧化碳两种无色气体区别开来,下列方法中不可行的是 ( )A.分别通人澄清的石灰水中 B.分别通人滴有紫色石蕊试液的水中 C.将带火星的小木条分别插入到两瓶气体中 D.分别通人蒸馏水中2.某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将 沿器壁缓慢注入 中,并不断搅拌以防液体飞溅。3.青色的生虾煮熟后颜色会变成红色。一些同学认为这种红色物质可能就象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这些同学的看法而言应属于科学探究中的 ( )A.实验 B.假设 C.观察 D.做结论4.化学课上,在氢氧化钠溶液与稀硫酸能否发生反应的实验中,小宇同学发现向氢氧化钠溶液中滴加几滴酚酞试液,溶液变红色,当向该溶液中连续滴加稀硫酸,溶液红色又褪去。(1)根据实验现象,你认为氢氧化钠溶液与稀硫酸 (填“能”或“不能”)发生化学反应,理由是有 。(2)针对上述实验,你还想探究的问题是有 。5.国家环保总局已规定将各类实验室纳入环保监管范围。某中学九年级甲、乙两个班的同学分别做常见酸和碱与指示剂反应的实验,所做的实验和使用的试剂如图所示。实验后废液分别集中到各班的废液缸中,甲班废液呈红色,乙班废液呈蓝色。(1)请你分析废液的成分:甲班废液含有 ;乙班废液中含有 。(2)目前许多高校、中学以及科研单位的化学实验室排放的各类废液大都未经严格处理便进入了下水道。甲班的废液若直接排入铸铁管下水道,会造成什么危害 ;你建议如何处理甲班的废液 _______________________。
预习作业 一、基本概念:1.稀硫酸和稀盐酸都能使石蕊试液变 ,使酚酞变 ,因为它们的溶液中都含有 。2.现有两只规格相同未贴标签的试剂瓶,分别装有相同体积的浓盐酸和浓硫酸。请你用三种不同的方法将它们区别开来。方法现象和结论①②③3.某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见右图)。分析图像得到的以下结论中, 一定正确的是:A.金属甲比金属乙活泼B.金属甲比金属乙的相对原子质量大C.金属乙比金属甲的反应速率大D.金属乙比金属甲的化合价高二、实验探究4.小明在一次实验中将带有铁锈的铁片放入一定量的稀硫酸中,观察发现下列现象:①铁锈逐渐消失,溶液变为黄色;②铁片表面有气泡产生,溶液由黄色逐渐变为浅绿色。回答下列问题:(1)写出现象①的化学反应方程式__________________.(2)写出现象②中产生气泡的化学方程式_______________________。(3)为了弄清溶液由黄色变为浅绿色的原因,请你帮助小明设计探究方案。(简略写出实验内容)5.①下列两个方案都可以除去铜粉中少量的CuO,从环境保护和操作简便等方面考虑,较好的方案是 (填a或b)。 a.用稀HCl除去CuO b.用CO还原CuO6.老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如下图所示(部分生成物已略去)。 ①紫红色固体C的化学式为_______________________________;②写出II中反应的化学方程式_____________________________。三、化学计算8.称取铜、锌混合物粉末10.0 g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0 g稀硫酸。剩余固体3.5 g。⑴ 该混合物粉末中铜的质量分数为多少 ⑵ 所用的稀硫酸溶质的质量分数是多少
O 反应时间/s
甲 乙
氢气的质量\g
主备人:天汾中学 邓廷木 审核人:
学习目标 1、会使用酸碱指示剂;认识几种常见的酸;认识浓硫酸的特性及稀释方法;认识酸常见的一些化学性质。2、注重化学实验探究,运用师生合作展示交流方法,加深对本节知识点的理解及规律的记忆。3、创设问题情境,增强学生探究问题的好奇心和求知欲
学习重点 会用指示剂;浓硫酸的特性;酸的几点化学性质
学习难点 掌握酸的几点化学性质
教具学具 书本实验10-(1~6)所需实验仪器与器材,小黑板,实物投影仪等
本节课预习作业题 1.取四朵用石蕊试剂染成紫色的干燥纸花进行如下操作,能够观察到纸花变红的是A.喷石灰水 B.直接喷水C.直接放入CO2中 D.喷水后放入CO2中 2.石蕊和酚酞溶液称_______剂。紫色石蕊试液遇酸溶液变成_____色,遇碱溶液变成________色。无色酚酞试液遇酸溶液_______色,遇碱溶液变成___色。3.浓硫酸具有强烈的_______性,它能夺取_______、_______、_______、皮肤里的水分,生成黑色的炭。因此,使用浓硫酸时应__________________________。4.下列图示的实验操作正确的是( )5.人的胃液中含有________,可以帮助___________。6.浓硫酸具有___________性,实验室常用作_______剂。7.如果不慎将浓硫酸沾到皮肤或衣服上,应立即用________8.在空气中敞放下列物质,质量会增重的是 ( ) A.浓盐酸 B.浓硫酸 C.食醋 D.食盐水9.酸有一些相似的化学性质。(1)酸能使紫色石蕊试液变成_____色,但不能使无色酚酞试液________。(2)酸能与___________反应,生成________________。如:_____________。(3)酸能与___________反应,生成________________。如:_____________。10.举例说明酸的某些化学性质与某些用途的对应关系。
(说明:本节课预习作业题应在前一节导学案中体现出来)
教学设计:
教学环节 教学活动过程 思考与调整
活动内容 师生行为
预习交流 (一)学生围绕教材内容和预习作业题自学3~5分钟。1.精读课文、实验演示、活动探究,了解指示剂,学会使用。2.会比较二种常见酸的颜色、状态、物理性质及其用途。3.理解浓硫酸的特性。4.总结出常见酸的化学性质。(二)学习小组进行讨论交流:1.常用指示剂有哪几种?如何使用指示剂?怎样判定溶液的酸碱性?2.说出常见酸的性质、用途。3.浓硫酸有哪些特性?其稀释方法是怎样的?4.说出常见酸的化学性质。(三)教师精解点拨预习作业:(或根据生生互动交流情况灵活处理) 1.教师检查学生预习作业,对重要的问题作记录。2.明确自学、群学内容和要求,教师巡回辅导,答疑解惑。3.生生互动,对预习内容进行讨论交流。4.掌握预设教学要求,达到预设教学目标。
展示探究 酸、碱指示剂的使用实验10-1现象记录:加石蕊后颜色加酚酞后颜色食醋石灰水盐酸氢氧化钠结论:酸性中性碱性石蕊酚酞注意:变色的是指示剂课堂练习:(1)下列叙述中正确的是:( )A.盐酸遇石蕊试剂就可以变成红色B.酚酞可以使稀硫酸变红色C.用石蕊试剂可以鉴别盐酸和硫酸D.用酚酞试剂可以区别稀硫酸和氢氧化钠溶液(2)桌子上有一瓶失去标签的无色溶液,请你对该溶液的酸碱性提出猜想,并用实验对你的猜想进行验证。猜想操作现象分析结论(3)为什么不同的酸溶液都能使石蕊变红,使无色的酚酞不变色呢?同样不同的碱溶液都能使石蕊变蓝,使无色的酚酞试液变红呢?(4)下列物质中,不属于酸的是( )A.HNO3 B.H2SO4 C.AgNO3 D.H3PO42.浓盐酸、浓硫酸的物理性质实验10-2现象记录:浓盐酸浓硫酸颜色、状态打开瓶盖现象原因气味敞口放置现象原因课堂练习:敞口放置的浓硫酸和浓盐酸,一段时间后,溶质的质量分数将如何变化?原因是什么,试分析?3.浓硫酸特性实验10-3现象记录:结论:浓硫酸有吸水性,脱水性,腐蚀性 浓硫酸是某些常见气体(如:O2、CO2等气体)的液体干燥剂实验10-4:现象:结论:稀释浓硫酸时要注意什么?注意:一定要将浓硫酸沿着容器壁(忌往量筒中倒)慢慢倒入水中并不断地用玻璃棒搅拌,切不可将水倒入浓硫酸中。4.探究常见酸的化学性质实验10-6对常见酸的化学性质进行规律的揭示与总结。酸与指示剂反应。酸与活泼金属反应。酸与金属氧化物反应。课堂练习:1.盐酸、硫酸、醋酸等同属于酸,它们具有相似的化学性质的原因是()A.都含有氢离子 B.都含有酸根离子C.都含有金属离子D.都含有氢氧根离子2.下列用途中利用了物质的化学性质的是 ( )用稀盐酸除铁锈B.用干冰进行人工降雨C.用金刚石切割玻璃D.用活性炭吸附毒气 学生实验记录现象记住结论:注意:酸溶液显酸性,酸性溶液不一定是酸溶液;碱溶液显碱性,碱性溶液不一定是碱溶液。学生练习学生猜想,实验注意与金属导电性进行比较,分析二者间的差异。结论:1.存在着可以自由移动的带电的离子2. 酸溶液中都有氢离子,碱溶液中都有氢氧根离子。学生练习学生观察现象将刚上课时敞口放置的浓盐酸和浓硫酸再进行称量,并与之前原有的质量进行比较,记录并分析原因。请学生思考,为什么?教师演示实验学生观察学生分组实验学生观察记住现象,规律,注意事项。教师注意对解题规律的总结、归纳与点拨。
检测反馈 当堂检测:1.请用最简单的方法区别浓盐酸和浓硫酸。2.一朵牵牛花,清晨呈粉红色,下午变蓝紫色。这是由于牵牛花中含有一种遇酸变红,遇碱变蓝的色素。牵牛花在清晨呈粉红色是因为经过一夜的呼吸作用,细胞内的 含量增高,细胞液呈酸性;白天由于 作用,细胞内 含量降低,该色素的这种性质在实验中与常用的__________指示剂性质相似。3.写出稀硫酸分别与金属镁、铁、锌、铝反应的方程式。4.写出稀盐酸除铁锈的化学方程式。 1.教师布置检测题,巡回查看学生答题情况,当堂批阅,统计差错及目标达成率。第2、3题让学生自行纠正。教师重点讲评第1、4题,对学生不同的方法进行实物展示,交流点评。
课堂评价小结 总结酸碱与指示剂反应的变色规律。总结常见酸的性质、用途。总结浓硫酸的特性及稀释方法。总结常见酸的几点化学性质。
课后作业 1.若将氧气和二氧化碳两种无色气体区别开来,下列方法中不可行的是 ( )A.分别通人澄清的石灰水中 B.分别通人滴有紫色石蕊试液的水中 C.将带火星的小木条分别插入到两瓶气体中 D.分别通人蒸馏水中2.某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将 沿器壁缓慢注入 中,并不断搅拌以防液体飞溅。3.青色的生虾煮熟后颜色会变成红色。一些同学认为这种红色物质可能就象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这些同学的看法而言应属于科学探究中的 ( )A.实验 B.假设 C.观察 D.做结论4.化学课上,在氢氧化钠溶液与稀硫酸能否发生反应的实验中,小宇同学发现向氢氧化钠溶液中滴加几滴酚酞试液,溶液变红色,当向该溶液中连续滴加稀硫酸,溶液红色又褪去。(1)根据实验现象,你认为氢氧化钠溶液与稀硫酸 (填“能”或“不能”)发生化学反应,理由是有 。(2)针对上述实验,你还想探究的问题是有 。5.国家环保总局已规定将各类实验室纳入环保监管范围。某中学九年级甲、乙两个班的同学分别做常见酸和碱与指示剂反应的实验,所做的实验和使用的试剂如图所示。实验后废液分别集中到各班的废液缸中,甲班废液呈红色,乙班废液呈蓝色。(1)请你分析废液的成分:甲班废液含有 ;乙班废液中含有 。(2)目前许多高校、中学以及科研单位的化学实验室排放的各类废液大都未经严格处理便进入了下水道。甲班的废液若直接排入铸铁管下水道,会造成什么危害 ;你建议如何处理甲班的废液 _______________________。
预习作业 一、基本概念:1.稀硫酸和稀盐酸都能使石蕊试液变 ,使酚酞变 ,因为它们的溶液中都含有 。2.现有两只规格相同未贴标签的试剂瓶,分别装有相同体积的浓盐酸和浓硫酸。请你用三种不同的方法将它们区别开来。方法现象和结论①②③3.某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见右图)。分析图像得到的以下结论中, 一定正确的是:A.金属甲比金属乙活泼B.金属甲比金属乙的相对原子质量大C.金属乙比金属甲的反应速率大D.金属乙比金属甲的化合价高二、实验探究4.小明在一次实验中将带有铁锈的铁片放入一定量的稀硫酸中,观察发现下列现象:①铁锈逐渐消失,溶液变为黄色;②铁片表面有气泡产生,溶液由黄色逐渐变为浅绿色。回答下列问题:(1)写出现象①的化学反应方程式__________________.(2)写出现象②中产生气泡的化学方程式_______________________。(3)为了弄清溶液由黄色变为浅绿色的原因,请你帮助小明设计探究方案。(简略写出实验内容)5.①下列两个方案都可以除去铜粉中少量的CuO,从环境保护和操作简便等方面考虑,较好的方案是 (填a或b)。 a.用稀HCl除去CuO b.用CO还原CuO6.老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如下图所示(部分生成物已略去)。 ①紫红色固体C的化学式为_______________________________;②写出II中反应的化学方程式_____________________________。三、化学计算8.称取铜、锌混合物粉末10.0 g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0 g稀硫酸。剩余固体3.5 g。⑴ 该混合物粉末中铜的质量分数为多少 ⑵ 所用的稀硫酸溶质的质量分数是多少
O 反应时间/s
甲 乙
氢气的质量\g
同课章节目录
