人教版高中化学必修一2.2-离子反应(共25张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.2-离子反应(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 801.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 15:29:01 | ||
图片预览








文档简介
(共25张PPT)
第二节
离
子
反
应
一、酸、碱、盐在水溶液中的电离
1、电解质
(1)定义:
(2)注意事项:
①电解质必须是化合物
②化合物不一定都是电解质
③能导电的物质不一定都是电解质
在水溶液里或熔化状态下能导电的
化合物
如:H2SO4、
NaOH、
KCl
、Na2O
范围:酸、碱、盐、活泼金属氧化物
2、非电解质
定义:
如:蔗糖、C2H5OH、CO2、SO2、NH3等
在水溶液里和熔化状态下都不能导电的化合物
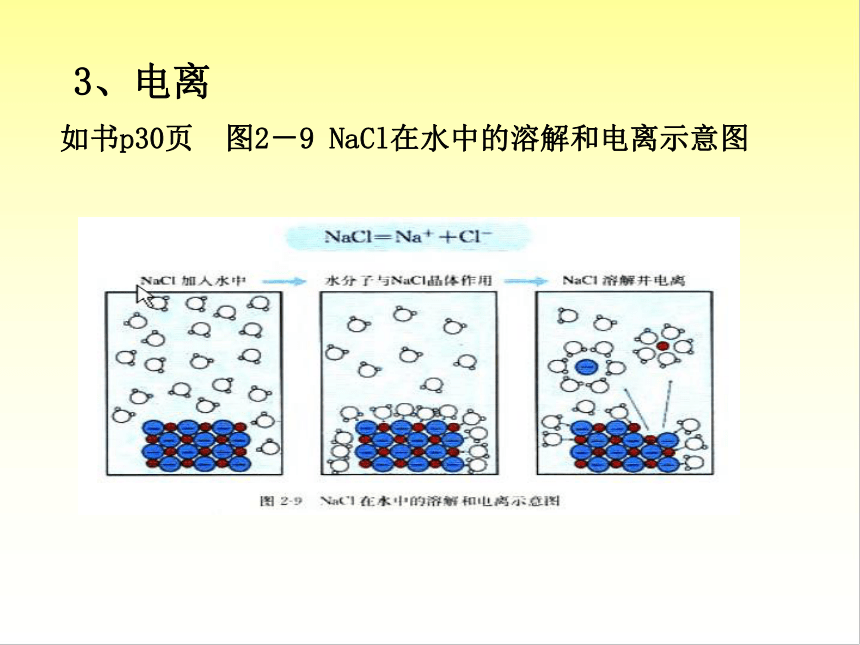
3、电离
(1)定义:
电解质溶解于水或受热熔化时,离解
成自由移动的离子的过程。
3、电离
如书p30页
图2-9
NaCl在水中的溶解和电离示意图
(2)、电离方程式
定义:用离子符号表示电解质电离的式子
如:NaCl
=
Na++Cl-
HCl
=
H++Cl-
H2SO4
=
2H++SO42-
HNO3
=
H++NO3-
练习:写出下列物质的电离方程式
①氢氧化钠②氢氧化钡③氢氧化钙④氯化镁⑤硫酸铜
⑥碳酸钠
⑦硫酸钾
⑧氯化铁
⑨碳酸铵
⑩硫酸氢钠
(3)注意事项:
①电离是电解质导电的前提条件
②电解质必须是自身能电离成自由移动离子
的化合物
【问题】
为什么NaCl晶体不导电?NaCl溶液可以导电?
自由移动的水合钠离子和水合氯离子
所以:CO2
SO2
NH3是非电解质
4、从电离的角度概括酸、碱、盐
电解质电离时生成的阳离子全部是氢离子(H+)的化合物
HCl
H2SO4
NaOH
Ca(OH)2
NaCl
NH4NO3
电解质电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
电解质电离时生成的阳离子是金属离子或铵根离子(NH4+),阴离子是酸根离子的化合物
练习:
①Cu②NaCl③NaHSO4④SO3⑤H2SO4⑥C2H5OH⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩Fe(OH)3?NaOH?NH3·H20
请按下列分类标准回答问题:
(1)属于电解质的是:
,
(2)能电离H+的是:
,
以下中学化学常见的物质:
(3)属于酸的是:
,
(4)属于碱的是:
,
(5)属于难溶性盐的是:
,
【实验探究】
【实验2-1】
p31页
向CuSO4溶液里加入BaCl2溶液
【分析】
CuSO4=Cu2+
+
SO42-
BaCl2=Ba2+
+
2Cl-
CuCl2=Cu2++2Cl-
CuSO4+BaCl2=CuCl2+BaSO4↓
Cu2++SO42-+Ba2++2Cl-=Cu2++2Cl-+BaSO4↓
Ba2++SO42+=BaSO4↓
1、离子反应
二、离子反应及其发生的条件
(1)、定义:
有离子参加或生成的反应
(2)、离子反应的特点:
离子反应总是向着某种离子浓度减小的方向进行
如:向稀HCl中加入AgNO3溶液
再如:实验室制取CO2
2、离子方程式
(1)、定义:用实际参加反应的离子符号
来表示反应的式子
【探究】
【实验2-2】
p32页表格
(2)、离子方程式的意义
离子方程式不仅可以表示某一具体的化学反应,而且还可以表示同一类型的离子反应。
3、离子方程式的书写
(1)写:
写出反应的化学方程式
(2)拆:
把易溶于水、易电离的物质拆成离子形式(强酸、强碱、可溶性盐)
(难溶的物质、气体和水仍用化学式表示)
把不参加反应的离子从方程式两端删去
检查方程式两端各元素的原子个数和电荷数是否相等
(3)删:
(4)查:
如:Cu(OH)2和稀HCl
练习:
完成下列化学方程式,并改写为离子方程式
①硫酸和氢氧化钠
②碳酸钾和盐酸
③硫酸钠和氯化钡
④盐酸和氢氧化钾
⑤碳酸钠和盐酸
⑥硫酸钾和硝酸钡
⑦硫酸和氢氧化钾
⑧碳酸钠和硫酸
⑨硫酸镁和氯化钡
4、离子反应发生的条件
(1)生成难溶于水的物质
(2)生成难电离的物质
(H2O、弱酸、弱碱等)
(3)生成易挥发性的物质(气体)
如:硝酸银溶液和氯化钠溶液
如:硫酸和氢氧化钠溶液
如:碳酸钙和稀盐酸
三、离子方程式正误判断
1、以客观事实为依据
如:铁与稀盐酸反应
2Fe+6H+
=
2Fe3++3H2↑
2、以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+
=
Al3++H2↑
3、以电荷守恒为依据
如:2FeCl3+Fe
=
3FeCl2
(正确)
Fe3++Fe
=
2Fe2+
(错误)
4、以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+
=
H2O+CO2↑
BaCO3+2H+
=
Ba2++H2O+CO2↑
√
5、以物质的组成为依据
如:氢氧化钡和稀硫酸
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
√
6、注意物质的状态,是否漏写
如:碳酸钾和稀盐酸
CO32-+2H+
=
H2O+CO2
↑
√
练习1:写出有关反应的化学方程式
(1)CO32-+2H+=H2O+CO2↑
(2)Cu2++2OH-=Cu(OH)2↓
(3)Zn+2H+=Zn2++H2↑
(1)
+
2Ag+
=
+
2Ag,
(2)Fe2O3+
=
2Fe3++
,
(3)CaCO3+
=
CO2↑+
+
,
练习2:完成离子反应并改写成化学方程式
练习3:下列离子方程式正确的是(
)
A:铝和稀硫酸
Al+2H+=Al3++H2↑
B:石灰石和盐酸
CO32-+2H+=CO2↑+H2O
C:氢氧化钡和稀硫酸
H++OH-=H2O
D:铜和硝酸银溶液
Cu+Ag+=Cu2++Ag
E:澄清的石灰水和盐酸
H++OH-=H2O
F:碳酸钡和稀硫酸
BaCO3+2H+=Ba2++CO2↑+H2O
四、离子共存
(1)不能共存:离子间若发生下列反应之一
①生成难溶物或微溶物
如:
②生成气体或挥发性物质
如:
③生成难电离物质
如:
常见难电离的物质:
a
b
c
(2)隐含条件
①无色透明溶液中,不存在有色离子
如:
②弱酸的酸式根离子在较强的酸性和碱性条件下
如:HCO3-
、HSO3-
练习:在强酸性溶液中能大量共存且溶液为
无色透明的一组离子是(
)
A:Ca2+、Na+、NO3-、SO42-
B:Mg2+、Cl-、Al3+、SO42-
C:K+、Cl-、HCO3-、NO3-
D:Ca2+、Na+、Fe3+、NO3-
五、离子反应的应用
(1)、混合物的分离
(2)、物质的提纯
如:粗盐的提纯
如:分离铜粉和氧化铜粉末
(3)、物质的鉴别
如:有A、B、C三种无色溶液,只知是HCl
H2SO4
Ba(NO3)2三种物质的溶液的各一种。按一定顺序滴入Na2CO3溶液中至恰好完全反应,有一下现象:
①加入A时生成白色沉淀
②向①中沉淀加入B时沉淀溶解,并有气体逸出
③向②中生成的溶液中加入C时,又有白色沉淀生成
根据以上现象回答下列问题:
(1)判断A、B、C各是什么溶液?
A:
B:
C:
.
(2)有关反应的离子方程式:
①
,
②
,
③
。
Ba(NO3)2
HCl
H2SO4
Ba2++CO32-=BaCO3↓
BaCO3+2H+=Ba2++H2O+CO2↑
Ba2++SO42-=BaSO4↓
(4)化合物组成成分的分析和鉴定
如:如何对无色气体A的水溶液进行鉴定
步骤:取少量A的溶液,向其中加入少量的Na2CO3溶液,逸出无色、无味并使澄清的石灰水变浑浊的气体;
离子方程式:
,
则:阳离子是:
.
再向溶液中滴加用稀硝酸酸化的AgNO3溶液,生成白色沉淀。
离子方程式:
,
则:阴离子是:
.
综上可知:气体A是
。
H+
2H++CO32-=H2O+CO2↑
Cl-
Cl-+Ag+=AgCl↓
HCl
(5)治理水中的污染物
如:一种污水中含有KCl,另一种污水中含AgNO3
若将两种污水按适当的比例混合
Ag++Cl-=AgCl↓
将混合物的水经过过滤后再排放,不但消除了水的污染,而且还能回收AgCl。用这样的水浇灌农田又能增加肥料(K+
NO3-)
第三节
第二节
离
子
反
应
一、酸、碱、盐在水溶液中的电离
1、电解质
(1)定义:
(2)注意事项:
①电解质必须是化合物
②化合物不一定都是电解质
③能导电的物质不一定都是电解质
在水溶液里或熔化状态下能导电的
化合物
如:H2SO4、
NaOH、
KCl
、Na2O
范围:酸、碱、盐、活泼金属氧化物
2、非电解质
定义:
如:蔗糖、C2H5OH、CO2、SO2、NH3等
在水溶液里和熔化状态下都不能导电的化合物
3、电离
(1)定义:
电解质溶解于水或受热熔化时,离解
成自由移动的离子的过程。
3、电离
如书p30页
图2-9
NaCl在水中的溶解和电离示意图
(2)、电离方程式
定义:用离子符号表示电解质电离的式子
如:NaCl
=
Na++Cl-
HCl
=
H++Cl-
H2SO4
=
2H++SO42-
HNO3
=
H++NO3-
练习:写出下列物质的电离方程式
①氢氧化钠②氢氧化钡③氢氧化钙④氯化镁⑤硫酸铜
⑥碳酸钠
⑦硫酸钾
⑧氯化铁
⑨碳酸铵
⑩硫酸氢钠
(3)注意事项:
①电离是电解质导电的前提条件
②电解质必须是自身能电离成自由移动离子
的化合物
【问题】
为什么NaCl晶体不导电?NaCl溶液可以导电?
自由移动的水合钠离子和水合氯离子
所以:CO2
SO2
NH3是非电解质
4、从电离的角度概括酸、碱、盐
电解质电离时生成的阳离子全部是氢离子(H+)的化合物
HCl
H2SO4
NaOH
Ca(OH)2
NaCl
NH4NO3
电解质电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
电解质电离时生成的阳离子是金属离子或铵根离子(NH4+),阴离子是酸根离子的化合物
练习:
①Cu②NaCl③NaHSO4④SO3⑤H2SO4⑥C2H5OH⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩Fe(OH)3?NaOH?NH3·H20
请按下列分类标准回答问题:
(1)属于电解质的是:
,
(2)能电离H+的是:
,
以下中学化学常见的物质:
(3)属于酸的是:
,
(4)属于碱的是:
,
(5)属于难溶性盐的是:
,
【实验探究】
【实验2-1】
p31页
向CuSO4溶液里加入BaCl2溶液
【分析】
CuSO4=Cu2+
+
SO42-
BaCl2=Ba2+
+
2Cl-
CuCl2=Cu2++2Cl-
CuSO4+BaCl2=CuCl2+BaSO4↓
Cu2++SO42-+Ba2++2Cl-=Cu2++2Cl-+BaSO4↓
Ba2++SO42+=BaSO4↓
1、离子反应
二、离子反应及其发生的条件
(1)、定义:
有离子参加或生成的反应
(2)、离子反应的特点:
离子反应总是向着某种离子浓度减小的方向进行
如:向稀HCl中加入AgNO3溶液
再如:实验室制取CO2
2、离子方程式
(1)、定义:用实际参加反应的离子符号
来表示反应的式子
【探究】
【实验2-2】
p32页表格
(2)、离子方程式的意义
离子方程式不仅可以表示某一具体的化学反应,而且还可以表示同一类型的离子反应。
3、离子方程式的书写
(1)写:
写出反应的化学方程式
(2)拆:
把易溶于水、易电离的物质拆成离子形式(强酸、强碱、可溶性盐)
(难溶的物质、气体和水仍用化学式表示)
把不参加反应的离子从方程式两端删去
检查方程式两端各元素的原子个数和电荷数是否相等
(3)删:
(4)查:
如:Cu(OH)2和稀HCl
练习:
完成下列化学方程式,并改写为离子方程式
①硫酸和氢氧化钠
②碳酸钾和盐酸
③硫酸钠和氯化钡
④盐酸和氢氧化钾
⑤碳酸钠和盐酸
⑥硫酸钾和硝酸钡
⑦硫酸和氢氧化钾
⑧碳酸钠和硫酸
⑨硫酸镁和氯化钡
4、离子反应发生的条件
(1)生成难溶于水的物质
(2)生成难电离的物质
(H2O、弱酸、弱碱等)
(3)生成易挥发性的物质(气体)
如:硝酸银溶液和氯化钠溶液
如:硫酸和氢氧化钠溶液
如:碳酸钙和稀盐酸
三、离子方程式正误判断
1、以客观事实为依据
如:铁与稀盐酸反应
2Fe+6H+
=
2Fe3++3H2↑
2、以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+
=
Al3++H2↑
3、以电荷守恒为依据
如:2FeCl3+Fe
=
3FeCl2
(正确)
Fe3++Fe
=
2Fe2+
(错误)
4、以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+
=
H2O+CO2↑
BaCO3+2H+
=
Ba2++H2O+CO2↑
√
5、以物质的组成为依据
如:氢氧化钡和稀硫酸
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
√
6、注意物质的状态,是否漏写
如:碳酸钾和稀盐酸
CO32-+2H+
=
H2O+CO2
↑
√
练习1:写出有关反应的化学方程式
(1)CO32-+2H+=H2O+CO2↑
(2)Cu2++2OH-=Cu(OH)2↓
(3)Zn+2H+=Zn2++H2↑
(1)
+
2Ag+
=
+
2Ag,
(2)Fe2O3+
=
2Fe3++
,
(3)CaCO3+
=
CO2↑+
+
,
练习2:完成离子反应并改写成化学方程式
练习3:下列离子方程式正确的是(
)
A:铝和稀硫酸
Al+2H+=Al3++H2↑
B:石灰石和盐酸
CO32-+2H+=CO2↑+H2O
C:氢氧化钡和稀硫酸
H++OH-=H2O
D:铜和硝酸银溶液
Cu+Ag+=Cu2++Ag
E:澄清的石灰水和盐酸
H++OH-=H2O
F:碳酸钡和稀硫酸
BaCO3+2H+=Ba2++CO2↑+H2O
四、离子共存
(1)不能共存:离子间若发生下列反应之一
①生成难溶物或微溶物
如:
②生成气体或挥发性物质
如:
③生成难电离物质
如:
常见难电离的物质:
a
b
c
(2)隐含条件
①无色透明溶液中,不存在有色离子
如:
②弱酸的酸式根离子在较强的酸性和碱性条件下
如:HCO3-
、HSO3-
练习:在强酸性溶液中能大量共存且溶液为
无色透明的一组离子是(
)
A:Ca2+、Na+、NO3-、SO42-
B:Mg2+、Cl-、Al3+、SO42-
C:K+、Cl-、HCO3-、NO3-
D:Ca2+、Na+、Fe3+、NO3-
五、离子反应的应用
(1)、混合物的分离
(2)、物质的提纯
如:粗盐的提纯
如:分离铜粉和氧化铜粉末
(3)、物质的鉴别
如:有A、B、C三种无色溶液,只知是HCl
H2SO4
Ba(NO3)2三种物质的溶液的各一种。按一定顺序滴入Na2CO3溶液中至恰好完全反应,有一下现象:
①加入A时生成白色沉淀
②向①中沉淀加入B时沉淀溶解,并有气体逸出
③向②中生成的溶液中加入C时,又有白色沉淀生成
根据以上现象回答下列问题:
(1)判断A、B、C各是什么溶液?
A:
B:
C:
.
(2)有关反应的离子方程式:
①
,
②
,
③
。
Ba(NO3)2
HCl
H2SO4
Ba2++CO32-=BaCO3↓
BaCO3+2H+=Ba2++H2O+CO2↑
Ba2++SO42-=BaSO4↓
(4)化合物组成成分的分析和鉴定
如:如何对无色气体A的水溶液进行鉴定
步骤:取少量A的溶液,向其中加入少量的Na2CO3溶液,逸出无色、无味并使澄清的石灰水变浑浊的气体;
离子方程式:
,
则:阳离子是:
.
再向溶液中滴加用稀硝酸酸化的AgNO3溶液,生成白色沉淀。
离子方程式:
,
则:阴离子是:
.
综上可知:气体A是
。
H+
2H++CO32-=H2O+CO2↑
Cl-
Cl-+Ag+=AgCl↓
HCl
(5)治理水中的污染物
如:一种污水中含有KCl,另一种污水中含AgNO3
若将两种污水按适当的比例混合
Ag++Cl-=AgCl↓
将混合物的水经过过滤后再排放,不但消除了水的污染,而且还能回收AgCl。用这样的水浇灌农田又能增加肥料(K+
NO3-)
第三节
