人教版高中化学必修一3.2-几种重要的金属化合物(共39张PPT)
文档属性
| 名称 | 人教版高中化学必修一3.2-几种重要的金属化合物(共39张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 00:00:00 | ||
图片预览











文档简介
(共39张PPT)
第三章
金属及其化合物
第二节
几种重要的金属化合物
钠
的氧化物
氧化钠和过氧化钠
回忆:Na2O和Na2O2
的颜色、状态
Na2O:白色固体
Na2O2:淡黄色固体
思考与交流1(课本P55)
请写出Na2O与水、CO2
、稀盐酸反应的方程式
从物质分类的角度Na2O属于哪一类氧化物?这一类氧化物的共性是什么?(填写学案)
思考与交流2:
Na2O的化学性质
(1)与水反应
(2)与酸性氧化物反应生成盐
(3)与酸反应生成盐和水
Na2O
+
H2O
==
2NaOH
Na2O
+
CO2
==
Na2CO3
Na2O
+
2HCl
==
2NaCl
+
H2O
“滴水生火”
小魔术
脱脂棉为何能燃烧起来呢?
提示:从燃烧的条件进行分析
用原有知识进行推理分析:
观
察
与
思
考
分析判断
初步结论:过氧化钠与水反应生成气体并放出热量
大
胆
猜
想
Na2O2+H2O
===
?
从元素守恒可知未知气体只可能是氢气或氧气
究竟是哪种气体呢?
实验是最强有力的杠杆,我们可以利用这个杠杆去撬开自然界的秘密。
--伦琴
过氧化钠跟水反应的产物有什么?气体是
什么呢?
探讨交流:小组讨论展示其探究方案
引出探究任务一:
实验探究一、Na2O2与水的反应
[注意,先用酒精灯点燃线香(代替木条)]
1试管中用纸槽注入半药匙的Na2O2粉末,用胶头滴管
滴加6-7滴蒸馏水,观察有何现象。
2立即把带火星的线香伸入试管内,(同桌配合)
有何现象。
3、用手摸一摸试管外壁,有何感觉。
4、用玻棒蘸取试管内溶液,在表面皿上测定其PH
(实验后熄灭酒精灯和线香)
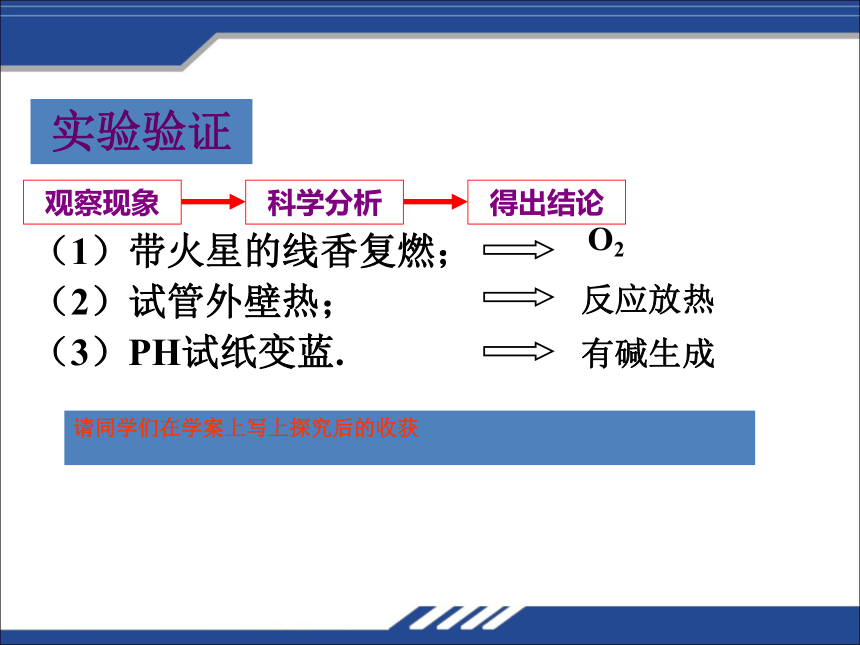
实验验证
(1)带火星的线香复燃;
(2)试管外壁热;
(3)PH试纸变蓝.
O2
反应放热
有碱生成
请同学们在学案上写上探究后的收获
观察现象
科学分析
得出结论
1.
Na2O2的性质
2Na2O2
+
2H2O
==
4NaOH
+
O2?
放热
(1)与水反应
使脱脂棉燃烧
过氧化钠与CO2的反应有什么产物?会不会也产生氧气呢?
探讨与交流:请同学们设计实验探究方案
小组互评
探究任务二
实验探究二
在一个盛有1/4药匙(大头)碳酸钠固体的
小烧杯中加入约20ml稀盐酸
(同桌配合),
用坩埚钳夹取包有1药匙(小头)过氧化钠粉末的疏松脱脂棉迅速伸入烧杯上部
,观察现象.(注意用量)
观
察
与
思
考(小组讨论
)
(1)脱脂棉为何能燃烧起来?请用化学方式解释原因
(2)从这个实验中你受到什么启迪?
Na2O2有哪些方面的用途?
应如何保存?
小组讨论并推选代表举牌发言
(2)与二氧化碳的反应
Na2O2
+
CO2
——
Na2CO3
+
O2
2Na2O2
+
2CO2
==
2Na2CO3
+
O2
放热
供氧剂
呼吸面具
潜水艇
使脱脂棉燃烧
学以致用
为什么呼吸面具和潜艇都要
用Na2O2
?
2)过氧化钠是强氧化剂,可用来漂白织物、
麦杆、羽毛等;
Na2O2的用途(指导阅读P56)
性质决定用途
1)可用作呼吸面具和潜水艇里的供氧剂
学以致用:性质决定保存方法
Na2O2应如何保存?
因它易吸潮,易和二氧化碳和水反应,
所以必须保存在密封的器皿中。
因它具有强氧化性,所以存放时不能与
易燃物接触。
(3)与盐酸的反应
2Na2O2
+
4HCl
==
4NaCl
+
2H2O
+
O2↑
Na2O和Na2O2的比较
学
习
对
比
课后完成学案表格内容
Na2O2与
Na2O的性质比较
2Na2O2
+
2H2O
=
4NaOH
+
O2
Na2O
+
H2O
=
2NaOH
2Na2O2
+
2CO2
=
2Na2CO3
+
O2
Na2O
+CO2
=
Na2CO3
2Na2O2
+4HCl=
4NaCl
+2H2O
+O2
Na2O
+
2HCl=
2NaCl+
H2O
Na2O2
Na2O
淡黄色固体
白色固体
漂白剂、供氧剂
可制烧碱
2Na2O+
O2
===
2Na2O2
△
合作学习
分九个小组竞赛,
看哪个小组的学生最先举牌
每题答对加5分,答错扣5分
1.如果金属钠着火了,用水泼
√
1判断对错
2.
Na2O和Na2O2都是白色固体
4
.
Na2O2与盐酸不能产生氧气
×
×
×
3
.
Na2O和Na2O2都是都能和水反应形成强碱溶液
2选择题.下列说法中,
正确的是(
)
A
钠可保存在水中
B
稳定性:过氧化钠>氧化钠
C
钠是在地壳中含量最高的金属
D
钠在硫酸铜溶液中可置换出铜
B
3.能与水反应生成NaOH的物质有哪些
?
(每答对一种物质给5分)
白色固体Na2O
银白色金属钠(Na)
淡黄色固体Na2O2
回答完全正确加30分,答对一空加5分
答错一空减5分。(小组推选代表回答)
4.A、B、C三种均为含钠的常见物质,三者分别跟水发生化学反应均得物质D的溶液;A跟水反应还有O2生
成,B跟水反应还有H2生成,C跟水发生的是化合反应。
①A为_________,B为_________,
C为_________,D为_________。
②由B生成A的化学方程式是:
__________________________________
。
③由A变为D的化学方程式是:
__________________________________
。
④由B变为D的化学方程式是:
__________________________________
。
Na2O2
Na
Na2O
NaOH
2Na2O2
+
2H2O
=4NaOH
+
O2↑
2Na
+
2H2O
=2NaOH
+
H2
↑
2Na
+
O2
=
Na2O2
△
小结与反思
通过今天这节课的学习和探究,同学们有什么收获和启发?请分别给自己和同桌进行客观评价.
探究小组推选代表发言
我的课堂我总结
我的课堂我总结
作业:
课本P62页第1题
P63页第4题
兴趣探究实验
将蒸馏水注入到盛有1/2药匙的Na2O2粉末的试管里,制成2/3试管溶液,并将溶液分装在三支试管中(另一支备用)
,分别向其中两支试管中滴加1-2滴紫色的石蕊试液和无色的酚酞试液。
观察有何现象?振荡后再观察有何现象?
观察分析,科学推测
设疑:为何颜色会褪去?
猜想:生成物中有漂白性?究竟是什么物质起作用呢?
提示:过氧化钠与水的反应中有可能产生其他物质,这种物质具有漂白性,它的组成元素是什么,会是什么物质呢?请同学们讨论,并得出最后结论。
大
胆
猜
想
实
验
验
证
Na2O2反应完
不是Na2O2的作用
溶液中滴加酚酞试液
再加盐酸中和后,红色没有重现
不是NaOH的作用
敞口体系,O2逸出;酚酞试液贮存无特殊密封措施,O2不与酚酞试液作用。
不是O2的作用
向反应后的溶液中加入少量二氧化锰粉末,静置,待无气体产生时,取上层清液,加入酚酞试液,溶液显红色。
是H2O2的作用
H2O2的作用
得
出
结
论
过氧化钠与水的反应分两步进行:
⑴产生过氧化氢
Na2O2
+2H2O=2NaOH+H2O2
⑵过氧化氢分解
2H2O2=2H2O+
O2↑
课堂小结
分析判断
获得新知
物质类别
已有旧知
①2Na2O2
+
2H2O
=
4NaOH
+
O2↑
②2Na2O2
+
2CO2
=
2Na2CO3
+
O2
③Na2O2可做供氧剂漂白剂
④Na2CO3遇水先变成结晶水合物Na2CO3·xH2O并放热
⑤溶解度Na2CO3>NaHCO3
⑥与盐酸反应产生气泡快慢 Na2CO3<NaHCO3
⑦碱性 Na2CO3>NaHCO3
结论
实验验证
初步结论
探究问题的过程与方法
查阅资料
第三章
金属及其化合物
第二节
几种重要的金属化合物
钠
的氧化物
氧化钠和过氧化钠
回忆:Na2O和Na2O2
的颜色、状态
Na2O:白色固体
Na2O2:淡黄色固体
思考与交流1(课本P55)
请写出Na2O与水、CO2
、稀盐酸反应的方程式
从物质分类的角度Na2O属于哪一类氧化物?这一类氧化物的共性是什么?(填写学案)
思考与交流2:
Na2O的化学性质
(1)与水反应
(2)与酸性氧化物反应生成盐
(3)与酸反应生成盐和水
Na2O
+
H2O
==
2NaOH
Na2O
+
CO2
==
Na2CO3
Na2O
+
2HCl
==
2NaCl
+
H2O
“滴水生火”
小魔术
脱脂棉为何能燃烧起来呢?
提示:从燃烧的条件进行分析
用原有知识进行推理分析:
观
察
与
思
考
分析判断
初步结论:过氧化钠与水反应生成气体并放出热量
大
胆
猜
想
Na2O2+H2O
===
?
从元素守恒可知未知气体只可能是氢气或氧气
究竟是哪种气体呢?
实验是最强有力的杠杆,我们可以利用这个杠杆去撬开自然界的秘密。
--伦琴
过氧化钠跟水反应的产物有什么?气体是
什么呢?
探讨交流:小组讨论展示其探究方案
引出探究任务一:
实验探究一、Na2O2与水的反应
[注意,先用酒精灯点燃线香(代替木条)]
1试管中用纸槽注入半药匙的Na2O2粉末,用胶头滴管
滴加6-7滴蒸馏水,观察有何现象。
2立即把带火星的线香伸入试管内,(同桌配合)
有何现象。
3、用手摸一摸试管外壁,有何感觉。
4、用玻棒蘸取试管内溶液,在表面皿上测定其PH
(实验后熄灭酒精灯和线香)
实验验证
(1)带火星的线香复燃;
(2)试管外壁热;
(3)PH试纸变蓝.
O2
反应放热
有碱生成
请同学们在学案上写上探究后的收获
观察现象
科学分析
得出结论
1.
Na2O2的性质
2Na2O2
+
2H2O
==
4NaOH
+
O2?
放热
(1)与水反应
使脱脂棉燃烧
过氧化钠与CO2的反应有什么产物?会不会也产生氧气呢?
探讨与交流:请同学们设计实验探究方案
小组互评
探究任务二
实验探究二
在一个盛有1/4药匙(大头)碳酸钠固体的
小烧杯中加入约20ml稀盐酸
(同桌配合),
用坩埚钳夹取包有1药匙(小头)过氧化钠粉末的疏松脱脂棉迅速伸入烧杯上部
,观察现象.(注意用量)
观
察
与
思
考(小组讨论
)
(1)脱脂棉为何能燃烧起来?请用化学方式解释原因
(2)从这个实验中你受到什么启迪?
Na2O2有哪些方面的用途?
应如何保存?
小组讨论并推选代表举牌发言
(2)与二氧化碳的反应
Na2O2
+
CO2
——
Na2CO3
+
O2
2Na2O2
+
2CO2
==
2Na2CO3
+
O2
放热
供氧剂
呼吸面具
潜水艇
使脱脂棉燃烧
学以致用
为什么呼吸面具和潜艇都要
用Na2O2
?
2)过氧化钠是强氧化剂,可用来漂白织物、
麦杆、羽毛等;
Na2O2的用途(指导阅读P56)
性质决定用途
1)可用作呼吸面具和潜水艇里的供氧剂
学以致用:性质决定保存方法
Na2O2应如何保存?
因它易吸潮,易和二氧化碳和水反应,
所以必须保存在密封的器皿中。
因它具有强氧化性,所以存放时不能与
易燃物接触。
(3)与盐酸的反应
2Na2O2
+
4HCl
==
4NaCl
+
2H2O
+
O2↑
Na2O和Na2O2的比较
学
习
对
比
课后完成学案表格内容
Na2O2与
Na2O的性质比较
2Na2O2
+
2H2O
=
4NaOH
+
O2
Na2O
+
H2O
=
2NaOH
2Na2O2
+
2CO2
=
2Na2CO3
+
O2
Na2O
+CO2
=
Na2CO3
2Na2O2
+4HCl=
4NaCl
+2H2O
+O2
Na2O
+
2HCl=
2NaCl+
H2O
Na2O2
Na2O
淡黄色固体
白色固体
漂白剂、供氧剂
可制烧碱
2Na2O+
O2
===
2Na2O2
△
合作学习
分九个小组竞赛,
看哪个小组的学生最先举牌
每题答对加5分,答错扣5分
1.如果金属钠着火了,用水泼
√
1判断对错
2.
Na2O和Na2O2都是白色固体
4
.
Na2O2与盐酸不能产生氧气
×
×
×
3
.
Na2O和Na2O2都是都能和水反应形成强碱溶液
2选择题.下列说法中,
正确的是(
)
A
钠可保存在水中
B
稳定性:过氧化钠>氧化钠
C
钠是在地壳中含量最高的金属
D
钠在硫酸铜溶液中可置换出铜
B
3.能与水反应生成NaOH的物质有哪些
?
(每答对一种物质给5分)
白色固体Na2O
银白色金属钠(Na)
淡黄色固体Na2O2
回答完全正确加30分,答对一空加5分
答错一空减5分。(小组推选代表回答)
4.A、B、C三种均为含钠的常见物质,三者分别跟水发生化学反应均得物质D的溶液;A跟水反应还有O2生
成,B跟水反应还有H2生成,C跟水发生的是化合反应。
①A为_________,B为_________,
C为_________,D为_________。
②由B生成A的化学方程式是:
__________________________________
。
③由A变为D的化学方程式是:
__________________________________
。
④由B变为D的化学方程式是:
__________________________________
。
Na2O2
Na
Na2O
NaOH
2Na2O2
+
2H2O
=4NaOH
+
O2↑
2Na
+
2H2O
=2NaOH
+
H2
↑
2Na
+
O2
=
Na2O2
△
小结与反思
通过今天这节课的学习和探究,同学们有什么收获和启发?请分别给自己和同桌进行客观评价.
探究小组推选代表发言
我的课堂我总结
我的课堂我总结
作业:
课本P62页第1题
P63页第4题
兴趣探究实验
将蒸馏水注入到盛有1/2药匙的Na2O2粉末的试管里,制成2/3试管溶液,并将溶液分装在三支试管中(另一支备用)
,分别向其中两支试管中滴加1-2滴紫色的石蕊试液和无色的酚酞试液。
观察有何现象?振荡后再观察有何现象?
观察分析,科学推测
设疑:为何颜色会褪去?
猜想:生成物中有漂白性?究竟是什么物质起作用呢?
提示:过氧化钠与水的反应中有可能产生其他物质,这种物质具有漂白性,它的组成元素是什么,会是什么物质呢?请同学们讨论,并得出最后结论。
大
胆
猜
想
实
验
验
证
Na2O2反应完
不是Na2O2的作用
溶液中滴加酚酞试液
再加盐酸中和后,红色没有重现
不是NaOH的作用
敞口体系,O2逸出;酚酞试液贮存无特殊密封措施,O2不与酚酞试液作用。
不是O2的作用
向反应后的溶液中加入少量二氧化锰粉末,静置,待无气体产生时,取上层清液,加入酚酞试液,溶液显红色。
是H2O2的作用
H2O2的作用
得
出
结
论
过氧化钠与水的反应分两步进行:
⑴产生过氧化氢
Na2O2
+2H2O=2NaOH+H2O2
⑵过氧化氢分解
2H2O2=2H2O+
O2↑
课堂小结
分析判断
获得新知
物质类别
已有旧知
①2Na2O2
+
2H2O
=
4NaOH
+
O2↑
②2Na2O2
+
2CO2
=
2Na2CO3
+
O2
③Na2O2可做供氧剂漂白剂
④Na2CO3遇水先变成结晶水合物Na2CO3·xH2O并放热
⑤溶解度Na2CO3>NaHCO3
⑥与盐酸反应产生气泡快慢 Na2CO3<NaHCO3
⑦碱性 Na2CO3>NaHCO3
结论
实验验证
初步结论
探究问题的过程与方法
查阅资料
