湖北省新高考联考协作体2020-2020学年高二上学期开学联考化学试题 Word版含答案
文档属性
| 名称 | 湖北省新高考联考协作体2020-2020学年高二上学期开学联考化学试题 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 861.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-14 00:00:00 | ||
图片预览



文档简介
____________________________________________________________________________________________
2020年湖北省新高考联考协作体高二上学期起点考试
高二化学试卷
考试时间:2020年9月7日 14:30—17:30 试卷满分:100 分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56
一、单项选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列说法错误的是
A.氯仿的相对分子质量为119.5 B.“84消毒液”的主要有效成分是NaClO
C.使用泡沫灭火器扑灭金属Na的燃烧 D.使用冷却结晶的方法制备胆矾
2.下列叙述不涉及氧化还原反应的是
A.酸性重铬酸钾溶液检测酒后驾驶 B.大气中氮氧化物参与酸雨形成
C.过氧乙酸灭活新冠病毒 D.小苏打用作食品膨松剂
3.A、B、C、D为原子序数依次增大的短周期元素,化合物CB是一种新型高温结构陶瓷的主要成分;化合物BA3与D2相遇会产生白烟。下列叙述正确的是
A.非金属性:A> B>C> D B.原子半径:D>C>B>A
C.元素B的含氧酸均为强酸 D.C的氧化物对应水化物是两性氢氧化物
4.下列化学用语正确的是( )
A.、 D、T是氢元素的三种同位素
B.次氯酸的结构式:H-Cl-O
C.N2的结构式::N≡N:
D.H2O2的电子式:
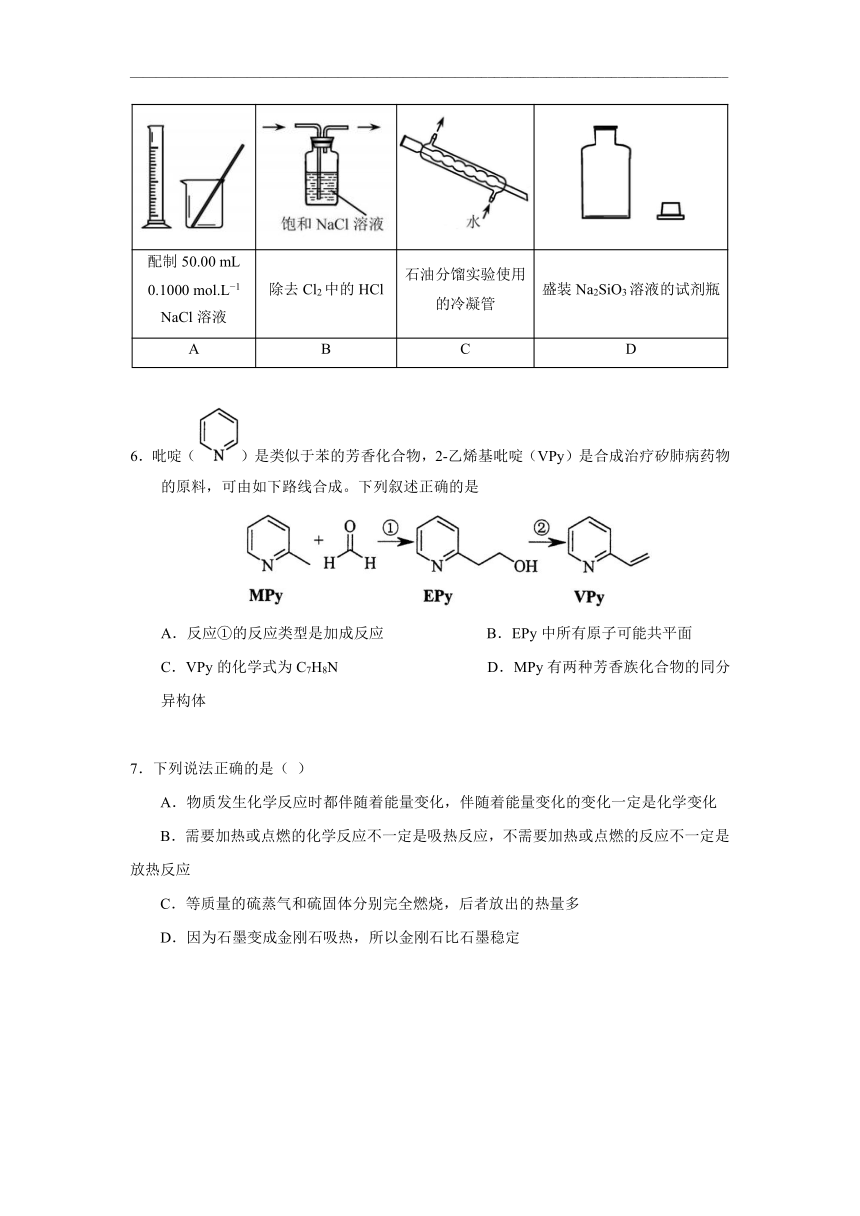
5.下列实验仪器或装置的选择正确的是
配制50.00 mL 0.1000 mol.L?1
NaCl溶液 除去Cl2中的HCl 石油分馏实验使用的冷凝管 盛装Na2SiO3溶液的试剂瓶
A B C D
6.吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述正确的是
A.反应①的反应类型是加成反应 B.EPy中所有原子可能共平面
C.VPy的化学式为C7H8N D.MPy有两种芳香族化合物的同分异构体
7.下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化
B.需要加热或点燃的化学反应不一定是吸热反应,不需要加热或点燃的反应不一定是放热反应
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.因为石墨变成金刚石吸热,所以金刚石比石墨稳定
8.下图是2SO3(g) 2SO2(g) + O2(g)的能量变化图,据图得出的相关叙述正确的是(??? )
A.2SO3(g) 2SO2(g) + O2(g)? △H=-(a-b) kJ·mol-1
B.该化学反应过程中正反应的活化能大于逆反应
C.1 mol SO2的能量比1 mol SO3的能量高
D.若某容器内的2 mol SO3充分反应,则反应吸收(a-b)kJ热量
9.下列有关叙述正确的是
A.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
B.HCl(aq)和NaOH(aq)反应的反应热ΔH=-57.3 kJ·mol-1,则H2SO4(aq)和Ba(OH)2(aq)反应热的ΔH=-114.6 kJ·mol-1
C.2H2O(g)=2H2(g)+O2(g) 在任何温度下均能自发进行
D.NaOH溶于水和NaOH与HCl反应均为放热反应
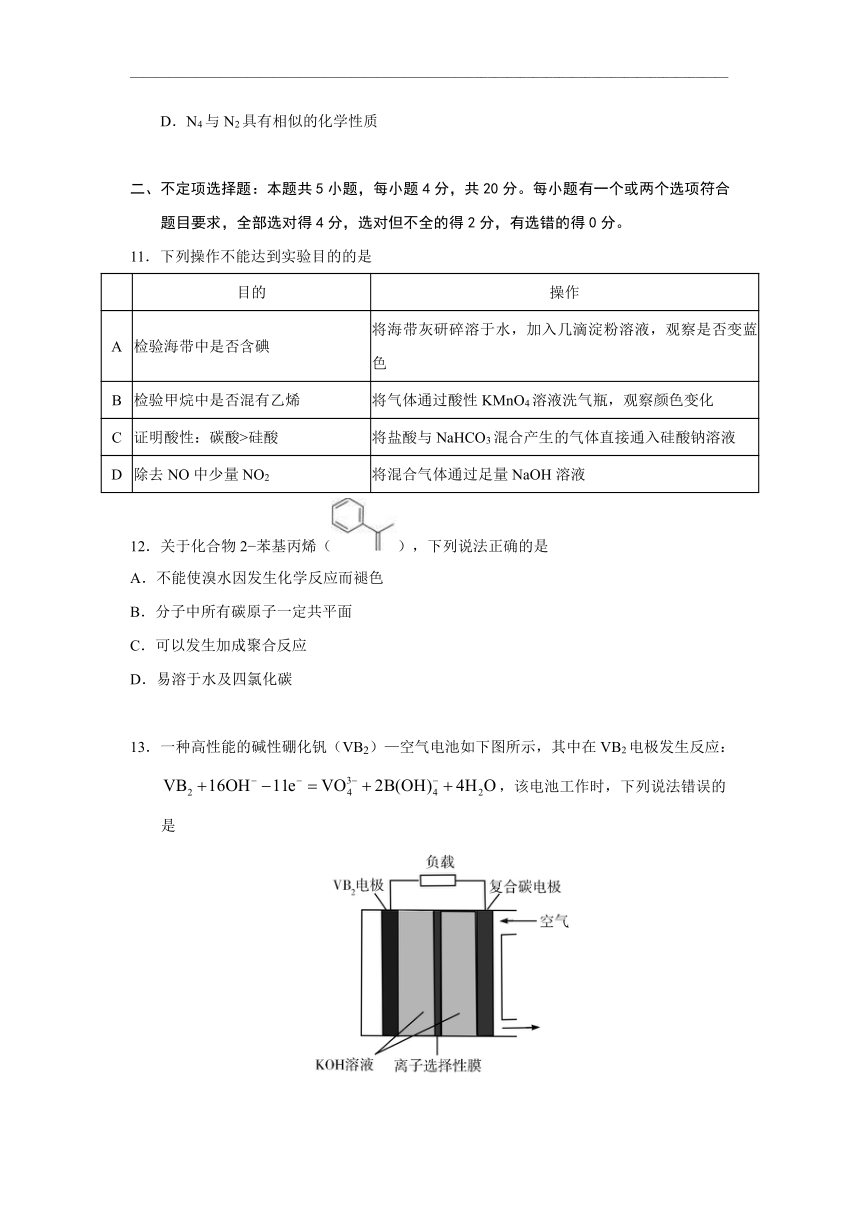
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1mol?N—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是(?? )
A.1mol?N4气体转变为N2放出882kJ热量
B.P4(白磷)沸点低于N4
C.N4与N2互为同分异构体
D.N4与N2具有相似的化学性质
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列操作不能达到实验目的的是
目的 操作
A 检验海带中是否含碘 将海带灰研碎溶于水,加入几滴淀粉溶液,观察是否变蓝色
B 检验甲烷中是否混有乙烯 将气体通过酸性KMnO4溶液洗气瓶,观察颜色变化
C 证明酸性:碳酸>硅酸 将盐酸与NaHCO3混合产生的气体直接通入硅酸钠溶液
D 除去NO中少量NO2 将混合气体通过足量NaOH溶液
12.关于化合物2?苯基丙烯(),下列说法正确的是
A.不能使溴水因发生化学反应而褪色
B.分子中所有碳原子一定共平面
C.可以发生加成聚合反应
D.易溶于水及四氯化碳
13.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:
,该电池工作时,下列说法错误的是
A.负载通过0.02 mol电子时,有0.112 LO2参与反应
B.正极区溶液的pH升高、负极区溶液的pH降低
C.电池总反应为
D.电子由VB2电极经负载、复合碳电极、KOH溶液回到VB2电极
14.关于如图所示转化关系(X代表卤素),说法不正确的是(??)
A.因为反应热大小与途径无关,所以
B.过程III中 △H3 > 0
C.键、键、键键能依次减小,所以三个反应中过程Ⅱ吸收的热量依次减小
D.反应Ⅰ生成HCl放出的热量比生成HBr的多,所以HBr比HCl更稳定
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:
反应Ⅰ:3N2H4(g) = N2(g) + 4NH3(g)? ΔH1= ? 32.9 kJ·mol?1;
反应Ⅱ:N2H4(g) + H2(g) = 2NH3(g)? ΔH2= ? 41.8 kJ·mol?1
下列说法不正确的是
A.图所示过程②是吸热反应
B.反应Ⅱ的能量过程示意图如图所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g) = N2(g)+2H2(g)? ΔH= -50.7 kJ·mol?1
三、非选择题:本题共5小题,共60分
16.(12分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放浓盐酸的仪器名称是 ,a中的试剂为 。
(2)c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d中可选用试剂 (填标号)。
A.NaCl B.Na2S C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”、“等于”或“小于")。
17.(12分)Ⅰ.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:?
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H+ + OH﹣= H2O外,还有:
_____________________________、________________________________;
(3)步骤③中加入(或通入)的过量试剂b的结构式是______________。
Ⅱ. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(4)从硫元素化合价的角度分析,图中只具有还原性的化合物有______________(填化学式)。
(5)将X与Y混合,可生成淡黄色固体,该反应的化学方程式为_________________________。
(6)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S + S???? b.SO2 + Na2SO4??? ?c.Na2SO3 + S? d.Na2SO3 + Na2SO4
18.(12分)乙烯和丙烯是重要有机化工原料。
I.以乙烯为原料可以制备乙二醇和高分子化合物B。
(1)①的化学方程式为___________________________________。
(2)②为取代反应,通过A与NaOH溶液加热条件下完成转化,②的化学反应方程式为___________________。
(3)③的反应类型为_______________,B的结构简式为________________。
II.丙烯酸乙酯天然存在于菠萝等水果中,是一种天然香料,也可以由乙烯和丙烯为原料合成。
(4)有机物E中的官能团的名称是_________________。
(5) D与E反应生成丙烯酸乙酯的化学反应方程式为_____________________________________________。
(6)下列说法正确的是______________。
a.乙烯、丙烯是石油裂解的产物 b.乙二醇难溶于水
c.丙烯酸乙酯可发生取代反应 d.D可以由葡萄糖分解得到
19.(12分)根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_______变化;稳定性白磷_______红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2 + O2 2H2O。该反应1mol氢气完全燃烧放出热量242 kJ,其中断裂1 mol H—H键吸收436 kJ,断裂1mol O=O键吸收496 kJ,那么形成1mol H—O键放出热量为___________________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:
①b极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②a电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲醇,则负极电极反应式为______________________________________。
20.(12分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)① 图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:????????????????????????????????????????????????????????????????????????????????????????。②若在反应体系中加入催化剂,E1、E2的变化分别是:E1_________、E2________(填“增大”、“减小”或“不变”)。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① PCl3(g)分解生成P(s)和Cl2(g)的热化学方程式?????????????????????????????????????????????????????????????????????????????????????。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的反应热△H3与P(s)和Cl2(g)仅一步反应生成1molPCl5(g)的反应热△H4关系是:△H3______△H4(填“>”、“<”或“=”),原因是?????????????????????????????????????????????????。
图一 图二
2020年湖北省新高考联考协作体高二上学期起点考试
高二化学参考答案
一、选择题
1.C 2.D 3.C 4.A 5.B 6.A 7.B 8.B 9.A 10.A
二、选择題
11.AC 12.C 13.AD 14.BD 15.D
三、非选择题
16.(1)分液漏斗...[1分] 饱和食盐水...[1分]
(2)Cl2+2OH?=ClO?+Cl?+H2O...[2分] 避免生成NaClO3...[2分]
(3)BC...[2分,只答B或C给1分,出现A或D给0分]
(4)过滤...[1分] 洗涤(或答少量冷水洗涤)...[1分]
(5)紫(或紫红)...[1分] 小于...[1分]
17.(1)SiO2...[2分]
(2) Fe3+ + 3OH﹣=Fe(OH)3↓ ...[1分] Al3+ + 4OH﹣= AlO2﹣ + 2H2O ...[1分]
(3)O=C=O ...[2分]
(4)H2S ...[2分]
(5)SO2 + 2H2S = 3S↓ + 2H2O ...[2分]
(6)c ...[2分]
18.(1)CH2=CH2 + Br2 → CH2BrCH2Br ...[2分]
(2)CH2BrCH2Br + 2H2OHOCH2CH2OH + 2HBr ...[2分]
(3)加聚反应 ...[1分] ...[1分]
(4)碳碳双键、羧基 ...[2分,不全给1分,答错给0分]
(5)CH3CH2OH + CH2=CHCOOHCH2=CHCOOCH2CH3 + H2O...[2分,答可逆号也可]
(6)acd ...[2分]
19.(1)化学 ...[1分] < ...[1分]
(2)463 kJ ...[2分]
①正极...[2分] a ...[2分]
②减小 ...[2分]
③CH3OH -6e-+8OH- = CO32-+6H2O ...[2分]
(1)①NO2(g) + CO(g) = CO2(g) + NO(g) △H = - 234 kJ/mol ...[2分]
②减小 ...[2分] 减小 ...[2分]
(2)①PCl3(g) = P(s) + 3/2 Cl2(g) △H= + 306 kJ/mol ...[2分]
② = ...[2分] 由盖斯定理可知,反应热只与起始状态和终了状态有关,所以反应无论是一步完成还是分多步完成,其反应热是相同的。...[2分 只答“盖斯定理”给1分,展开描述盖斯定律给2分。]
2020年湖北省新高考联考协作体高二上学期起点考试
高二化学试卷
考试时间:2020年9月7日 14:30—17:30 试卷满分:100 分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56
一、单项选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列说法错误的是
A.氯仿的相对分子质量为119.5 B.“84消毒液”的主要有效成分是NaClO
C.使用泡沫灭火器扑灭金属Na的燃烧 D.使用冷却结晶的方法制备胆矾
2.下列叙述不涉及氧化还原反应的是
A.酸性重铬酸钾溶液检测酒后驾驶 B.大气中氮氧化物参与酸雨形成
C.过氧乙酸灭活新冠病毒 D.小苏打用作食品膨松剂
3.A、B、C、D为原子序数依次增大的短周期元素,化合物CB是一种新型高温结构陶瓷的主要成分;化合物BA3与D2相遇会产生白烟。下列叙述正确的是
A.非金属性:A> B>C> D B.原子半径:D>C>B>A
C.元素B的含氧酸均为强酸 D.C的氧化物对应水化物是两性氢氧化物
4.下列化学用语正确的是( )
A.、 D、T是氢元素的三种同位素
B.次氯酸的结构式:H-Cl-O
C.N2的结构式::N≡N:
D.H2O2的电子式:
5.下列实验仪器或装置的选择正确的是
配制50.00 mL 0.1000 mol.L?1
NaCl溶液 除去Cl2中的HCl 石油分馏实验使用的冷凝管 盛装Na2SiO3溶液的试剂瓶
A B C D
6.吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述正确的是
A.反应①的反应类型是加成反应 B.EPy中所有原子可能共平面
C.VPy的化学式为C7H8N D.MPy有两种芳香族化合物的同分异构体
7.下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化
B.需要加热或点燃的化学反应不一定是吸热反应,不需要加热或点燃的反应不一定是放热反应
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.因为石墨变成金刚石吸热,所以金刚石比石墨稳定
8.下图是2SO3(g) 2SO2(g) + O2(g)的能量变化图,据图得出的相关叙述正确的是(??? )
A.2SO3(g) 2SO2(g) + O2(g)? △H=-(a-b) kJ·mol-1
B.该化学反应过程中正反应的活化能大于逆反应
C.1 mol SO2的能量比1 mol SO3的能量高
D.若某容器内的2 mol SO3充分反应,则反应吸收(a-b)kJ热量
9.下列有关叙述正确的是
A.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
B.HCl(aq)和NaOH(aq)反应的反应热ΔH=-57.3 kJ·mol-1,则H2SO4(aq)和Ba(OH)2(aq)反应热的ΔH=-114.6 kJ·mol-1
C.2H2O(g)=2H2(g)+O2(g) 在任何温度下均能自发进行
D.NaOH溶于水和NaOH与HCl反应均为放热反应
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1mol?N—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是(?? )
A.1mol?N4气体转变为N2放出882kJ热量
B.P4(白磷)沸点低于N4
C.N4与N2互为同分异构体
D.N4与N2具有相似的化学性质
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列操作不能达到实验目的的是
目的 操作
A 检验海带中是否含碘 将海带灰研碎溶于水,加入几滴淀粉溶液,观察是否变蓝色
B 检验甲烷中是否混有乙烯 将气体通过酸性KMnO4溶液洗气瓶,观察颜色变化
C 证明酸性:碳酸>硅酸 将盐酸与NaHCO3混合产生的气体直接通入硅酸钠溶液
D 除去NO中少量NO2 将混合气体通过足量NaOH溶液
12.关于化合物2?苯基丙烯(),下列说法正确的是
A.不能使溴水因发生化学反应而褪色
B.分子中所有碳原子一定共平面
C.可以发生加成聚合反应
D.易溶于水及四氯化碳
13.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:
,该电池工作时,下列说法错误的是
A.负载通过0.02 mol电子时,有0.112 LO2参与反应
B.正极区溶液的pH升高、负极区溶液的pH降低
C.电池总反应为
D.电子由VB2电极经负载、复合碳电极、KOH溶液回到VB2电极
14.关于如图所示转化关系(X代表卤素),说法不正确的是(??)
A.因为反应热大小与途径无关,所以
B.过程III中 △H3 > 0
C.键、键、键键能依次减小,所以三个反应中过程Ⅱ吸收的热量依次减小
D.反应Ⅰ生成HCl放出的热量比生成HBr的多,所以HBr比HCl更稳定
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:
反应Ⅰ:3N2H4(g) = N2(g) + 4NH3(g)? ΔH1= ? 32.9 kJ·mol?1;
反应Ⅱ:N2H4(g) + H2(g) = 2NH3(g)? ΔH2= ? 41.8 kJ·mol?1
下列说法不正确的是
A.图所示过程②是吸热反应
B.反应Ⅱ的能量过程示意图如图所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g) = N2(g)+2H2(g)? ΔH= -50.7 kJ·mol?1
三、非选择题:本题共5小题,共60分
16.(12分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放浓盐酸的仪器名称是 ,a中的试剂为 。
(2)c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d中可选用试剂 (填标号)。
A.NaCl B.Na2S C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”、“等于”或“小于")。
17.(12分)Ⅰ.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:?
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H+ + OH﹣= H2O外,还有:
_____________________________、________________________________;
(3)步骤③中加入(或通入)的过量试剂b的结构式是______________。
Ⅱ. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(4)从硫元素化合价的角度分析,图中只具有还原性的化合物有______________(填化学式)。
(5)将X与Y混合,可生成淡黄色固体,该反应的化学方程式为_________________________。
(6)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S + S???? b.SO2 + Na2SO4??? ?c.Na2SO3 + S? d.Na2SO3 + Na2SO4
18.(12分)乙烯和丙烯是重要有机化工原料。
I.以乙烯为原料可以制备乙二醇和高分子化合物B。
(1)①的化学方程式为___________________________________。
(2)②为取代反应,通过A与NaOH溶液加热条件下完成转化,②的化学反应方程式为___________________。
(3)③的反应类型为_______________,B的结构简式为________________。
II.丙烯酸乙酯天然存在于菠萝等水果中,是一种天然香料,也可以由乙烯和丙烯为原料合成。
(4)有机物E中的官能团的名称是_________________。
(5) D与E反应生成丙烯酸乙酯的化学反应方程式为_____________________________________________。
(6)下列说法正确的是______________。
a.乙烯、丙烯是石油裂解的产物 b.乙二醇难溶于水
c.丙烯酸乙酯可发生取代反应 d.D可以由葡萄糖分解得到
19.(12分)根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_______变化;稳定性白磷_______红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2 + O2 2H2O。该反应1mol氢气完全燃烧放出热量242 kJ,其中断裂1 mol H—H键吸收436 kJ,断裂1mol O=O键吸收496 kJ,那么形成1mol H—O键放出热量为___________________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:
①b极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②a电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲醇,则负极电极反应式为______________________________________。
20.(12分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)① 图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:????????????????????????????????????????????????????????????????????????????????????????。②若在反应体系中加入催化剂,E1、E2的变化分别是:E1_________、E2________(填“增大”、“减小”或“不变”)。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① PCl3(g)分解生成P(s)和Cl2(g)的热化学方程式?????????????????????????????????????????????????????????????????????????????????????。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的反应热△H3与P(s)和Cl2(g)仅一步反应生成1molPCl5(g)的反应热△H4关系是:△H3______△H4(填“>”、“<”或“=”),原因是?????????????????????????????????????????????????。
图一 图二
2020年湖北省新高考联考协作体高二上学期起点考试
高二化学参考答案
一、选择题
1.C 2.D 3.C 4.A 5.B 6.A 7.B 8.B 9.A 10.A
二、选择題
11.AC 12.C 13.AD 14.BD 15.D
三、非选择题
16.(1)分液漏斗...[1分] 饱和食盐水...[1分]
(2)Cl2+2OH?=ClO?+Cl?+H2O...[2分] 避免生成NaClO3...[2分]
(3)BC...[2分,只答B或C给1分,出现A或D给0分]
(4)过滤...[1分] 洗涤(或答少量冷水洗涤)...[1分]
(5)紫(或紫红)...[1分] 小于...[1分]
17.(1)SiO2...[2分]
(2) Fe3+ + 3OH﹣=Fe(OH)3↓ ...[1分] Al3+ + 4OH﹣= AlO2﹣ + 2H2O ...[1分]
(3)O=C=O ...[2分]
(4)H2S ...[2分]
(5)SO2 + 2H2S = 3S↓ + 2H2O ...[2分]
(6)c ...[2分]
18.(1)CH2=CH2 + Br2 → CH2BrCH2Br ...[2分]
(2)CH2BrCH2Br + 2H2OHOCH2CH2OH + 2HBr ...[2分]
(3)加聚反应 ...[1分] ...[1分]
(4)碳碳双键、羧基 ...[2分,不全给1分,答错给0分]
(5)CH3CH2OH + CH2=CHCOOHCH2=CHCOOCH2CH3 + H2O...[2分,答可逆号也可]
(6)acd ...[2分]
19.(1)化学 ...[1分] < ...[1分]
(2)463 kJ ...[2分]
①正极...[2分] a ...[2分]
②减小 ...[2分]
③CH3OH -6e-+8OH- = CO32-+6H2O ...[2分]
(1)①NO2(g) + CO(g) = CO2(g) + NO(g) △H = - 234 kJ/mol ...[2分]
②减小 ...[2分] 减小 ...[2分]
(2)①PCl3(g) = P(s) + 3/2 Cl2(g) △H= + 306 kJ/mol ...[2分]
② = ...[2分] 由盖斯定理可知,反应热只与起始状态和终了状态有关,所以反应无论是一步完成还是分多步完成,其反应热是相同的。...[2分 只答“盖斯定理”给1分,展开描述盖斯定律给2分。]
同课章节目录
