沪教九年级上册版化学2.2 奇妙的二氧化碳 课件(共27张PPT)
文档属性
| 名称 | 沪教九年级上册版化学2.2 奇妙的二氧化碳 课件(共27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 09:12:41 | ||
图片预览






文档简介
(共27张PPT)
第二章
我们身边的物质
第二节
奇妙的二氧化碳
学习目标
学习目标
1.认识二氧化碳的主要物理性质和化学性质;学会鉴别二氧化碳。
2.学会通过观察实验,从中归纳二氧化碳的某些性质;
3.使用学生理解化合反应和分解反应的概念和特点。
4.了解二氧化碳的循环以及人类生活和生产的意义。
新课讲解
新课讲解
知识点一
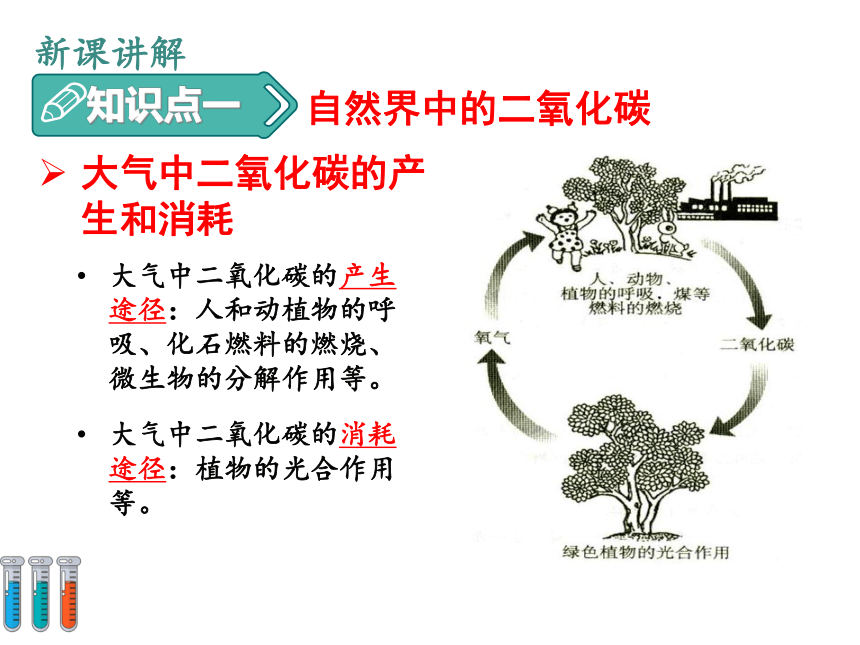
自然界中的二氧化碳
大气中二氧化碳的产生和消耗
大气中二氧化碳的产生途径:人和动植物的呼吸、化石燃料的燃烧、微生物的分解作用等。
大气中二氧化碳的消耗途径:植物的光合作用等。
新课讲解
温室效应
概念
产生原因
危害
防治措施
当大气中二氧化碳等气体的含量升高时,会增强大气对太阳光中红外线辐射的吸收,阻止地球表面的热量向外散发,使地球表面的平均气温上升,这就是所谓的“温室效应”
煤、石油、天然气消耗量急剧增加,向空气中排放大量的二氧化碳,森林遭到破坏,使二氧化碳的吸收量减少,从而造成空气中的二氧化碳含量不断上升
两极冰川融化,海平面上升淹没部分沿海城市;
土地沙漠化,农业减产
减少煤、石油、天然气等化石原料的燃烧;
开发新能源,利用太阳能、风能、地热能等;
大力植树造林,严禁乱砍滥伐森林
新课讲解
知识点二
二氧化碳的奇妙变化
在一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。
干冰升华时,吸收大量的热,因此可以作制冷剂,可用于人工降雨。
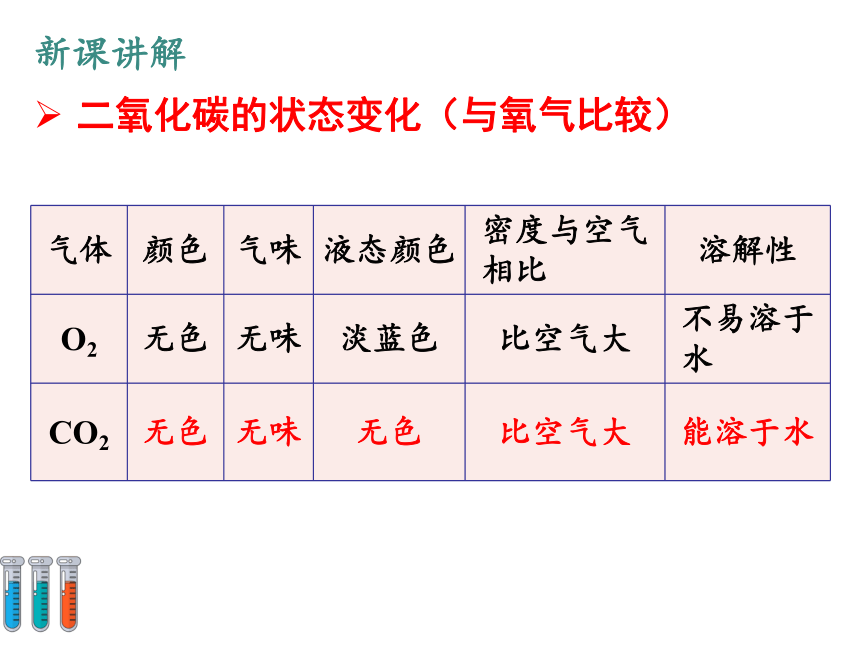
二氧化碳的状态变化
新课讲解
气体
颜色
气味
液态颜色
密度与空气相比
溶解性
O2
无色
无味
淡蓝色
比空气大
不易溶于水
CO2
无色
无味
无色
比空气大
能溶于水
二氧化碳的状态变化(与氧气比较)
新课讲解
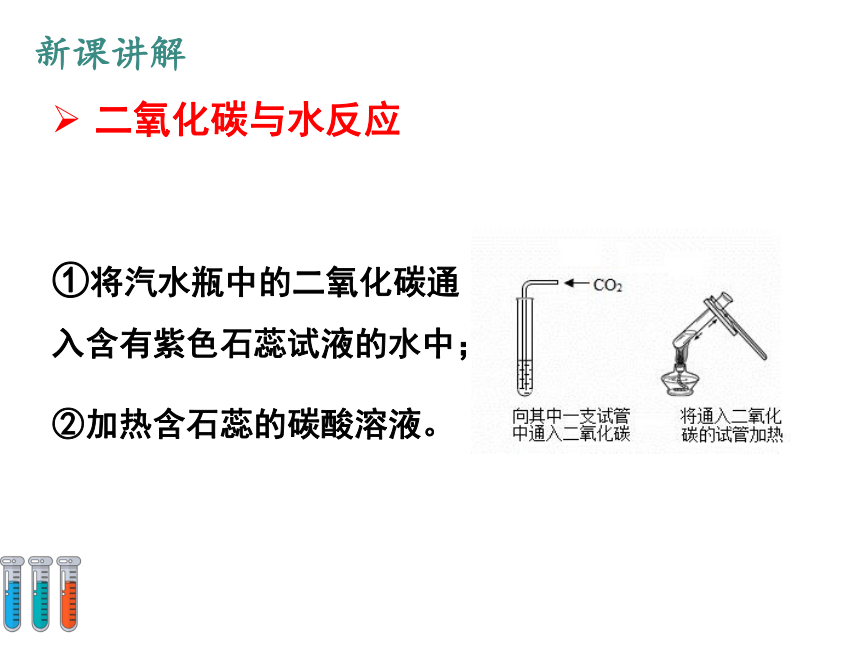
①将汽水瓶中的二氧化碳通入含有紫色石蕊试液的水中;
②加热含石蕊的碳酸溶液。
二氧化碳与水反应
新课讲解
①
②
现象
分析
变红色
紫色石蕊试液遇酸变红
变红色,加热后变回紫色
CO2与H2O反应生成碳酸使紫色石蕊试液变红,碳酸不稳定,受热易分解
二氧化碳与水反应
新课讲解
CO2
H2O
H2CO3
H2CO3
CO2
H2O
二氧化碳与水反应
二氧化碳与水反应生成碳酸的文字表达式为
碳酸不稳定,可分解成二氧化碳和水,其文字表达式为
二氧化碳+水
碳酸
碳酸
二氧化碳+水
新课讲解
知识点三
二氧化碳的制备与利用
实验室制取二氧化碳的理想原料
石灰石(主要成分CaCO3)
碳酸钠粉末(Na2CO3)
稀盐酸(有效成分HCl)
稀硫酸(有效成分H2SO4)
注意事项:
(1)注意仪器的使用和药品的取用;
(2)重点比较反应速率的快慢。
新课讲解
甲
乙
丙
丁
注意:①将半药匙碳酸钠粉末分别放入甲、丁试管中,两至三粒石灰石分别放入乙、丙试管中。②向甲、乙试管中分别倒入1/5试管的稀盐酸,丙、丁试管中分别倒入1/5试管的稀硫酸。
③比较气泡产生的快慢。
反应原理的选择
新课讲解
反应原理的选择
编号
实验内容
实验现象
实验分析
甲
稀盐酸和
碳酸钠粉末
有大量气泡产生,反应剧烈
反应速率太快,不易收集气体
乙
稀盐酸和石灰石
气泡产生速率比较适中
适合用于实验室制取二氧化碳
丙
稀硫酸和石灰石
有气泡产生,反应逐渐减慢直至停止
反应速率慢,不易收集气体
丁
稀硫酸和碳酸钠粉末
有大量气泡产生,反应剧烈
反应速率太快,不易收集气体
新课讲解
稀硫酸与石灰石反应
现象
刚开始有大量气泡产生,一段时间后,气泡逐渐减少,反应逐渐停止
分析
结论
实验室制取二氧化碳不能用稀硫酸代替稀盐酸
虽然该反应能生成二氧化碳,但生成的CaSO4微溶于水,覆盖在大理石表面,形成一层薄膜,使石灰石与酸不能接触,反应难以进行
新课讲解
稀盐酸与碳酸钠粉末反应
现象
反应非常剧烈,短时间内产生大量气泡
分析
碳酸钠粉末的表面积很大,与盐酸接触面积大,反应速率很快,不易控制
结论
实验室不能用碳酸钠粉末或石灰石粉末等粉末状物质制取二氧化碳
新课讲解
实验室制取二氧化碳的反应原理
●药
品
●文字表达式
大理石
(石灰石)
稀盐酸
主要成分
主要成分
CaCO3
HCl
CaCO3
HCl
CaCl2
H2O
CO2
碳酸钙+盐酸
氯化钙+水+二氧化碳
新课讲解
实验室制取二氧化碳能不能用浓盐酸代替稀盐酸?
不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。
新课讲解
发生装置的选择:
反应物的状态
固体和液体
反应条件
不需要加热
实验室制取二氧化碳的装置选择
收集装置的选择:
二氧化碳的密度比空气大;能溶于水,且与水反应,应选择向上排空气法收集。
新课讲解
实验室制取二氧化碳的装置
新课讲解
装置气密性的检查方法:
1.关闭止水夹;
2.从长颈漏斗向锥形瓶中加水,至水面没过长颈漏斗下端;
3.一段时间后若长颈漏斗中液面不再下降,说明装置气密性良好。
实验室制取二氧化碳的装置
新课讲解
长颈漏斗必须液封
导管应在橡皮塞下少许
导管应接近集气瓶底部
防止气体从长颈漏斗口逸出
便于排出气体
能充分排走集气瓶中的空气
?
目的:
实验室制取二氧化碳的装置
装置注意事项:
新课讲解
连接仪器
①
检查气密性
②
加大理石
③
加稀盐酸
④
收集气体
⑤
实验室制取二氧化碳的步骤
新课讲解
二氧化碳的收集
新课讲解
澄清石灰水
变浑浊
火焰熄灭
二氧化碳的检验和验满
新课讲解
实验室制取气体的装置
发生装置
收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件(是否需要加热、加催化剂等)
排空气法
密度比空气大——向上排空气法
密度比空气小——向下排空气法
排水法(不易溶于水、不与水反应)
总结
二氧化碳对人体健康的影响
二氧化碳与人体健康
空气中二氧化碳的体积分数(%)
对人体的影响
0.03
正常
1
有害
4~5
气喘、头晕
>6
死亡
新课讲解
第二章
我们身边的物质
第二节
奇妙的二氧化碳
学习目标
学习目标
1.认识二氧化碳的主要物理性质和化学性质;学会鉴别二氧化碳。
2.学会通过观察实验,从中归纳二氧化碳的某些性质;
3.使用学生理解化合反应和分解反应的概念和特点。
4.了解二氧化碳的循环以及人类生活和生产的意义。
新课讲解
新课讲解
知识点一
自然界中的二氧化碳
大气中二氧化碳的产生和消耗
大气中二氧化碳的产生途径:人和动植物的呼吸、化石燃料的燃烧、微生物的分解作用等。
大气中二氧化碳的消耗途径:植物的光合作用等。
新课讲解
温室效应
概念
产生原因
危害
防治措施
当大气中二氧化碳等气体的含量升高时,会增强大气对太阳光中红外线辐射的吸收,阻止地球表面的热量向外散发,使地球表面的平均气温上升,这就是所谓的“温室效应”
煤、石油、天然气消耗量急剧增加,向空气中排放大量的二氧化碳,森林遭到破坏,使二氧化碳的吸收量减少,从而造成空气中的二氧化碳含量不断上升
两极冰川融化,海平面上升淹没部分沿海城市;
土地沙漠化,农业减产
减少煤、石油、天然气等化石原料的燃烧;
开发新能源,利用太阳能、风能、地热能等;
大力植树造林,严禁乱砍滥伐森林
新课讲解
知识点二
二氧化碳的奇妙变化
在一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。
干冰升华时,吸收大量的热,因此可以作制冷剂,可用于人工降雨。
二氧化碳的状态变化
新课讲解
气体
颜色
气味
液态颜色
密度与空气相比
溶解性
O2
无色
无味
淡蓝色
比空气大
不易溶于水
CO2
无色
无味
无色
比空气大
能溶于水
二氧化碳的状态变化(与氧气比较)
新课讲解
①将汽水瓶中的二氧化碳通入含有紫色石蕊试液的水中;
②加热含石蕊的碳酸溶液。
二氧化碳与水反应
新课讲解
①
②
现象
分析
变红色
紫色石蕊试液遇酸变红
变红色,加热后变回紫色
CO2与H2O反应生成碳酸使紫色石蕊试液变红,碳酸不稳定,受热易分解
二氧化碳与水反应
新课讲解
CO2
H2O
H2CO3
H2CO3
CO2
H2O
二氧化碳与水反应
二氧化碳与水反应生成碳酸的文字表达式为
碳酸不稳定,可分解成二氧化碳和水,其文字表达式为
二氧化碳+水
碳酸
碳酸
二氧化碳+水
新课讲解
知识点三
二氧化碳的制备与利用
实验室制取二氧化碳的理想原料
石灰石(主要成分CaCO3)
碳酸钠粉末(Na2CO3)
稀盐酸(有效成分HCl)
稀硫酸(有效成分H2SO4)
注意事项:
(1)注意仪器的使用和药品的取用;
(2)重点比较反应速率的快慢。
新课讲解
甲
乙
丙
丁
注意:①将半药匙碳酸钠粉末分别放入甲、丁试管中,两至三粒石灰石分别放入乙、丙试管中。②向甲、乙试管中分别倒入1/5试管的稀盐酸,丙、丁试管中分别倒入1/5试管的稀硫酸。
③比较气泡产生的快慢。
反应原理的选择
新课讲解
反应原理的选择
编号
实验内容
实验现象
实验分析
甲
稀盐酸和
碳酸钠粉末
有大量气泡产生,反应剧烈
反应速率太快,不易收集气体
乙
稀盐酸和石灰石
气泡产生速率比较适中
适合用于实验室制取二氧化碳
丙
稀硫酸和石灰石
有气泡产生,反应逐渐减慢直至停止
反应速率慢,不易收集气体
丁
稀硫酸和碳酸钠粉末
有大量气泡产生,反应剧烈
反应速率太快,不易收集气体
新课讲解
稀硫酸与石灰石反应
现象
刚开始有大量气泡产生,一段时间后,气泡逐渐减少,反应逐渐停止
分析
结论
实验室制取二氧化碳不能用稀硫酸代替稀盐酸
虽然该反应能生成二氧化碳,但生成的CaSO4微溶于水,覆盖在大理石表面,形成一层薄膜,使石灰石与酸不能接触,反应难以进行
新课讲解
稀盐酸与碳酸钠粉末反应
现象
反应非常剧烈,短时间内产生大量气泡
分析
碳酸钠粉末的表面积很大,与盐酸接触面积大,反应速率很快,不易控制
结论
实验室不能用碳酸钠粉末或石灰石粉末等粉末状物质制取二氧化碳
新课讲解
实验室制取二氧化碳的反应原理
●药
品
●文字表达式
大理石
(石灰石)
稀盐酸
主要成分
主要成分
CaCO3
HCl
CaCO3
HCl
CaCl2
H2O
CO2
碳酸钙+盐酸
氯化钙+水+二氧化碳
新课讲解
实验室制取二氧化碳能不能用浓盐酸代替稀盐酸?
不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。
新课讲解
发生装置的选择:
反应物的状态
固体和液体
反应条件
不需要加热
实验室制取二氧化碳的装置选择
收集装置的选择:
二氧化碳的密度比空气大;能溶于水,且与水反应,应选择向上排空气法收集。
新课讲解
实验室制取二氧化碳的装置
新课讲解
装置气密性的检查方法:
1.关闭止水夹;
2.从长颈漏斗向锥形瓶中加水,至水面没过长颈漏斗下端;
3.一段时间后若长颈漏斗中液面不再下降,说明装置气密性良好。
实验室制取二氧化碳的装置
新课讲解
长颈漏斗必须液封
导管应在橡皮塞下少许
导管应接近集气瓶底部
防止气体从长颈漏斗口逸出
便于排出气体
能充分排走集气瓶中的空气
?
目的:
实验室制取二氧化碳的装置
装置注意事项:
新课讲解
连接仪器
①
检查气密性
②
加大理石
③
加稀盐酸
④
收集气体
⑤
实验室制取二氧化碳的步骤
新课讲解
二氧化碳的收集
新课讲解
澄清石灰水
变浑浊
火焰熄灭
二氧化碳的检验和验满
新课讲解
实验室制取气体的装置
发生装置
收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件(是否需要加热、加催化剂等)
排空气法
密度比空气大——向上排空气法
密度比空气小——向下排空气法
排水法(不易溶于水、不与水反应)
总结
二氧化碳对人体健康的影响
二氧化碳与人体健康
空气中二氧化碳的体积分数(%)
对人体的影响
0.03
正常
1
有害
4~5
气喘、头晕
>6
死亡
新课讲解
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
