化学反应的焓变.ppt
图片预览






文档简介
(共22张PPT)
专题1
化学反应与能量变化
化学反应的焓变
一、反应热 焓变
1、定义:
2、符号:△H
3、单位:KJ·mol-1
在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。
化学反应过程中放出或吸收的热量叫做化学反应的反应热.
放热反应
吸热反应
化学反应中 热量的反应
化学反应中 热量的反应
二、放热反应和吸热反应
放出
吸收
△H为“-”
△H为“+”
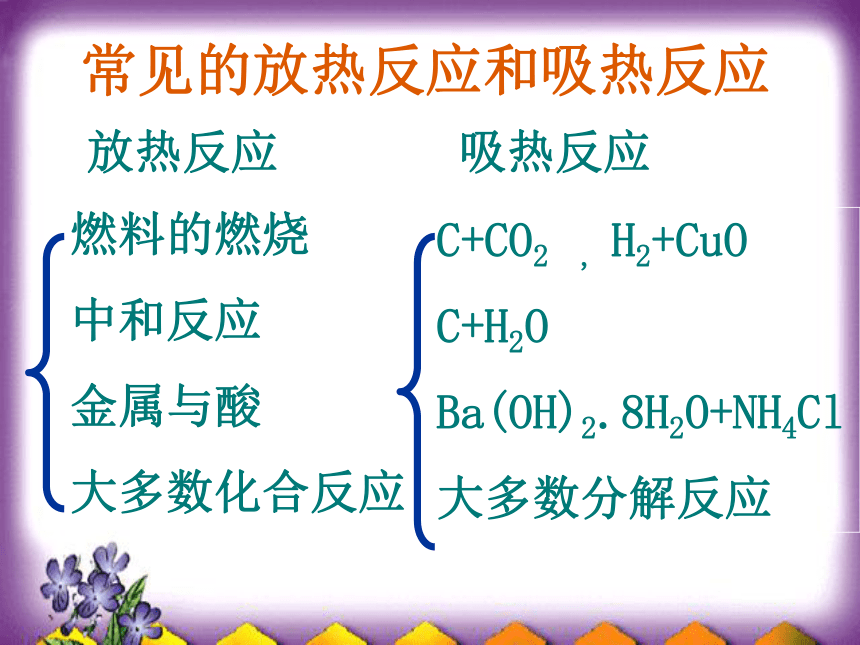
常见的放热反应和吸热反应
放热反应
吸热反应
燃料的燃烧
中和反应
金属与酸
大多数化合反应
C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
大多数分解反应
为什么有的反应会放出热量有的需要吸收热量呢?
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于
。
反应物的总能量与生成物的总能量的相对大小。
生成物
反应物
能量
图1
吸收热量
放出热量
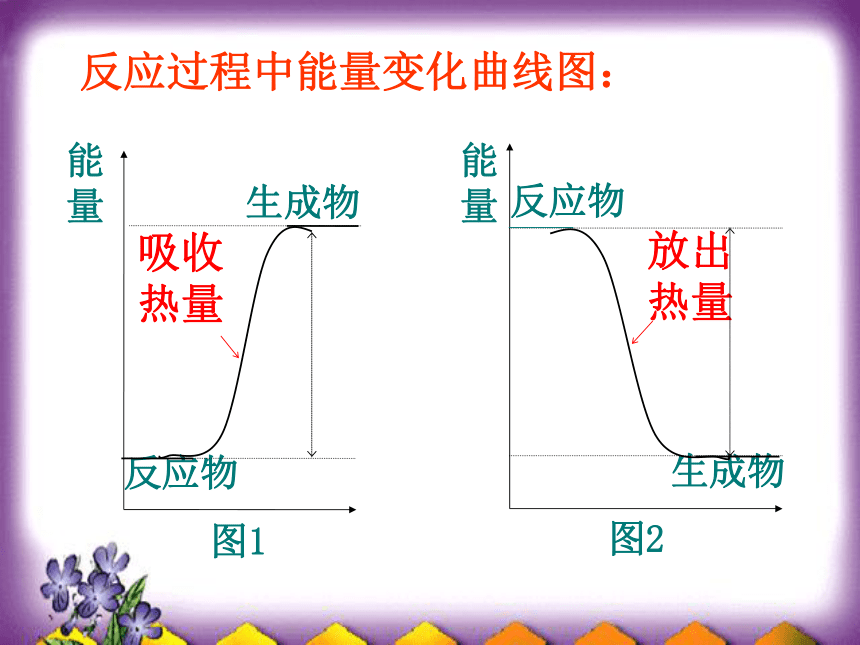
反应过程中能量变化曲线图:
生成物
图2
反应物
能量
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
规 律
化学反应的本质是什么?
旧键断裂和新键形成
旧键断裂需要 能量,新键形成会 能量。
放 出
吸 收
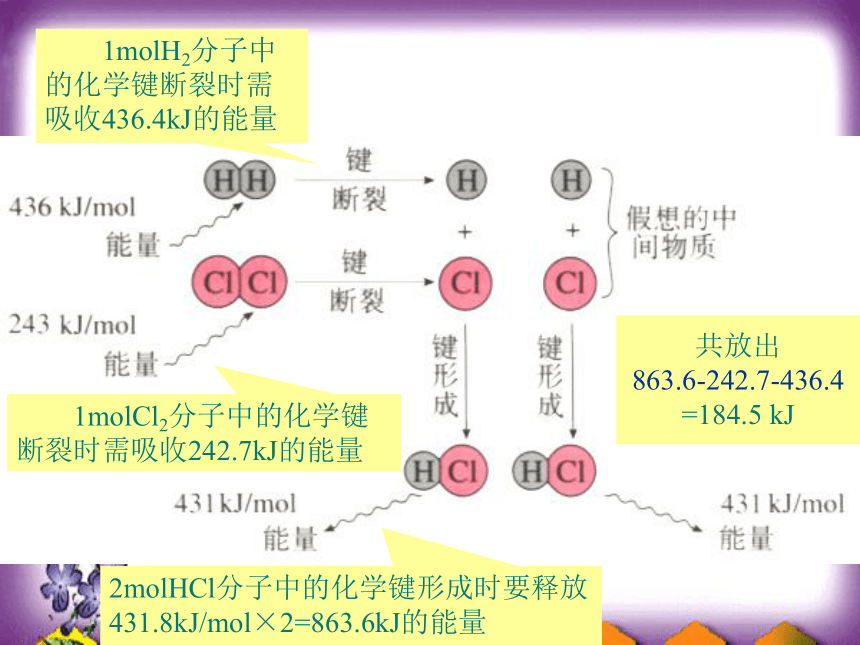
1molH2分子中的化学键断裂时需吸收436.4kJ的能量
1molCl2分子中的化学键断裂时需吸收242.7kJ的能量
2molHCl分子中的化学键形成时要释放431.8kJ/mol×2=863.6kJ的能量
共放出
863.6-242.7-436.4
=184.5 kJ
所以:一个化学反应是放热还是吸热取决于
所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
1、定义:表示化学反应中放出或吸收的热量的化学方程式
三、热化学方程式
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol
H2(g)+ O2(g)=H2O(l) △H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g) △H=-241.8KJ/mol
请观察下列反应热效应的化学方程式,分析其在书写上与化学方程式有何不同。
因为反应放出或吸收的热量的多少与外界的温度和压强有关,若不注明则指101kPa和25℃时的数据。
因为物质的聚集状态不同所含的能量也不同。用g、l、s分别代表气态、液态、固态。
1)要注明温度和压强:
2)反应物和生成物要注明聚集状态:
2、书写热化学方程式应注意以下几点
3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,可以用整数或简单分数表示。
H2(g)+Cl2(g)=2HCl(g) △H=-184.6KJ/mol
H2(g)+ Cl2(g)=HCl(g) △H=-92.3KJ/mol
4)热化学方程式中的△H的“+”与“-”一定要注明。无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成正比。
3、热化学方程式表示的意义
1)表示什么物质参加反应,生成什么物质
2)反应物和生成物之间的物质的量比
3)反应物完全变成生成物后所放出或
吸收的热量。
H2(g)+ O2(g)=H2O(g) △H=-241.8KJ/mol
1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
BC
练 习
2、已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)
△H= - 48.40kJ·mol-1
B、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= - 5518kJ·mol-1
C、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= + 5518kJ·mol-1
D、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= - 48.40kJ·mol-1
B
3、在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. H2(g)+Cl2(g)=2HCl(g) △H=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g) △H=-Q2
B. C(s)+1/2O2(g)=CO (g) △H=-Q1
C(s)+O2(g)=CO2 (g) △H=-Q2
C. 2H2(g)+O2(g)=2H2O(l) △H=-Q1
2H2(g)+O2(g)=2H2O(g) △H=-Q2
D. S(g)+O2(g)=SO2 (g) △H=-Q1
S(s)+O2(g)=SO2 (g) △H=-Q2
B
5.已知热化学方程式:SO2(g)+ O2(g)=SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )。
A. 196.64kJ B. 196.64kJ/mol C. < 196.64kJ D. > 196.64kJ
C
专题1
化学反应与能量变化
化学反应的焓变
一、反应热 焓变
1、定义:
2、符号:△H
3、单位:KJ·mol-1
在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。
化学反应过程中放出或吸收的热量叫做化学反应的反应热.
放热反应
吸热反应
化学反应中 热量的反应
化学反应中 热量的反应
二、放热反应和吸热反应
放出
吸收
△H为“-”
△H为“+”
常见的放热反应和吸热反应
放热反应
吸热反应
燃料的燃烧
中和反应
金属与酸
大多数化合反应
C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
大多数分解反应
为什么有的反应会放出热量有的需要吸收热量呢?
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于
。
反应物的总能量与生成物的总能量的相对大小。
生成物
反应物
能量
图1
吸收热量
放出热量
反应过程中能量变化曲线图:
生成物
图2
反应物
能量
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
规 律
化学反应的本质是什么?
旧键断裂和新键形成
旧键断裂需要 能量,新键形成会 能量。
放 出
吸 收
1molH2分子中的化学键断裂时需吸收436.4kJ的能量
1molCl2分子中的化学键断裂时需吸收242.7kJ的能量
2molHCl分子中的化学键形成时要释放431.8kJ/mol×2=863.6kJ的能量
共放出
863.6-242.7-436.4
=184.5 kJ
所以:一个化学反应是放热还是吸热取决于
所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
1、定义:表示化学反应中放出或吸收的热量的化学方程式
三、热化学方程式
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol
H2(g)+ O2(g)=H2O(l) △H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g) △H=-241.8KJ/mol
请观察下列反应热效应的化学方程式,分析其在书写上与化学方程式有何不同。
因为反应放出或吸收的热量的多少与外界的温度和压强有关,若不注明则指101kPa和25℃时的数据。
因为物质的聚集状态不同所含的能量也不同。用g、l、s分别代表气态、液态、固态。
1)要注明温度和压强:
2)反应物和生成物要注明聚集状态:
2、书写热化学方程式应注意以下几点
3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,可以用整数或简单分数表示。
H2(g)+Cl2(g)=2HCl(g) △H=-184.6KJ/mol
H2(g)+ Cl2(g)=HCl(g) △H=-92.3KJ/mol
4)热化学方程式中的△H的“+”与“-”一定要注明。无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成正比。
3、热化学方程式表示的意义
1)表示什么物质参加反应,生成什么物质
2)反应物和生成物之间的物质的量比
3)反应物完全变成生成物后所放出或
吸收的热量。
H2(g)+ O2(g)=H2O(g) △H=-241.8KJ/mol
1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
BC
练 习
2、已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)
△H= - 48.40kJ·mol-1
B、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= - 5518kJ·mol-1
C、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= + 5518kJ·mol-1
D、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l)
△H= - 48.40kJ·mol-1
B
3、在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. H2(g)+Cl2(g)=2HCl(g) △H=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g) △H=-Q2
B. C(s)+1/2O2(g)=CO (g) △H=-Q1
C(s)+O2(g)=CO2 (g) △H=-Q2
C. 2H2(g)+O2(g)=2H2O(l) △H=-Q1
2H2(g)+O2(g)=2H2O(g) △H=-Q2
D. S(g)+O2(g)=SO2 (g) △H=-Q1
S(s)+O2(g)=SO2 (g) △H=-Q2
B
5.已知热化学方程式:SO2(g)+ O2(g)=SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )。
A. 196.64kJ B. 196.64kJ/mol C. < 196.64kJ D. > 196.64kJ
C
