2020年人教版第二单元《我们周围的空气》2.3制取氧气基础训练
文档属性
| 名称 | 2020年人教版第二单元《我们周围的空气》2.3制取氧气基础训练 |  | |
| 格式 | zip | ||
| 文件大小 | 115.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 15:41:56 | ||
图片预览


文档简介
第二单元2.3制取氧气
一、选择题:
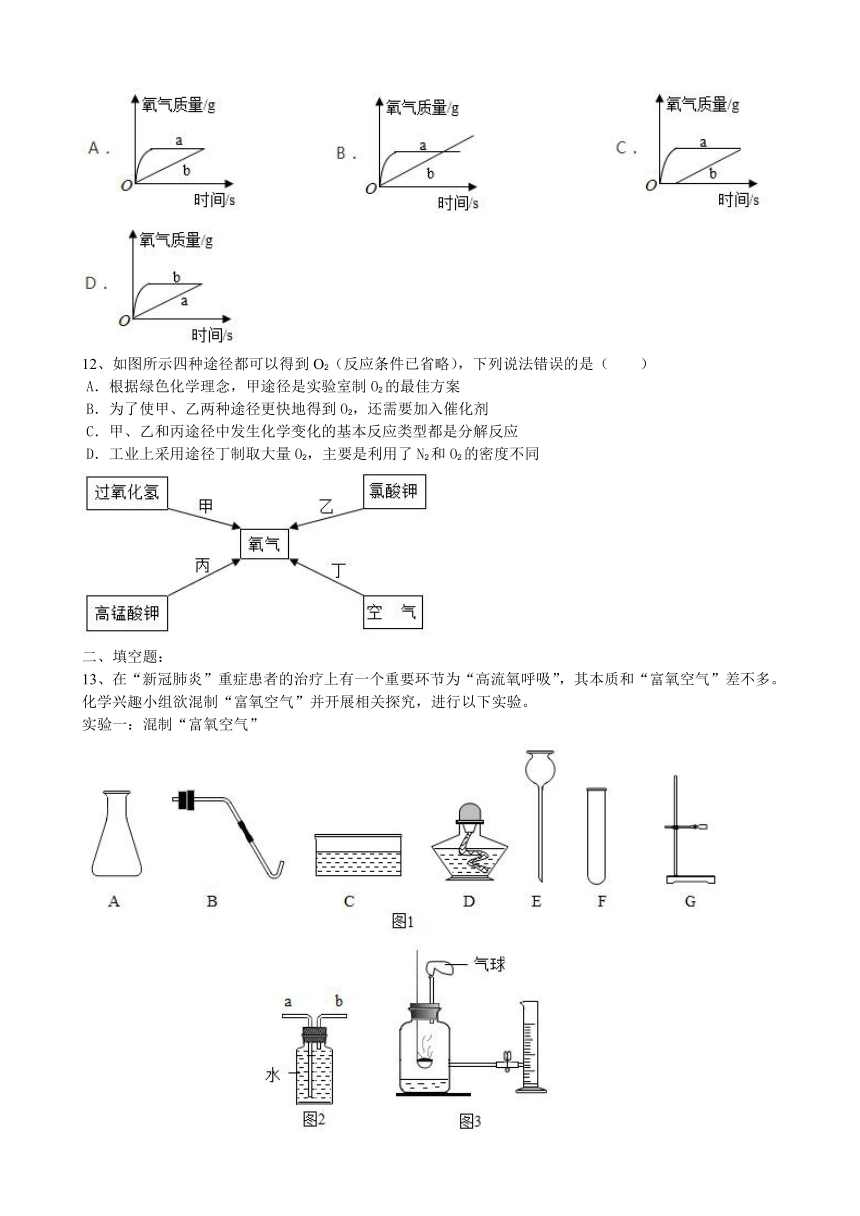
1、实验室用过氧化氢溶液和二氧化锰制取氧气,一定不需要用到的仪器是( )
A、酒精灯
B、水槽
C、集气瓶
D、分液漏斗
2、与氧气有关的实验中错误的是( )
A、制取
B、收集
C、验满
D、性质
3、关于实验室制取氧气,下列说法错误的是( )
A.装置①可用于氯酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
4、如图所示,过氧化氢(H2O2)在催化剂二氧化锰(MnO2)的作用下,迅速分解放出大量氧气,出现的现象是( )
A.气球胀大,红墨水左移
B.气球缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移
5、在进行“氧气的实验室制取与性质”实验时,某同学制得的氧气不纯。你认为可能的原因是( )
A.用排水法收集O2时,集气瓶装满水
B.用向上排空气法收集O2,验满时,将带火星的木条伸入到集气瓶中
C.用排水法收集O2时,导管口连续均匀地冒出气泡,再开始收集
D.用向上排空气法收集O2时,导管伸入到集气瓶的底部
6、实验室用高锰酸钾制取并收集氧气的实验步骤有:
①在试管中加入药品并固定好装置;
②把导管移出水面;
③点燃酒精灯加热,当气泡连续均匀冒出时开始收集;
④熄灭酒精灯;
⑤检查装置的气密性。
正确的顺序是( )
A.①⑤②④
B.⑤①③②④
C.①⑤③④②
D.⑤①③④②
7、关于“加热高锰酸钾制得氧气并用排水法收集”的实验,下列说法正确的是( )
A.制取气体时,先装药品,然后检验装置的气密性
B.反应结束时,先停止加热,然后将导管移出水面
C.导气管口开始产生气泡时,立即用装满水的集气瓶收集气体
D.装有高锰酸钾的试管口要放一小团棉花,目的是防止反应时药品进入导气管
8、推理是学习化学的一种重要方法,但推理必须科学、严谨,下列推理正确的是( )
A.木炭在氧气中能燃烧,所以氧气具有可燃性
B.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
C.工业上分离液态空气可以得到氧气和氮气,因此分离液态空气的过程发生了分解反应
D.冰水共存体中有冰也有水,但它属于纯净物而不是混合物
9、查阅资料得知:马铃薯可代替二氧化锰作过氧化氢溶液分解的催化剂,下列有关催化剂的说法正确的是( )
A.MnO2只能作为过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂能使原本不发生的反应也能快速进行
D.用作催化剂的物质不可能是其它反应的反应物或生成物
10、某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
A.c代表氧气
B.t2时刻,O2开始产生
C.t1时刻,KMnO4开始分解
D.KMnO4质量在反应前后不变
11、现有a、b两份质量相等、浓度相同的过氧化氢溶液,向a中直接加入适量的二氧化锰,而将b缓缓地匀速滴加到适量的二氧化锰中,两份溶液产生氧气的质量与时间的关系对应正确的一项是( )
12、如图所示四种途径都可以得到O2(反应条件已省略),下列说法错误的是( )
A.根据绿色化学理念,甲途径是实验室制O2的最佳方案
B.为了使甲、乙两种途径更快地得到O2,还需要加入催化剂
C.甲、乙和丙途径中发生化学变化的基本反应类型都是分解反应
D.工业上采用途径丁制取大量O2,主要是利用了N2和O2的密度不同
二、填空题:
13、在“新冠肺炎”重症患者的治疗上有一个重要环节为“高流氧呼吸”,其本质和“富氧空气”差不多。化学兴趣小组欲混制“富氧空气”并开展相关探究,进行以下实验。
实验一:混制“富氧空气”
(1)用高锰酸钾制取氧气
①写出反应的文字表达式
;
②仪器名称:C
、E
;
③组装发生装置所需的仪器
(选填标号)(如图1)。
(2)混制“富氧空气”
如图2,用纯氮气及上述实验制取的氧气,混制一瓶(集气瓶容积为250mL)氧气体积分数为40%的“富氧空气”,气体应从装置中的管
(选“a”或“b”)通入,先通入氮气排出120mL水,再通入氧气排出
mL水。
实验二:测定“富氧空气”中氧气的体积分数
用如图3装置测定“富氧空气”中氧气的体积分数(集气瓶中“富氧空气”体积为100mL,底部残留少量水,燃烧匙内有足量红磷)。操作过程如下:
i.往量筒内加入适量水,读出量筒内水的体积为V1mL;
ii.用电点火装置点燃红磷,充分反应;
iii.打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为V2mL。
试回答问题:
(3)气球的作用
;
(4)操作ii中可观察到现象
,反应的文字表达式;
(5)本次实验测得“富氧空气”中氧气的体积分数为
(用含V1、V2的式子表示)。
(6)若读取V1时仰视,读取V2时俯视,则测得实验结果
(选填“偏大”、“偏小”或“无影响”)。
14、工业制取氧气主要有下列步骤。将经过除尘、除二氧化碳、除水的空气进行下列操作:
请据图回答:
(1)工业制氧气属于
(填“物理”或“化学”)变化。
(2)从步骤②可以得出氮气的沸点比氧气的沸点
(填“高”或“低”)。
(3)储存在蓝色钢瓶里的“工业液氧”是
(填“纯净物”或“混合物”)。
(4)液氧和氧气属于同一种物质的原因是
。
15、是不是只有纯净的氧气才能使带火星的木条复燃?为测量能使带火星木条复燃的最低氧气体积分数,同学们设计并完成了探究实验。
①取容积为300mL的集气瓶一个,用注射器注入100mL的水后,倒放入水槽中。
②用导管将纯净的氧气缓缓通入集气瓶,当瓶中水恰好排尽时,移走导管,将集气瓶加盖毛玻璃片后从水槽中取出。
③将带火星的木条伸入集气瓶中,观察木条是否复燃。
④将集气瓶中注水量由100mL改为80mL、60mL、40mL,重复实验步骤。
⑤实验相关数据及现象记录如表,请回答:
集气瓶编号
瓶内预先注入水的体积/mL
瓶内空气体积/mL
瓶内气体中氧气的体积分数/%
木条能否复燃
1
100
200
???????
能
2
80
220
42.1
能
3
60
240
36.8
不能
4
40
260
31.5
不能
(1)表中1号集气瓶内氧气体积分数
(用百分数表示,精确到小数点后1位);
(2)集气瓶中注水量分别为100mL、80mL、60mL、40mL,选择这样有一定数量关系的数值进行实验,好处是
;
(3)可得的实验结论是
;
(4)实验后若想得到更为精确的实验结果,应该进行的操作是
。
16、小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号
KClO3的质量
其他物质的质量
温度
氧气的体积
反应所需时间
①
10.0?g
330℃
100?mL
t1
②
10.0?g
CuO?1.5?g
330℃
100?mL
t2
③
10.0?g
MnO2?1.5?g
330℃
100?mL
t3
④
10.0?g
MnO2
g
380℃
100?mL
t4
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的
和
不变。
(2)写出实验④所涉及的化学反应的文字表达式
。
(3)实验④中MnO2的质量为
g,若t3>t4,则化学反应快慢与温度的关系是
。
(4)氯酸钾的分解速率可能还与
因素有关。
参考答案
一、选择题:
1、A
2、D
3、C
4、D
5、B
6、B
7、D
8、D
9、B
10、C
11、A
12、D
二、填空题:
13、答案:(1)①高锰酸钾锰酸钾+二氧化锰+氧气;
②水槽;长颈漏斗;
③BDFG;
(2)b;80;
(3)调节装置内的压强;
(4)剧烈燃烧,产生大量白烟,放出大量的热;红磷+氧气五氧化二磷;
(5);
(6)偏小。
14、答案:
(1)物理;(2)低;(3)混合物;(4)都是由氧分子构成的。
15、答案:(1)47.3%。
(2)可以简单有效的改变氧气的体积分数。
(3)能使带火星木条复燃的氧气体积分数需要不低于42.1%。
(4)将集气瓶中注水量改为60mL到80mL之间,重复实验步骤,观察实验现象。
16、答案:(1)质量;化学性质;
(2)氯酸钾氯化钾+氧气;
(3)1.5;温度越高,反应速率越快;
(4)接触面积。
一、选择题:
1、实验室用过氧化氢溶液和二氧化锰制取氧气,一定不需要用到的仪器是( )
A、酒精灯
B、水槽
C、集气瓶
D、分液漏斗
2、与氧气有关的实验中错误的是( )
A、制取
B、收集
C、验满
D、性质
3、关于实验室制取氧气,下列说法错误的是( )
A.装置①可用于氯酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
4、如图所示,过氧化氢(H2O2)在催化剂二氧化锰(MnO2)的作用下,迅速分解放出大量氧气,出现的现象是( )
A.气球胀大,红墨水左移
B.气球缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移
5、在进行“氧气的实验室制取与性质”实验时,某同学制得的氧气不纯。你认为可能的原因是( )
A.用排水法收集O2时,集气瓶装满水
B.用向上排空气法收集O2,验满时,将带火星的木条伸入到集气瓶中
C.用排水法收集O2时,导管口连续均匀地冒出气泡,再开始收集
D.用向上排空气法收集O2时,导管伸入到集气瓶的底部
6、实验室用高锰酸钾制取并收集氧气的实验步骤有:
①在试管中加入药品并固定好装置;
②把导管移出水面;
③点燃酒精灯加热,当气泡连续均匀冒出时开始收集;
④熄灭酒精灯;
⑤检查装置的气密性。
正确的顺序是( )
A.①⑤②④
B.⑤①③②④
C.①⑤③④②
D.⑤①③④②
7、关于“加热高锰酸钾制得氧气并用排水法收集”的实验,下列说法正确的是( )
A.制取气体时,先装药品,然后检验装置的气密性
B.反应结束时,先停止加热,然后将导管移出水面
C.导气管口开始产生气泡时,立即用装满水的集气瓶收集气体
D.装有高锰酸钾的试管口要放一小团棉花,目的是防止反应时药品进入导气管
8、推理是学习化学的一种重要方法,但推理必须科学、严谨,下列推理正确的是( )
A.木炭在氧气中能燃烧,所以氧气具有可燃性
B.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
C.工业上分离液态空气可以得到氧气和氮气,因此分离液态空气的过程发生了分解反应
D.冰水共存体中有冰也有水,但它属于纯净物而不是混合物
9、查阅资料得知:马铃薯可代替二氧化锰作过氧化氢溶液分解的催化剂,下列有关催化剂的说法正确的是( )
A.MnO2只能作为过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂能使原本不发生的反应也能快速进行
D.用作催化剂的物质不可能是其它反应的反应物或生成物
10、某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
A.c代表氧气
B.t2时刻,O2开始产生
C.t1时刻,KMnO4开始分解
D.KMnO4质量在反应前后不变
11、现有a、b两份质量相等、浓度相同的过氧化氢溶液,向a中直接加入适量的二氧化锰,而将b缓缓地匀速滴加到适量的二氧化锰中,两份溶液产生氧气的质量与时间的关系对应正确的一项是( )
12、如图所示四种途径都可以得到O2(反应条件已省略),下列说法错误的是( )
A.根据绿色化学理念,甲途径是实验室制O2的最佳方案
B.为了使甲、乙两种途径更快地得到O2,还需要加入催化剂
C.甲、乙和丙途径中发生化学变化的基本反应类型都是分解反应
D.工业上采用途径丁制取大量O2,主要是利用了N2和O2的密度不同
二、填空题:
13、在“新冠肺炎”重症患者的治疗上有一个重要环节为“高流氧呼吸”,其本质和“富氧空气”差不多。化学兴趣小组欲混制“富氧空气”并开展相关探究,进行以下实验。
实验一:混制“富氧空气”
(1)用高锰酸钾制取氧气
①写出反应的文字表达式
;
②仪器名称:C
、E
;
③组装发生装置所需的仪器
(选填标号)(如图1)。
(2)混制“富氧空气”
如图2,用纯氮气及上述实验制取的氧气,混制一瓶(集气瓶容积为250mL)氧气体积分数为40%的“富氧空气”,气体应从装置中的管
(选“a”或“b”)通入,先通入氮气排出120mL水,再通入氧气排出
mL水。
实验二:测定“富氧空气”中氧气的体积分数
用如图3装置测定“富氧空气”中氧气的体积分数(集气瓶中“富氧空气”体积为100mL,底部残留少量水,燃烧匙内有足量红磷)。操作过程如下:
i.往量筒内加入适量水,读出量筒内水的体积为V1mL;
ii.用电点火装置点燃红磷,充分反应;
iii.打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为V2mL。
试回答问题:
(3)气球的作用
;
(4)操作ii中可观察到现象
,反应的文字表达式;
(5)本次实验测得“富氧空气”中氧气的体积分数为
(用含V1、V2的式子表示)。
(6)若读取V1时仰视,读取V2时俯视,则测得实验结果
(选填“偏大”、“偏小”或“无影响”)。
14、工业制取氧气主要有下列步骤。将经过除尘、除二氧化碳、除水的空气进行下列操作:
请据图回答:
(1)工业制氧气属于
(填“物理”或“化学”)变化。
(2)从步骤②可以得出氮气的沸点比氧气的沸点
(填“高”或“低”)。
(3)储存在蓝色钢瓶里的“工业液氧”是
(填“纯净物”或“混合物”)。
(4)液氧和氧气属于同一种物质的原因是
。
15、是不是只有纯净的氧气才能使带火星的木条复燃?为测量能使带火星木条复燃的最低氧气体积分数,同学们设计并完成了探究实验。
①取容积为300mL的集气瓶一个,用注射器注入100mL的水后,倒放入水槽中。
②用导管将纯净的氧气缓缓通入集气瓶,当瓶中水恰好排尽时,移走导管,将集气瓶加盖毛玻璃片后从水槽中取出。
③将带火星的木条伸入集气瓶中,观察木条是否复燃。
④将集气瓶中注水量由100mL改为80mL、60mL、40mL,重复实验步骤。
⑤实验相关数据及现象记录如表,请回答:
集气瓶编号
瓶内预先注入水的体积/mL
瓶内空气体积/mL
瓶内气体中氧气的体积分数/%
木条能否复燃
1
100
200
???????
能
2
80
220
42.1
能
3
60
240
36.8
不能
4
40
260
31.5
不能
(1)表中1号集气瓶内氧气体积分数
(用百分数表示,精确到小数点后1位);
(2)集气瓶中注水量分别为100mL、80mL、60mL、40mL,选择这样有一定数量关系的数值进行实验,好处是
;
(3)可得的实验结论是
;
(4)实验后若想得到更为精确的实验结果,应该进行的操作是
。
16、小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号
KClO3的质量
其他物质的质量
温度
氧气的体积
反应所需时间
①
10.0?g
330℃
100?mL
t1
②
10.0?g
CuO?1.5?g
330℃
100?mL
t2
③
10.0?g
MnO2?1.5?g
330℃
100?mL
t3
④
10.0?g
MnO2
g
380℃
100?mL
t4
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的
和
不变。
(2)写出实验④所涉及的化学反应的文字表达式
。
(3)实验④中MnO2的质量为
g,若t3>t4,则化学反应快慢与温度的关系是
。
(4)氯酸钾的分解速率可能还与
因素有关。
参考答案
一、选择题:
1、A
2、D
3、C
4、D
5、B
6、B
7、D
8、D
9、B
10、C
11、A
12、D
二、填空题:
13、答案:(1)①高锰酸钾锰酸钾+二氧化锰+氧气;
②水槽;长颈漏斗;
③BDFG;
(2)b;80;
(3)调节装置内的压强;
(4)剧烈燃烧,产生大量白烟,放出大量的热;红磷+氧气五氧化二磷;
(5);
(6)偏小。
14、答案:
(1)物理;(2)低;(3)混合物;(4)都是由氧分子构成的。
15、答案:(1)47.3%。
(2)可以简单有效的改变氧气的体积分数。
(3)能使带火星木条复燃的氧气体积分数需要不低于42.1%。
(4)将集气瓶中注水量改为60mL到80mL之间,重复实验步骤,观察实验现象。
16、答案:(1)质量;化学性质;
(2)氯酸钾氯化钾+氧气;
(3)1.5;温度越高,反应速率越快;
(4)接触面积。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
